CXCL3/CXCR2调节乳腺癌细胞上皮-间质转化的作用机制研究
2021-02-28李文燕祝迪薇顾艳玲周晓红王瑾
李文燕 祝迪薇 顾艳玲 周晓红 王瑾
趋化因子3(chemokines 3,CXCL3)是一种单链蛋白质,属于CXC 趋化因子家族。在机体稳态条件下,CXCL3 可以由多种细胞产生[1-2]。趋化因子受体2(chemokine receptor 2,CXCR2)是CXCL3 的一个重要受体,CXCL3/CXCR2 中,CXCL3 可以激活CXCR2,介导下游信号的激活,调控细胞迁移、侵袭等,且CXCL3/CXCR2 与多种疾病相关[3-4],其在肿瘤的发生、发展中起重要作用。CXCL3 作为肿瘤诱导因子,可促进肿瘤细胞的趋化,激活G 蛋白偶联受体,诱导钙动员和细胞外调节蛋白激酶磷酸化,抑制腺苷酸环化酶激活剂活化,降低环腺苷酸水平,从而参与肿瘤的发生、发展[5-6],但是目前在乳腺癌的研究中鲜有CXCL3/CXCR2 的报道。上皮-间质转化(epithelial-mesenchymal transformation,EMT)是肿瘤重要的特征之一,它在人体发育过程中起着关键的作用,而且还参与组织愈合、器官纤维化和癌症发生等过程[7-8]。在肿瘤的发生、发展中,转化生长因子-β(transforming growth factor-β,TGF-β)可以抑制细胞的凋亡,诱导Snail 的表达,Snail 是EMT 的重要调控因子,而EMT 的发生与肿瘤细胞的趋化能力有着重要的关系[9]。因此,本研究探讨CXCL3/CXCR2 调节乳腺癌细胞EMT 的作用机制。
1 材料和方法
1.1 主要试剂和仪器 人乳腺癌细胞株MCF-7(批号:CL-0149)购自武汉普诺赛生命科技有限公司,重组人CXCL3 蛋白(批号:RPB604Hu01)购自武汉云克隆科技有限公司,CXCR2 抑制剂IN-1(批号:101022)购自上海MCE 公司,CCK-8 检测试剂盒(批号:C0037)购自碧云天生物技术有限公司,N-钙黏蛋白(N-cadherin)、β-连环蛋白(β-catenin)、波形蛋白(vimentin)、CXCR2 及E-钙黏蛋白(E-cadherin)(批号:13116、12475、5741、12671、14472)单克隆抗体购自美国cell signaling technology 公司,PI 染色的细胞周期检测试剂盒(批号:S21522)购自美国BD 公司,Transwell 小室购自康宁公司,酶标仪(型号:Multuskan Go 1510)购自美国Thermo 公司,显微镜(Olympusix71)购自德国徕卡公司,流式细胞仪(FASCC)购自美国BD 公司。
1.2 方法
1.2.1 细胞实验及分组 在CXCL3 对于乳腺癌细胞作用的实验中,将MCF-7 细胞分为对照组A 和CXCL3组A,对照组A 为常规培养的MCF-7 细胞,而CXCL3组A 为加入10 ng/L CXCL3 干预的MCF-7 细胞。在IN-1 干预的实验中,将MCF-7 细胞分为对照组B、CXCL3 组B 和IN-1 组,对照组B 为常规培养的细胞,CXCL3 组B 为加入10 ng/L CXCL3 干预的MCF-7 细胞,而IN-1 组为同时加入10 μM IN-1 和10 ng/L CXCL3干预的MCF-7 细胞。
1.2.2 细胞周期检测 细胞分组后接种在6 孔板中,分别用CXCL3 和IN-1 进行干预,培养24 h 后用胰蛋白酶消化,PBS 洗2~3 次后,3 000 r/min 离心10 min,取细胞,加入50 μl PI 染液避光染色15 min,将细胞转移到流式管中,上机检测。
1.2.3 细胞增殖能力检测 采用CCK-8 法。细胞接种到96 孔板中,待细胞贴壁后,加入CXCL3 或IN-1 进行干预,于6、12、24、48 h 检测细胞增殖能力。在96 孔板中加入10 μl CCK-8 溶液继续孵育4 h。轻轻摇匀培养板后,在450 nm 处检测吸光度(OD)值,同时设置空白培养基为对照。细胞增殖能力=(OD实验组-OD对照)/(OD初始-OD对照)×100%。
1.2.4 平板克隆形成实验 细胞生长至对数期后,消化细胞,调整细胞浓度为1 000 个/孔,接种到6 孔板中,同时采用含有30%FBS 的DMEM 培养基培养2 周,待细胞形成克隆后,弃去培养基,PBS 清洗2 次后加入多聚甲醛固定,结晶紫染色,PBS 洗2~3 次,拍照后计算克隆形成数。
1.2.5 细胞侵袭能力检测 细胞加入Transwell 上层的小室,待细胞贴壁后,加入无血清的DMEM 培养基进行细胞培养,同时在上层的DMEM 培养基中加入CXCL-3 或IN-1 进行干预,而下层小室中加入含20%FBS 的DMEM 完全培养基。细胞培养24 h 进行侵袭后取出,用甲醇固定、0.1%结晶紫染色,镜下计算侵袭细胞数。
1.2.6 EMT 相关蛋白表达水平检测 采用Western blot。细胞培养48 h 后,收集细胞并用PBS 洗2 次后,RIPA+PMSF 蛋白裂解液冰上裂解细胞30 min,3 000 r/min离心后取上清液,加入等体积的上样缓冲液煮沸后采用SDS-PAGE 凝胶进行电泳分离,PVDF 转膜后用脱脂奶粉进行封闭,之后用稀释的N-cadherin、βcatenin、vimentin、CXCR2、E-cadherin 单克隆抗体4 ℃过夜孵育,孵育后采用TBST 漂洗后加入IgG-HRP二抗孵育,ECL 显色液显色后,成像系统成像,并用凝胶定量分析软件Quantity One 4.4 进行相对表达量的测定。
1.3 统计学处理 采用SPSS 17.0 统计软件。计量资料以表示,两组间比较采用两独立样本t 检验;多组间比较采用单因素方差分析,两两比较采用LSD-t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 CXCL3 对于MCF-7 细胞周期的影响 对照组A细胞中G0/G1 期的比例为(82.44±4.18)%,S/M+G2 期为(17.43±2.87)%;CXCL3 组A 细胞中G0/G1 期的比例为(74.54±4.43)%,S/M+G2 期为(25.87±3.42)%;两组比较差异有统计学意义(P<0.05),见图1a。而IN-1 干预后,IN-1 组细胞中G0/G1 期的比例为(79.44±4.21)%,S/M+G2 期为(22.54±2.32)%;CXCL3 组B 细胞中G0/G1 期的比例为(84.23±3.11)%,S/M+G2 期为(15.43±3.11)%;对照组B 细胞中G0/G1 期的比例为(76.43±2.87)%,S/M+G2 期为(21.11±3.42)%;3 组比较差异有统计学意义(P<0.05);两两比较发现,与CXCL3 组B 比较,IN-1组细胞中G0/G1 期的比例下降(P<0.05),见图1b。
2.2 CXCL3 对于MCF-7 细胞增殖能力的影响 与对照组A 同一时间点比较,CXCL3 组A 细胞增殖能力明显上升(均P<0.05),提示CXCL3 干预后可以明显提高MCF-7 细胞增殖能力,见图2a。而IN-1 干预后,与CXCL3 组B 同一时间点比较,IN-1 组细胞增殖能力明显下降(均P<0.05),见图2b。
2.3 CXCL3 对于MCF-7 细胞平板克隆形成的影响与对照组A 克隆形成数(45.87±8.12)比较,CXCL3 组A细胞平板克隆形成数(78.43±12.12)明显增加(P<0.05),见图3a。而IN-1 干预后,与CXCL3 组B 平板克隆形成数(88.43±11.54)比较,IN-1 组细胞平板克隆形成数(50.54±11.54)明显减少(P<0.05),见图3b。
2.4 CXCL3 对于MCF-7 细胞侵袭能力的影响 与对照组A 侵袭细胞数(68.87±18.54)比较,CXCL3 组A 侵袭细胞数(135.65±17.65)明显增加(P<0.05),见图4a。而IN-1 干预后,与CXCL3 组B 侵袭细胞数(129.65±20.54)比较,IN-1 组侵袭细胞数(69.12±14.54)明显减少(P<0.05),见图4b。

图1 趋化因子3(CXCL3)对于MCF-7 细胞周期改变的影响[a:CXCL3 对于MCF-7 细胞周期的影响;b:抑制趋化因子受体2(CXCR2)后,CXCL3 对于MCF-7 细胞周期的影响]

图2 趋化因子3(CXCL3)对于MCF-7 细胞增殖能力的影响[a:CXCL3 对于MCF-7 细胞增殖能力的影响,与对照组A 同一时间点比较,*P<0.05;b:抑制趋化因子受体2(CXCR2)后,CXCL3 对于MCF-7 细胞增殖能力的影响,与对照组B 同一时间点比较,*P<0.05;与CXCL3 组B 比较,△P<0.05]
2.5 CXCL-3 对于EMT 相关蛋白表达的影响 与对照组A 比较,CXCL3 组A 细胞N-cadherin、β-catenin、vimentin、CXCR2 表达水平均上调,E-cadherin 表达水平下调,差异均有统计学意义(均P<0.05)。而IN-1 干预后,与CXCL3 组B 比较,IN-1 组细胞N-cadherin、βcatenin、vimentin、CXCR2 表达水平均下调,E-cadherin表达水平上调,差异均有统计学意义(均P<0.05),见图5。
3 讨论

图3 趋化因子3(CXCL3)对于MCF-7 细胞克隆形成能力的影响[a:CXCL3 对于MCF-7 细胞克隆形成的影响;b:抑制趋化因子受体2(CXCR2)后,CXCL3 对于MCF-7 细胞克隆形成的影响]

图4 趋化因子3(CXCL3)对于MCF-7 细胞侵袭能力的影响[a:CXCL3 对于MCF-7 细胞侵袭能力的影响;b:抑制趋化因子受体2(CXCR2)后,CXCL3 对于MCF-7 细胞侵袭能力的影响]
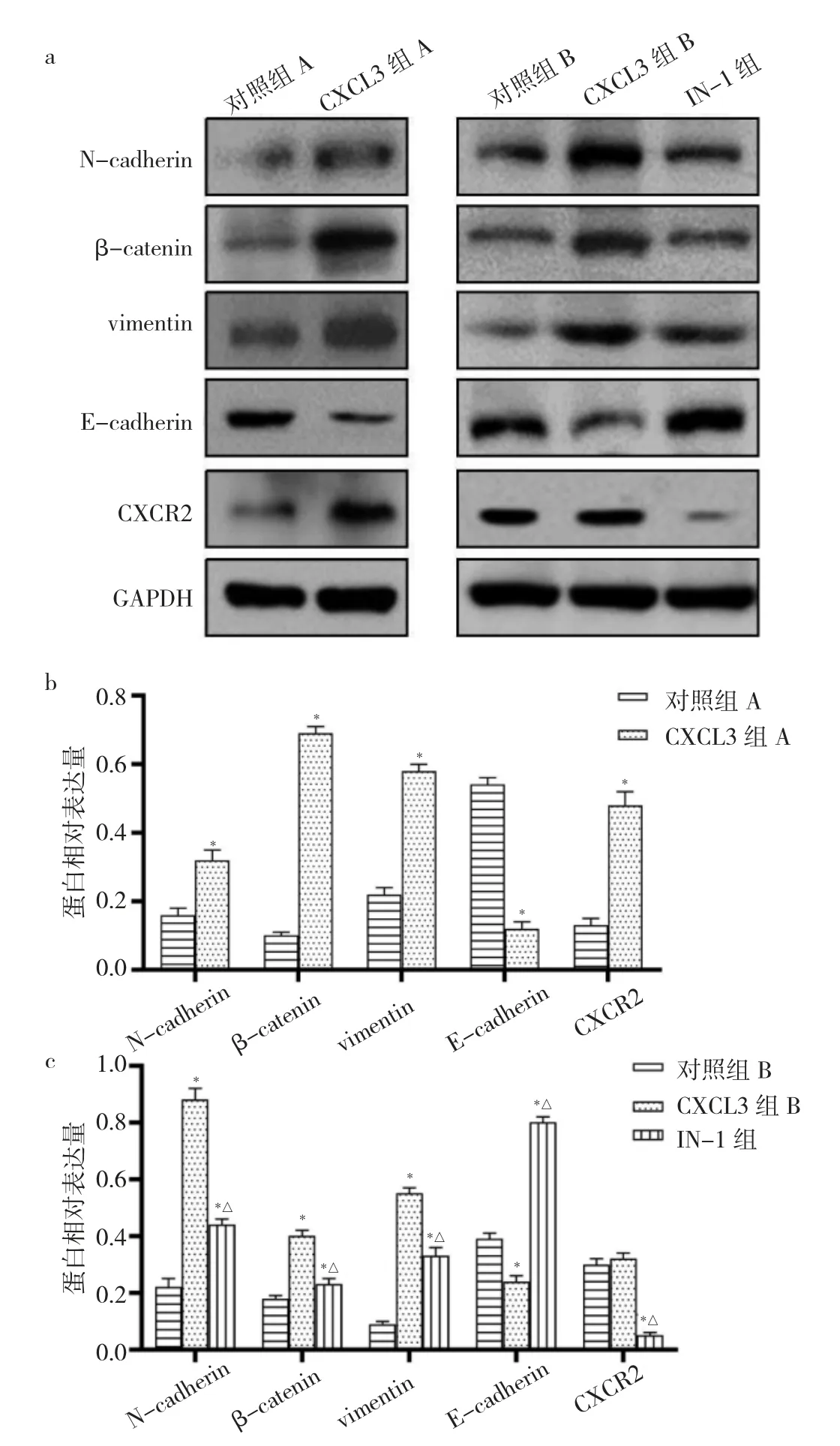
图5 CXCL3 对于MCF-7 EMT 相关蛋白的影响[a:EMT 相关蛋白表达的电泳图;b:对照组A 和CXCL3 组A 细胞EMT 相关蛋白表达水平比较,与对照组A 比较,*P<0.05;c:对照组B、CXCL3 组B 和IN-1 组细胞EMT 相关蛋白表达水平比较,与对照组B 比较,*P<0.05;与CXCL3 组B 比较,△P<0.05;CXCL3 为趋化因子3;N-cadherin 为N-钙黏蛋白;β-catenin 为β-连环蛋白;vimentin为波形蛋白;E-cadherin 为E-钙黏蛋白;CXCR2 为趋化因子受体2;EMT 为上皮-间质转化]
趋化因子是一类细胞因子的超家族,具有激活和趋化白细胞的作用,它的不同趋化因子在许多疾病的发生、发展中均有重要的作用[10]。尤其是肿瘤的发生、发展过程中,趋化因子表现出双刃剑的作用:一部分趋化因子可能增强宿主抗肿瘤侵入的固有或特异性免疫反应,另一部分可能通过促进肿瘤细胞的增殖和肿瘤血管的生成,发挥促进肿瘤的生长和转移的作用[11]。趋化因子受体是一类表达于细胞膜上的,与趋化因子结合的,含有7 个跨膜区的G 蛋白耦联受体。根据其所结合的配体可将趋化因子受体分为CXC 受体、CC 受体、XC 受体、CX3C 受体4 个亚家族。趋化因子与趋化因子受体结合后,可以参与多种生理和病理过程,如细胞的生长、发育、分化、凋亡、组织损伤、肿瘤的生长和转移等[12-13]。肿瘤的侵袭和转移又以EMT 为基础。EMT 是指上皮细胞在形态学上向间质细胞转变的过程,同时获得迁移的能力。肿瘤细胞在EMT 的过程中发生了明显变化,主要是肿瘤细胞极性改变,与周围细胞和基质细胞联系接触减少。EMT 在肿瘤的转移、侵袭过程中也起到重要的作用。β-catenin 是经典的调节EMT 的信号通路,其作用和β-catenin 的磷酸化/降解有关[14],β-catenin 与E-cadherin 和骨架蛋白的稳态有关,E-cadherin 表达水平是EMT 主要的标志物,同时vimentin 蛋白也在大部分肿瘤EMT 过程中高表达[15-16]。CXCL3 是一种趋化因子,其受体主要是CXCR2,在临床研究中已经发现CXCL3 和CXCR2 在多种肿瘤中高表达,但是机制尚未明确。
乳腺癌是一种高转移高致死率的恶性肿瘤,乳腺癌经常发生骨转移和脑转移,转移的机制较为复杂。本实验体外培养了MCF-7 细胞,并用重组人CXCL3 蛋白进行干预,结果发现CXCL3 蛋白干预后明显提高了MCF-7 细胞的增殖能力,同时促进了细胞周期的改变。在EMT 发生的过程中,细胞具有高增殖能力是EMT 发生的先决条件,而CXCL3 可以促进细胞增殖。在转移和侵袭的实验中也发现,CXCL3 可以促进细胞侵袭,同时提高细胞克隆形成能力,这与EMT 的发生相关。在机制的检测中发现,CXCL3 可以上调EMT 标志蛋白N-cadherin、β-catenin、vimentin 的表达,同时下调E-cadherin,这说明,细胞对于基质的黏附能力下降,具备了转移和侵袭的能力。CXCR2 作为CXCL3 的受体,在CXCL3 的作用中也扮演着重要的角色,本实验用IN-1 干预后,发现CXCR2 抑制后可以明显抑制CXCL3 的作用,细胞增殖能力下调,同时侵袭能力也下调,最关键的是可以抑制EMT 相关蛋白的表达。这说明CXCL3 是通过CXCR2 发挥作用的。
综上所述,本实验发现CXCL3/CXCR2 的激活可以促进乳腺癌EMT,这有望成为乳腺癌治疗的新靶点。
