NHE-1蛋白和V-ATPase在胃癌及癌前病变组织中的表达及临床意义
2021-02-28胡业晓朱仁武张煜程陈旭晨赵茂森
胡业晓 朱仁武 张煜程 陈旭晨 赵茂森
Na+/H+交换蛋白-1(Na+/H+exchanger 1,NHE-1)是调节细胞内pH 的重要跨膜蛋白,它以胞内一个H+,胞外一个Na+进行等分子比例的跨膜交换,排出细胞内H+,从而维持细胞内pH 的稳定,同时调节细胞内渗透压和细胞体积[1]。空泡型质子ATP 酶(vacuolar H+-ATPase,V-ATPase)广泛分布于真核细胞的囊泡膜和细胞膜上,依赖ATP 逆浓度梯度将H+泵出细胞外或泵入细胞器囊泡腔内[2]。两者共同维持细胞内pH 的稳定。细胞内pH 稳定是维持细胞正常功能的前提,当细胞内开始出现酸化时,随着酸化程度的不断加深,正常细胞会出现凋亡和坏死。近年来研究表明,NHE-1 蛋白和VATPase 在肿瘤细胞中的活性表达水平明显增高,与肿瘤的发生密切相关[3-6]。本研究分析NHE-1 蛋白和VATPase 在胃癌和癌前病变组织中的表达差异,探讨两者在胃癌组织中不同程度的表达与临床病理特征的关系、两者在胃癌组织中表达的相关性及对胃癌患者预后生存时间的临床意义。
1 对象和方法
1.1 对象 收集2014 年1 月至2019 年12 月在温州市中西医结合医院行胃镜检查时采取的胃黏膜组织标本及行胃癌手术采取的胃癌组织标本共320 例,其中原发性胃癌标本152 例,正常胃黏膜标本55 例,癌前病变组织113 例(慢性萎缩性胃炎42 例、肠上皮化生30 例、异型增生41 例)。胃镜标本取自胃窦部及胃内病变部位,胃癌标本取自手术切除后的胃癌组织,均经过HE染色病理检查证实。纳入标准:(1)符合胃癌及癌前病变的诊断标准,且经临床表现、影像学检查及胃镜、手术后病理证实为胃癌及癌前病变;(2)均行胃癌手术及胃镜治疗;(3)年龄≤80 岁且能耐受手术治疗;(4)可以获得长期随访。排除标准:(1)临床资料不完整或不能完成随访者;(2)合并有其他重要脏器疾病或不能耐受手术者。本研究经医院医学伦理委员会审批通过,所有患者均签署知情同意书。
1.2 NHE-1 蛋白及V-ATPase 表达水平检测 采用免疫组化SP 染色法。制作4 μm 厚石蜡切片,常规脱蜡至水。3%H2O2孵育以消除内源性过氧化物酶活性。10%正常山羊血清封闭,加入一抗(1∶250 抗NHE-1 抗体、1∶250 抗V-ATPase 抗体)4 ℃过夜。第二天滴加生物素标记的二抗(抗NHE-1 蛋白抗体、抗V-ATPase 抗体),滴加辣根酶标记的链霉卵白素,DAB 显色。自来水充分冲洗,苏木素复染,梯度乙醇脱水,二甲苯透明和树胶封片,显微镜下观察NHE-1 蛋白和V-ATPase 表达的特点和阳性定位。抗NHE-1 蛋白抗体及抗V-ATPase 抗体试剂盒均购自美国圣克鲁斯生物技术公司。
1.3 观察指标 阳性细胞表现为黄色至棕褐色颗粒,NHE-1 蛋白及V-ATPase 主要表达于细胞膜上和细胞质中。在光学显微镜下,每张切片随机观察5 个高倍视野(×400),每个视野计数200 个细胞进行评分和记录。阳性细胞百分比:无阳性细胞为0 分,<10%为1 分,10%~50%为2 分,51%~100%为3 分。染色强度:无显色为0 分,黄色为1 分,棕黄色为2 分,棕褐色为3 分。两者表达的总评分为染色强度和阳性细胞百分比之和:0~2 分为阴性,3~4 分为弱阳性,5~6 分为强阳性[7]。在预后分析中,将NHE-1 蛋白和V-ATPase 均为0~2 分记为NHE-1 蛋白和V-ATPase 均不表达组,NHE-1 蛋白为3~6 分且V-ATPase 为0~2 分记为NHE-1 蛋白表达组,V-ATPase 为3~6 分且NHE-1 蛋白为0~2 分记为V-ATPase 表达组,两者均为3~6 分记为NHE-1 蛋白和V-ATPase 均表达组。
1.4 统计学处理 采用SPSS 22.0 统计软件。计数资料多组间比较采用χ2检验,两两比较采用χ2分割法(P<0.0125)。等级资料多组间比较采用Kruskal-Wallis H 检验,两两比较采用Mann-Whitney U 检验(Bonferroni 校正,3 组间两两比较P<0.0167,4 组间两两比较P<0.0125)。采用Spearman 等级相关分析NHE-1 蛋白表达和V-ATPase 表达的相关性。预后分析采用Kaplan-Meier 生存曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 胃癌及癌前病变组织中NHE-1 蛋白及V-ATPase的表达 NHE-1 蛋白及V-ATPase 在正常胃黏膜组织中均无表达,但在胃癌组织及癌前病变组织中均有不同程度的表达。胃癌组织及癌前病变组织中NHE-1 蛋白及V-ATPase 的阳性表达率比较差异均有统计学意义(均P<0.05);两两比较发现,胃癌组织中NHE-1 蛋白及V-ATPase 的阳性表达率均高于慢性萎缩性胃炎、肠上皮化生和异型增生等癌前病变组织,差异均有统计学意义(均P<0.0125),见表1。

表1 胃癌及癌前病变组织中NHE-1 蛋白及V-ATPase 的表达[例(%)]
2.2 胃癌组织中NHE-1 蛋白及V-ATPase 表达与临床病理特征的关系 胃癌组织中NHE-1 蛋白及VATPase 的表达与性别、年龄、肿瘤大小、分化程度均无关(均P >0.05),但与浸润深度、淋巴结转移、TNM 分期均有关(均P<0.05)。两两比较发现,浸润深度T2、T3、T4时NHE-1 蛋白及V-ATPase 的表达与T1比较,差异均有统计意义(均P<0.0125);淋巴结转移N1、N2、N3时NHE-1 蛋白及V-ATPase 的表达与N0比较,差异均有统计意义(均P<0.0125);TNM 分期Ⅱ期、Ⅲ期、Ⅳ期NHE-1 蛋白及V-ATPase 的表达与Ⅰ期比较,差异均有统计意义(均P<0.0125),见表2。
2.3 胃癌组织中NHE-1 蛋白表达和V-ATPase 表达的相关性分析 Spearman 等级相关分析显示,胃癌组织中NHE-1 蛋白表达和V-ATPase 表达呈正相关(r=0.299,P<0.05),见表3。

表2 胃癌组织中NHE-1 蛋白及V-ATPase 表达与临床病理特征的关系(例)

表3 胃癌组织中NHE-1 蛋白表达和V-ATPase 表达的相关性(例)
2.4 NHE-1 蛋白表达和V-ATPase 表达与预后的相关性分析 NHE-1 蛋白表达阴性、弱阳性和强阳性组中位生存时间分别为48(95%CI:42.643~53.357)、39(95%CI:29.344~48.656)和28(95%CI:20.949~35.051)个月,3 组比较差异有统计学意义(P<0.05);两两比较差异均有统计学意义(均P<0.0167),见图1(插页)。V-ATPase表达阴性、弱阳性和强阳性组中位生存时间分别为50(95%CI:45.920~54.080)、32(95%CI:26.410~37.590)和27(95%CI:22.696~31.304)个月,3 组比较差异有统计学意义(P<0.05);两两比较差异均有统计学意义(均P<0.0167),见图2(插页)。NHE-1 蛋白和V-ATPase 均表达组(70 例)、NHE-1 蛋白表达组(9 例)、V-ATPase 表达组(45 例)和NHE-1 蛋白和V-ATPase 均不表达组(28 例)中位生存时间分别为31(95%CI:25.784~36.216)、44(95%CI:40.120~47.880)、42(95%CI:39.140~44.860)和48(95%CI:46.790~49.210)个月,4 组比较差异有统计学意义(P<0.05);两两比较发现,NHE-1 蛋白和V-ATPase均表达组分别与NHE-1 蛋白表达组、V-ATPase 表达组、NHE-1 蛋白和V-ATPase 均不表达组比较,差异均有统计学意义(均P<0.0125),V-ATPase 表达组与NHE-1蛋白和V-ATPase 均不表达组比较,差异有统计学意义(P<0.0125),见图3(插页)。

图1 Na+/H+交换蛋白-1(NHE-1)蛋白表达的胃癌患者预后生存曲线
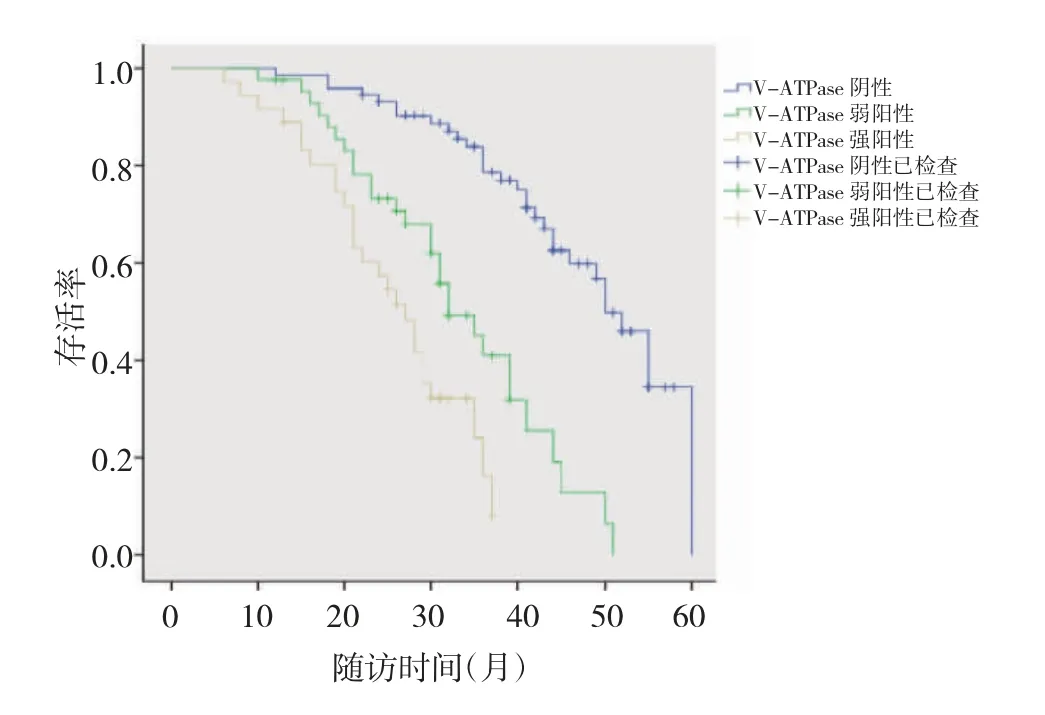
图2 空泡型质子ATP 酶(V-ATPase)表达的胃癌患者预后生存曲线

图3 Na+/H+交换蛋白-1(NHE-1)蛋白和空泡型质子ATP 酶(V-ATPase)表达的胃癌患者预后生存曲线
3 讨论
相对于正常细胞而言,胃癌细胞代谢旺盛,供血、供氧量相对不足,容易造成细胞缺氧的环境,缺氧环境加速细胞对葡萄糖的酵解,使细胞内产生大量的乳酸和H+[8],为了维持细胞内pH 的稳定,胃癌细胞会开放更多高效的排酸通道,促使细胞内H+排出,因此就会过度的表达NHE-1 蛋白及V-ATPase,而大量H+排出使细胞外pH 降低,最终导致细胞酸性微环境形成[9]。其次Na+-H+交换依赖于ATP 酶供能,这一耗能过程又会反馈地刺激胃癌细胞对糖的摄取和对糖酵解的依赖,从而使胃癌细胞进行更多的Na+-H+交换,形成恶性循环,导致更多的正常细胞发生凋亡和坏死,最终进一步加速癌症细胞的形成[10]。本研究发现胃癌组织中NHE-1 蛋白和V-ATPase 阳性表达率均高于癌前病变及正常胃黏膜组织,且胃癌组织中NHE-1 蛋白表达和V-ATPase 表达呈正相关。NHE-1 蛋白的表达会促进V-ATPase 表达,两者协同发挥作用来维持细胞内pH 稳定,因此也造成细胞酸性微环境形成,加速胃癌细胞的产生。
胃癌细胞可以通过上调NHE-1 蛋白和V-ATPase的表达,将癌细胞糖酵解产生的大量H+泵出细胞外,维持癌细胞的生存并形成肿瘤酸性微环境,酸性微环境形成会促使癌细胞基因表型的改变以获得更强劲的生命力,还有利于肿瘤血管的生成以及癌细胞外基质的重建,导致癌细胞的浸润和转移[11]。研究表明,NHE-1蛋白和V-ATPase 在多种肿瘤细胞中都存在过表达,且与肿瘤细胞的增殖生长、浸润转移和凋亡都有着密切的联系[11-13]。本研究发现胃癌组织中NHE-1 蛋白及VATPase 表达情况与浸润深度、淋巴结转移、TNM 分期均有关,表明NHE-1 蛋白及V-ATPase 的表达越强则胃癌组织的生长越活跃、淋巴结的转移程度越广泛、TNM 分期越晚。
胃癌细胞上NHE-1 蛋白和V-ATPase 的过表达不仅有助于胃癌细胞的生长和转移,也会对化疗和放疗产生抵抗[14]。研究表明NHE-1 蛋白和V-ATPase 的过表达更容易使胃癌细胞对化疗药物产生耐药性[15-17]。细胞内pH 的稳定对化疗药物发挥细胞毒反应起到重大作用,因为细胞酸中毒是细胞凋亡的起始点,同时对耐药性的产生也具有作用,耐药的胃癌细胞内化疗药物浓度会明显降低[16],使化疗效果下降,从而缩短生存时间。本研究发现胃癌组织中不同程度NHE-1 蛋白和V-ATPase 的表达其生存时间存在明显差异,表达程度越高胃癌生存时间越短。通过将NHE-1 和V-ATPase 同时表达跟单一表达及同时不表达之间的生存时间进行比较,发现同时表达的生存时间明显缩短,说明酸性微环境的形成与胃癌预后存在相关性。
综上所述,本研究通过Spearman 等级相关分析显示胃癌组织中NHE-1 蛋白表达和V-ATPase 表达呈正相关,且两者表达与胃癌的浸润深度、淋巴结转移、TNM分期和预后生存时间均有关。提示NHE-1 蛋白和VATPase 异常表达可能在胃癌发生、侵袭、转移的过程中起正向调控作用,两者有望成为预防、治疗和评估胃癌预后的新的生物学标志物。
