ATF2在宫颈癌组织中的表达及沉默ATF2抑制自噬对宫颈癌细胞化疗敏感性的影响
2021-02-27周展,李燚
周 展, 李 燚
(山东省立第三医院妇科, 山东 济南 250031)
宫颈癌(Cervical cancer,CC)是全球第三大女性特异性癌症,每年约有530000新诊断病例[1]。研究数据表明,CC发病率主要发生在发展中国家,如东部和西部非洲、南美和中南亚,并伴有严重的死亡率[2]。尽管放射治疗和根治性子宫切除术在治疗早期浸润性宫颈癌、局部复发风险的方面取得了出色的进展,但预后仍不能令人满意[3]。因此,迫切需要找到新的鉴定CC标志物并探索CC治疗的新治疗策略。激活转录因子2(Activating transcription factor 2,ATF2)属于碱性亮氨酸拉链转录因子家族。ATF2在肿瘤中起抑制或促进作用,并参与细胞应激、DNA损伤等过程。ATF2的激活主要是通过应激刺激后的磷酸化修饰来实现的。磷酸化的ATF2与靶基因的启动子区域的特定序列结合,例如细胞周期分子、黏附分子和凋亡相关分子,从而激活靶基因的表达。Wu等[4]研究发现ATF2在肾细胞癌中可以调节细胞周期蛋白B1、细胞周期蛋白D1、波形蛋白的表达,从而调节细胞的增殖和转移。此外,Song等[5]研究已证实miR-204可以特异性抑制ATF2蛋白的表达并调节人脑角化细胞瘤肿瘤细胞的增殖、迁移和侵袭。但是ATF2在宫颈癌中的研究甚少。因此,在本实验中,我们首先检测ATF2在宫颈癌组织和宫颈癌细胞系中的表达,此外,本实验利用shRNA转染HeLa细胞以构建ATF2低表达的稳定细胞株,观察沉默ATF2抑制自噬对宫颈癌细胞化疗敏感性的影响,为ATF2在宫颈癌进展中的重要性及其作为新的治疗靶标提供理论依据。
1 材料与方法
1.1主要材料
1.1.1临床样本:收集2017年12月至2019年12月在我院接受宫颈癌切除手术患者作为实验组,患者共40例,年龄33~67岁,平均年龄(52.37±4.16)岁;所有患者经病理确诊为宫颈癌且均在手术前未进行放、化疗。选取同期宫颈良性病变患者者30例作为对照组,年龄35~65岁,平均年龄(49.85±4.03)岁。两组年龄没有统计学差异(P>0.05)。所有患者经病理确诊为宫颈癌且均在手术前未进行放、化疗,且术前均签署了知情同意书。所有组织标本都保存在-80℃直至使用。
1.1.2细胞:正常宫颈上皮细胞HcerEpic和宫颈癌细胞系(HeLa、SiHa、C33A、MS751)购自中国科学院上海细胞生物学研究所。
1.1.3主要试剂:MEM培养基、RPMI-1640培养基和胎牛血清购自美国Hyclone公司。顺铂(cisplatin,DDP)购自上海源叶生物科技有限公司。免疫组织化学试剂盒购自北京索莱宝生物科技有限公司。TRIzol试剂、PrimeScriptTM 1st Strand cDNA Synthesis试剂盒和TB GreenTM Premix Ex Taq Ⅱ试剂盒购自日本TaKaRa公司。shNC、shATF2和GFP-LC3质粒购自上海吉玛制药技术有限公司。LipofectamineTM 3000购自美国Invitrogen公司。Annexin V/PI试剂盒、RIPA裂解液、BCA试剂盒购自美国Abcam公司。ATF2抗体、LC3A/B抗体、Bax抗体、Bcl-2抗体、GAPDH抗体和IgG-HRP抗体购自美国Cell Signaling Technology公司。
1.2实验方法
1.2.1细胞培养:HcerEpic细胞用含10%胎牛血清的MEM培养基;HeLa细胞、SiHa细胞、C33A细胞和MS751细胞用含10%胎牛血清的RPMI-1640培养基,置于37℃、5% CO2的培养箱中培养,2 d更换一次培养基,以保证细胞所需的营养成分。取对数期、状态良好的细胞进行后续实验。
1.2.2细胞转染与DDP处理:HeLa细胞按照1×105个/孔接种在24孔板中,细胞随机分为三组,control+DDP(10μg/mL)组、shNC+DDP(10μg/mL)组和shATF2+DDP(10μg/mL)组。待细胞生长融合至60%时,按照LipofectamineTM 3000转染试剂说明书进行顺时转染,其中shNC和shATF2的转染终浓度为50 nmoL/L(经验证顺时转染成功);48 h后,每组细胞中加入DDP;再48 h后结束培养,收集各组细胞进行后续实验。
1.2.3细胞克隆形成:培养结束后的各组细胞经胰酶消化以1×103个/孔接种于60mm细胞培养皿中。14d后,用结晶紫溶液染色细胞,并计数含有≥50个细胞的集落,显微镜拍摄代表性集落并统计。
1.2.4细胞免疫荧光染色:培养结束后的各组细胞经胰酶消化后按照1×105个/孔接种在24孔板中,用GFP-LC3质粒(1μg/mL)进行转染。培养48h后,使用倒置显微镜捕获GFP-LC3点的积累。通过使用ImageJ软件对GFP-LC3点的数目进行计数。
1.2.5细胞流式术:培养结束后的各组细胞,离心并重悬于缓冲液中。细胞依次用异硫氰酸荧光素(FITC)溶液(10μL)和碘化丙啶(PI)溶液(10μL)染色,之后将细胞在室温下黑暗环境中孵育30min,然后使用FACSCaliburTM流式细胞仪进行分析。
1.2.6免疫组织化学染色法:宫颈癌组织和正常组织经固定,包埋,石蜡切片、脱水、缓冲液清洗,3%过氧化氢溶液去除内源性过氧化物酶,滴加非免疫动物血清20min,滴加一抗、PBS冲洗、滴加二抗、冲洗后加ABC复合物、DAB显色,中性树胶封片。在显微镜下观察,用MIAS图像分析系统分析,按照免疫组化染色阳性细胞数在每一高倍视野中所占比例依次统计。目标蛋白呈棕黄色,则为阳性表达。
1.2.7qRT-PCR:TRIzol试剂提取组织样本或者细胞中的总RNA,紫外分光光度计检测样品RNA浓度。使用PrimeScriptTM 1st Strand cDNA Synthesis试剂盒将提取的RNA逆转录成cDNA。ATF2:正向5'-TGGTAGCGGATTGGTTAGG-3',反向5'-TTGGGTCTGTGGAGTTGTG-3';GAPDH:正向5'-TGGATCAGCAAGCAGCAGGAGTA-3',反向5'-TCGGCCACATTGTGTGAACTTT-3'。使用TB GreenTM Premix Ex Taq Ⅱ试剂盒进行qRT-PCR。使用StepOnePlus仪器完成实验后,采用2-△△Ct法分析数据。
1.2.8Western blot:RIPA裂解液提取组织样本或者细胞中的总蛋白,并通过BCA法测定总蛋白含量,并将配对的样品调节至相同浓度。样品经变性后,采用10% SDS-聚丙烯酰胺凝胶电泳分离蛋白,并转移到PVDF膜上。室温下用5%脱脂奶粉封闭1h,之后将PVDF膜分别与以下抗体在4℃孵育过夜:ATF2抗体(1∶1000)、LC3A/B抗体(1∶1000)、Bax抗体(1∶1000)、Bcl-2抗体(1∶1000)和GAPDH抗体(1∶2000)。随后,将PVDF膜用TBST洗涤3次,并与IgG-HRP抗体(1∶5000)孵育1h,用TBST洗涤3次,持续5min。最后显影曝光,Image-Pro Plus图像分析系统对蛋白条带的灰度值进行分析。

2 结 果
2.1ATF2在宫颈癌组织中的表达:免疫组织化学染色结果表明(图1A):ATF2在宫颈癌组织中的表达(75.23%)较正常组织(8.08%)明显增加(P<0.01);qRT-PCR结果表明(图1B):与正常组织组比较,ATF2 mRNA在宫颈癌组织中表达上调(P<0.01)。

图1 ATF2在宫颈癌组织中的表达
2.2ATF2在宫颈癌细胞系中的表达:qRT-PCR结果表明(图2A):ATF2 mRNA在宫颈癌细胞系(MS751、SiHa、HeLa、C33A)中的表达较HcerEpic细胞明显增加(P<0.01);Western blot结果表明(图2B):与HcerEpic组比较,ATF2蛋白在宫颈癌细胞系中表达上调(P<0.01);其中HeLa细胞中ATF2的表达水平最高,因此,后续实验选择HeLa细胞。
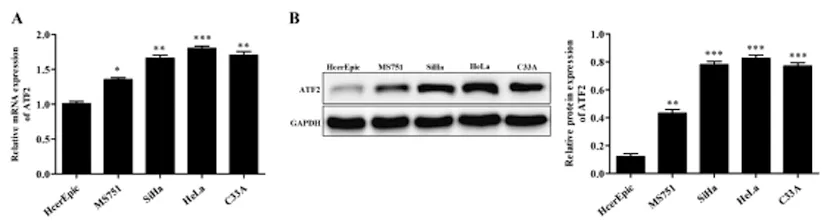
图2 ATF2在宫颈癌细胞系中的表达
2.3沉默ATF2对顺铂诱导HeLa细胞增殖的影响:qRT-PCR结果表明(图3A):与control组和shNC比较,shATF2组HeLa细胞中ATF2 mRNA的表达水平明显下调(均P<0.01);Western blot结果表明(图3B):与control组和shNC比较,shATF2组HeLa细胞中ATF2蛋白的表达水平明显下调(均P<0.001);细胞克隆形成实验结果表明(图3C):与control组和shNC比较,shATF2组HeLa细胞的集落数目明显减少(均P<0.01)。
2.4沉默ATF2对顺铂诱导HeLa细胞自噬的影响:Western blot结果表明(图4A):加入10μg/mL DDP后,与control组和shNC组比较,shATF2组HeLa细胞中LC3 Ⅱ/LC3 I蛋白表达水平比例明显下降(P<0.01);细胞免疫荧光染色法表明(图4B):加入10μg/mL DDP后,与control组和shNC组比较,shATF2组HeLa细胞中自噬体数目减少(P<0.01)。

图3 沉默ATF2对顺铂诱导HeLa细胞增殖的影响
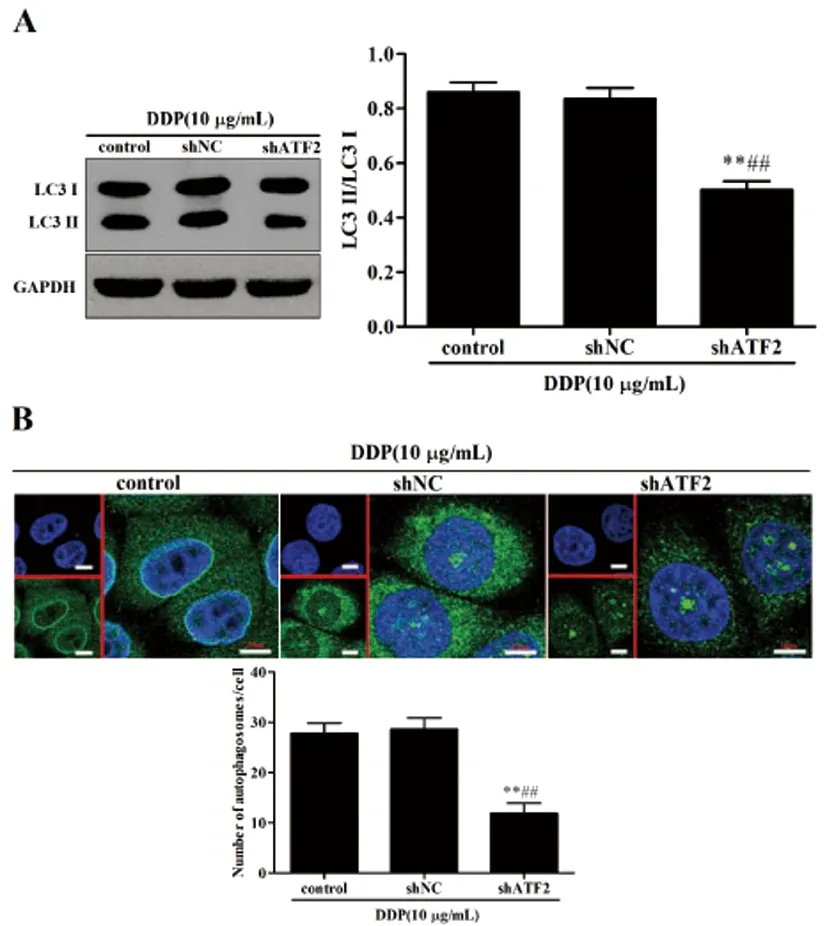
图4 沉默ATF2对顺铂诱导HeLa细胞自噬的影响
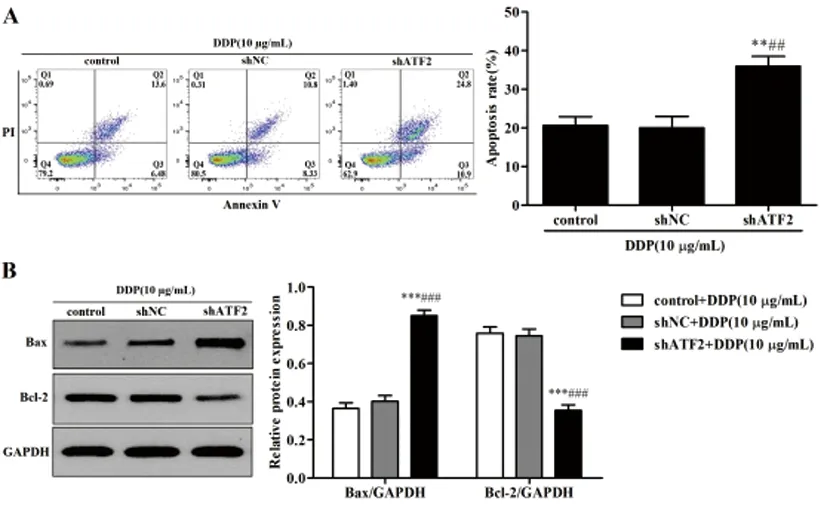
图5 沉默ATF2对顺铂诱导HeLa细胞凋亡作用的影响
2.5沉默ATF2对顺铂诱导HeLa细胞凋亡作用的影响:细胞流式术结果表明(图5A):加入10μg/mL DDP后,与control组和shNC组比较,shATF2组HeLa细胞的凋亡率明显增加(P<0.01);Western blot结果表明(图5B):加入10μg/mL DDP后,与control组和shNC组比较,shATF2组HeLa细胞中Bax蛋白表达水平显著上调(P<0.001),Bcl-2蛋白表达水平显著下调(P<0.001)。
3 讨 论
目前,手术、化学疗法和放射疗法是宫颈癌的主要治疗方法。尽管经治疗后患者总生存率已有一定程度的提高,但术后复发、淋巴转移和对周围正常组织的毒副作用仍没有好的治疗方法。目前,在宫颈癌的临床治疗中靶向治疗的研究已被医务工作者广泛关注。
ATF2位于2号染色体臂3区2带,是激活蛋白1超家族的成员。JNK或P38激活后,ATF2与其他转录因子异源二聚体(靶蛋白泛素特异性蛋白酶14)结合,从而调节细胞存活和分化。此外,ATF2可以通过应激或细胞因子刺激来激活,以响应DNA损伤、病毒感染和细胞死亡。ATF2与炎症和神经发育有关,也与肿瘤进展有关[6]。根据肿瘤类型及其亚细胞定位,已证明ATF2可作为致癌基因或抑癌基因。研究发现,ATF2在非小细胞肺癌和肾细胞癌中呈高表达,并且与不良预后与关[7,8]。Li等[9]研究发现,ATF2在胰腺癌中高表达,然而沉默ATF2增强了吉西他滨诱导的胰腺癌细胞生长抑制和凋亡诱导作用。但是ATF2在宫颈癌中研究甚少,我们的临床数据表明,宫颈癌组织中ATF2的表达高于非肿瘤组织,这促使我们提出了ATF2可能在宫颈癌中起致癌作用的假说。此外ATF2还可作为诊断宫颈癌的潜在生物标记。
自噬是一个吞噬自身细胞质或细胞器并使其包被进入囊泡,并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物的过程,藉此实现细胞本身的代谢需要和某些细胞器的更新,维持机体内环境稳定。研究表明,自噬在癌症的发生发展过程中发挥着重要作用[10]。Fukuda[11]等研究表明,氯喹通过自噬抑制作用从而抑制子宫内膜癌细胞的增殖并克服顺铂耐药性。Hong等[12]研究表明,辣椒素通过抑制化学疗法诱导的自噬提高胆管癌的药物敏感性。本文研究发现,沉默ATF2能明显抑制HeLa细胞中LC3 Ⅱ/ LC3Ⅰ蛋白表达比例的上调,减少HeLa细胞中自噬体数量,表明沉默ATF2对顺铂诱导HeLa细胞自噬有抑制作用。
细胞凋亡是细胞的一种基本生物学现象,是为维持内环境稳定,由基因控制的细胞自主的有序的死亡。细胞凋亡不仅是一种特殊的细胞死亡类型,而且具有重要的生物学意义及复杂的分子生物学机制。凋亡是多基因严格控制的过程,这些基因在种属之间非常保守,如Bcl-2家族、caspase家族、癌基因如C-myc、抑癌基因P53等。我们的结果表明,沉默ATF2可诱导宫颈癌细胞凋亡。研究表明,Bcl-2的启动子区域包含可以响应ATF-2的环状AMP响应元件[13]。我们的研究表明,沉默ATF2使HeLa细胞中Bax水平升高而Bcl-2水平降低,这为响应ATF2沉默的凋亡事件提供了分子证据。Bax和Bcl-2的比例与线粒体通透性过渡孔的开放有关。这里Bax和Bcl-2水平的变化也暗示线粒体可能参与了沉默ATF2诱导的细胞凋亡,但是还需要进一步的研究来检验这一假设。
综上所述,ATF2在宫颈癌组织和宫颈癌细胞中高表达。沉默ATF2可以抑制HeLa细胞的增殖与自噬,并增加细胞凋亡来提高HeLa细胞对顺铂的敏感性。因此,ATF2具有作为宫颈癌诊断生物标志物的潜在价值,并且ATF2也可能成为宫颈癌治疗的有希望的靶标。
