狼毒水煎液治疗H22肝癌小鼠的作用与机制
2021-02-24闫桂溪杜金城杜钢军
闫桂溪,杜金城,杜钢军*
1.河南大学药学院 药物研究所,河南 开封 475004;2.湖南中医药大学 中医学院,长沙410208
传统中医学[1]认为,癌症属于“积聚”“症瘕”等范畴。中药在抗癌治疗方面有标本兼治、整体性、多靶点、多途径等优势[2],可缩小或稳定瘤体、缓解临床症状、降低毒副作用,实现带瘤生存,对临床治疗具有重要意义。中药成分的复杂性使其具有复杂的作用机制,为中药的深入研究带来了困难。网络药理学方法能建立成分之间复杂的分子网络与多重靶点,基于靶点的蛋白与基因相互作用的探究为中药药理作用与机制研究提供了新思路。
狼毒是大戟科植物月腺大戟(Euphorbia ebracteolata Hayata)或狼毒大戟(Euphorbia fischeriana Steud)的干燥根[3],其味苦辛、性平、有毒、入肺、脾、肝经,具有祛痰逐水、拔毒、祛腐、止痒等功效,临床用于治疗水肿腹胀,心腹疼痛等病症[4-5]。研究[6]发现,狼毒提取物对肿瘤细胞有较强抑制活性,并具有抗菌、抗炎、抗病毒作用,是一个潜在的天然药物开发药源。实验采用网络药理学对狼毒可能的抗肿瘤成分及作用靶点进行预测,并对其抗肿瘤作用进行实验验证,为进一步研究其抗肿瘤成分奠定基础。
1 材料
1.1 药材
狼毒购自开封市天济堂药店,经河南大学生药教研室鉴定为大戟科植物狼毒大戟(Euphorbia fischeriana Steud)干燥根。狼毒水提物制备:称取狼毒干燥根40 g,加20 倍(800 mL)蒸馏水浸泡1 h,煎煮30 min,取水煎液。重复上述过程,共煎煮3 次。合并3 次滤液加热浓缩至200 mL(1 mL 相当于0.2 g原药材),分装冻存于-80 ℃冰箱,给药前用蒸馏水稀释至需要浓度,按小鼠体质量4 g/kg 灌胃给药。
1.2 试剂
二甲苯(天津市富晨化学试剂厂,批号:20150812),伊文思蓝(上海沃凯化学试剂有限公司,批号:20110325)。
1.3 实验动物与细胞
昆明小鼠,雄性,SPF 级,体质量>20 g,采购自河南省实验动物中心。H22 肝癌细胞,购自中科院细胞库,本实验室液氮冻存,小鼠腹腔接种传代。
1.4 仪器
FA1004B 型电子天平(上海舜宇恒平科学仪器有限公司);EM-KC150 数显游标卡尺(河东区星光扳钳工具厂);JD-2 系列多功能电子天平(沈阳固而特商贸有限公司);LDZX-75KBS 立式压力蒸汽灭菌锅(上海沪粤明科学仪器有限公司);微量移液器(上海佳安分析仪器厂);TDL-508 台式离心机(上海安亭科学仪器厂);BCD-539WT 低温冰箱(海尔集团);超净工作台(上海博迅实业公司);WH-866涡旋振荡器(太仓市科教器材厂);电热恒温培养箱(上海跃进医药器械厂);MultiskanTMFC 酶标仪(ThermoFisher);YLS-1A 多功能小鼠自主活动记录仪(济南益延科技发展有限公司)。
1.5 分析平台与软件
①中药系统药理学数据库和分析平台TCMSP(http:/ / Isp.nwu.edu.cn/ tcmsp.php);②UniProt 数据库(https:/ /www.uniprot.org/);③PubChem 数据库(https:/ /pubchem.ncbi.nlm.nih.gov/ );④Swiss Target Prediction(http:/ /www.swisstargetprediction.ch/);⑤STITCH(http:/ /stitch.embl.de/);⑥TTD 数据库(https:/ /db.idrblab.org/ttd/);⑦蛋白质相互作用分析平台STRING(https:/ /string-db.org/);⑧人类基因组注释数据库DAVID v6.8(https:/ /david.ncifcrf.gov/);⑨Omicshare 数据库(http:/ / www.omicshare.com/);⑩网络图形拓扑分析与编辑软件Cytoscape。
2 方法
2.1 狼毒有效成分筛选
在中药系统药理学分析平台[7](TCMSP,http:/ /lsp.nwu.edu.cn/tcmsp.php)中输入狼毒活性成分名称,查找相关信息。据化合物药动学参数:类药性(DL)≥0.18,口服生物利用度(OB)≥30%,类药五原则的标准筛选出6 个活性成分。通过Pub-Chem 数据库[8](https:/ /Pubchem.Ncbi.nlm.nih.gov)查找并导出6 个活性成分的化学结构(*.SMILES),保存为mol2 格式。
2.2 狼毒活性成分作用靶点的预测
将相关化学成分的mol2 格式结构文件上传至Swiss Target Prediction[9](www.swisstargetprediction.cn/)和STITCH[10](stitch.embl.de)进行靶点预测,2个预测得到的靶点与TCMSP 中的靶点作为全部备选靶点。采用UniProt 数据库[11](http:/ /www.uniprot.org/)将备选靶点名称规范化为官方名(Official Symbol)和Uniprot ID。
2.3 活性成分-预测靶点网络的构建
利用Cytoscape 3.2.1 软件[12]构建成分-预测靶点网络图。在网络中,靶点和成分以节点(node)表示,靶点和成分之间的联系以边(edge)表示。
2.4 癌症治疗靶点与抗炎相关靶点搜集
通过Therapeutic Target Database 数据库[13](TTD,https:/ /db.idrblab.org/ttd/),以“liver cancer”“cancer”“inflammation”为关键词收集与癌症和炎症相关治疗靶点,通过与预测靶点对比筛选出狼毒肿瘤治疗靶点和抗炎相关靶点。
2.5 GO 注释分析与KEGG 通路分析
使用生物学信息注释数据库[14](DAVID,https:/ /david.ncifcrf.gov/)对狼毒肿瘤治疗靶点进行GO 和KEGG 通路富集分析,并用FDR 错误控制法对P值作检验校正,最终设定阈值P<0.05,筛选出与狼毒抗肿瘤作用相关的生物过程和信号通路,进一步通过Omicshare 在线将GO 和KEGG 富集分析结果可视化,筛选出抗肿瘤相关通路较多的化合物。采用基因富集分析数据库[15](Enrichr,http:/ /amp.pharm.mssm.edu/Enrichr/enrich)对狼毒抗炎作用相关靶点进行GO 和KEGG 通路富集分析,并用FDR 错误控制法(FDR<0.05)对P值作检验校正,最终设定阈值P<0.05,筛选出与狼毒抗炎作用相关的生物过程和信号通路,并选择前10 个通路进行可视化。
2.6 小鼠H22 皮下肿瘤模型的建立及分组给药
选择腹腔接种7~9 d 的H22 小鼠,处死后于无菌条件下抽取乳白色腹水[16]。离心,弃去上清液,收集沉淀细胞,用无菌生理盐水稀释成1 × 107个/mL 细胞悬液,无菌环境下每只小鼠右肢腋部皮下接种瘤液0.2 mL。接种小鼠随机分为2 组:模型组和狼毒组,每组10 只。肿瘤接种次日,狼毒组按小鼠体质量4 g/kg 灌胃狼毒水煎液,1 次/d。
每周测定小鼠体质量和自主活动2 次。待肿瘤手触长出后开始用数显游标卡尺测量肿瘤长径和宽径,2 次/周。待对照组肿瘤平均直径>25 mm 时终止实验,处死小鼠,剥离肿瘤称重。计算肿瘤体积及肿瘤抑制率[17]。肿瘤体积(mm3)=(肿瘤长径×肿瘤宽径2)/2;肿瘤抑制率=(模型组肿瘤体积-狼毒给药组肿瘤体积)/模型组肿瘤体积×100%。
2.7 二甲苯诱导的小鼠耳肿胀
实验终止当日,小鼠给药后30 min,于各组小鼠右耳正反面均匀涂上二甲苯40 μL 致炎[18]。涂上二甲苯后30 min,处死小鼠,剪下同只小鼠左右耳用打孔器在同一部位打下耳片,分析天平称重,以两耳片重差值为耳肿胀度,并计算肿胀抑制率。肿胀抑制率=[(模型组耳平均肿胀度-狼毒组耳平均肿胀度)/模型组耳平均肿胀度]×100%。
2.8 瘤组织毛细血管渗透性
实验终止当日,小鼠给药1 h,各组小鼠尾静脉0.2 mL/10 g 注射体积分数1%的伊文思蓝染液30 min后处死,剖取皮下瘤组织0.5 g 剪碎,置于体积分数为70%的丙酮水溶液中浸泡2 d,摇晃2 次/d,离心取上清,酶标仪630 nm 测吸光度[19]。
2.9 荷瘤小鼠凝血功能检测
实验终止当日,各组小鼠断尾5 mm,记录凝血时间。处死时毛细管沿眼眶静脉丛取血,毛细管法测小鼠凝血时间[20]。
2.10 统计方法
3 结果
3.1 狼毒有效成分筛选
结合文献报道和TCMSP 数据库筛选得到6 个可被吸收有效成分,AlogP、Hdon 及Hacc,见表1。
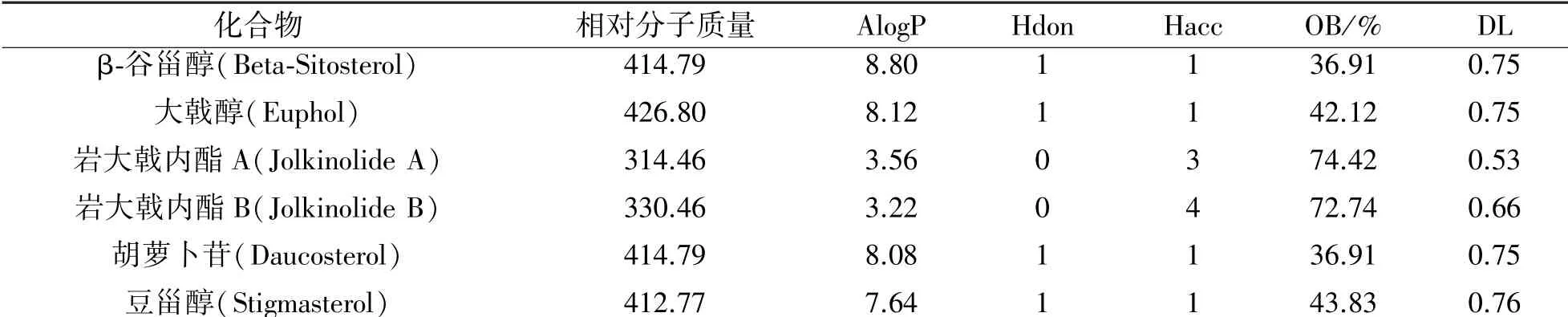
表1 狼毒中可吸收活性成分及其参数
3.2 狼毒活性成分-预测靶点网络的构建
通过Swiss Target Prediction、STITCH 预测活性成分靶点与TCMSP 中记载的靶点共得到预测靶点109 个。将预测靶点与活性成分导入Cytoscape 3.2.1软件中共有节点115 个(6 个活性成分节点与109 个靶点节点),边180 条,见图1。

图1 狼毒活性成分-预测靶点图
3.3 癌症治疗靶点与抗炎相关靶点搜集
根据Therapeutic Target Database(TTD)搜索与癌症和炎症相关治疗靶点与预测靶点对比,分别得到26 个和11 个相同的基因,见表2、表3。狼毒中6个活性成分分别对应26 个癌症相关治疗靶点,见图2。分别对应11 个炎症相关治疗靶点,见图3。
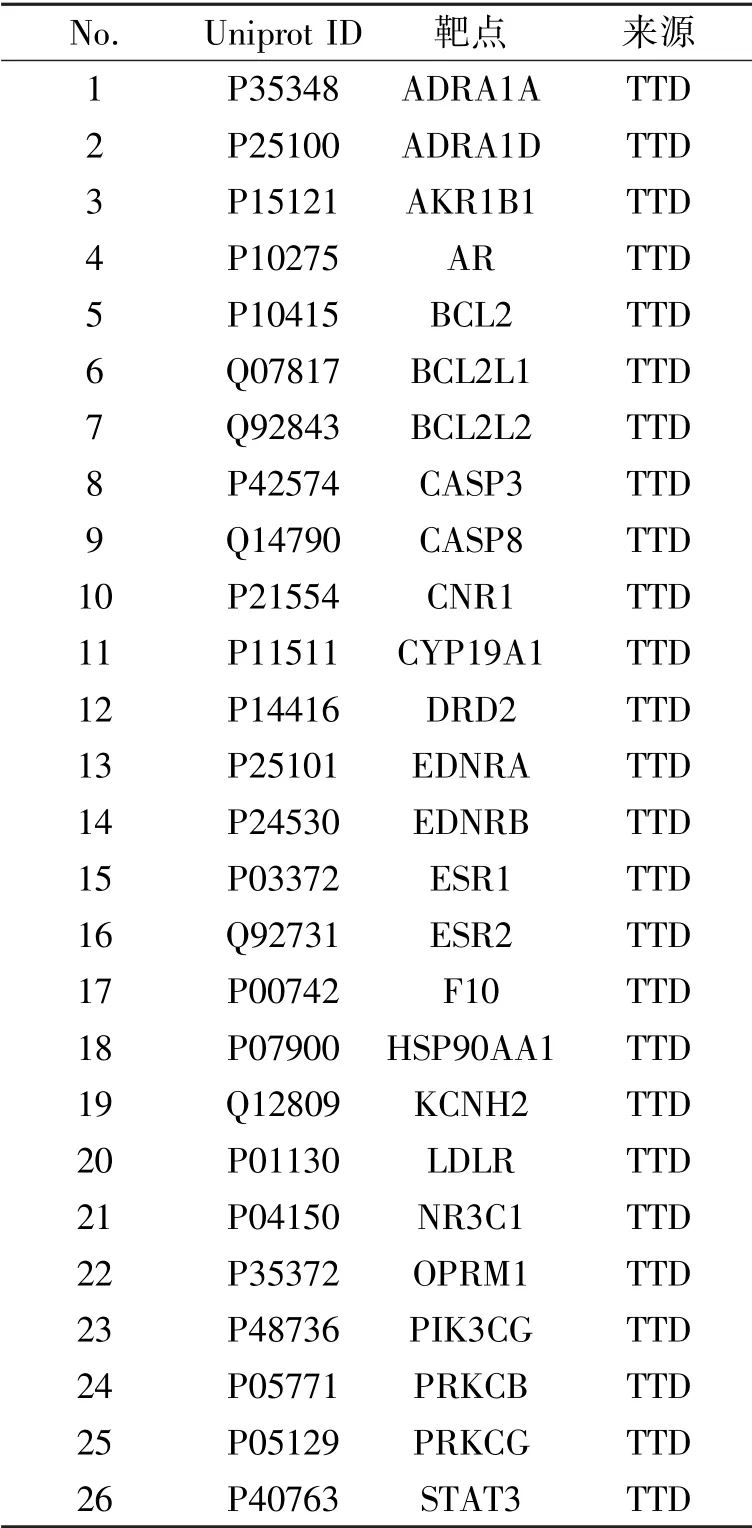
表2 肿瘤治疗相关作用靶点

表3 炎症相关作用靶点
3.4 GO 注释分析与KEGG 通路分析
对狼毒26 个肿瘤治疗基因和11 个抗炎相关靶点进行通路富集分析。GO 分析结果显示,26 个癌症治疗靶点参与84 个生物过程(P<0.05),其中22 个(P<0.05,count≥4)与癌症生物过程相关:生物通路主要有“细胞溶质钙离子浓度调节”“磷脂酶C 激活G 蛋白偶联受体信号通路”“无配体的情况下外源性凋亡信号传导途径”“药物反应”“细胞增殖”等。KEGG 分析结果表明,癌症治疗靶点参与44 个信号通路(P<0.05),其中24 个(P<0.05,count ≥4)与癌症信号传导相关:KEGG 主要通路有“癌症途径”“乙型肝炎”“Rap1 信号通路”“HIF-1 信号通路”等。11 个抗炎相关靶点富集分析显示其参与147 个生物过程(P<0.05),前10 个过程可视化图,见图4。生物通路主要有“突触传递”“γ-氨基丁酸信号通路”“突触后膜电位的调节”“氯离子跨膜转运”“一氧化氮生物合成过程调节”“活性氧生物合成过程调节”等;KEGG 分析结果表明,其参与26 个信号通路(P<0.05),前10 个信号通路可视化图,见图5。KEGG 主要通路有“NF-κB 信号通路”“雌激素信号通路”“NOD 样受体信号通路”“花生四烯酸代谢通路”等。
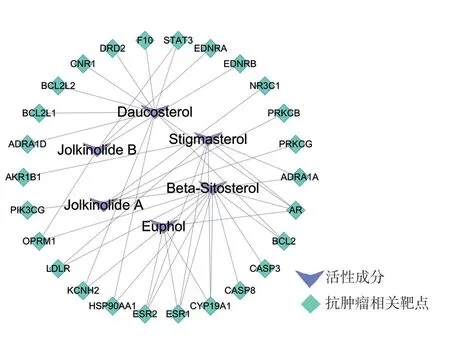
图2 狼毒活性成分-抗肿瘤相关靶点图
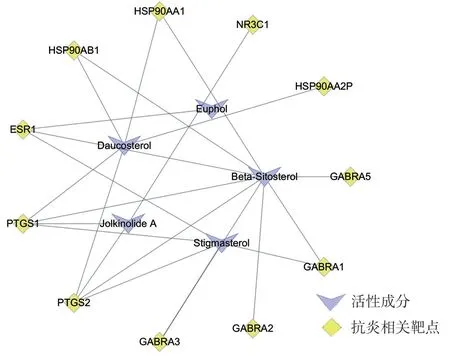
图3 狼毒活性成分-抗炎相关靶点图

图4 狼毒炎症相关GO 注释分析

图5 狼毒炎症相关KEGG 通路分析
3.5 成分-靶点-通路网络图
将狼毒活性成分、抗肿瘤作用靶点及其相对应信号通路导入Cytoscape 3.2.1 软件中共有节点70个,边178 条,见图6。直观地呈现了6 个活性成分、26 个靶基因、44 个信号通路间的关联。从图中可以看出狼毒抗肿瘤的主要活性组分是胡萝卜苷(Daucosterol)、豆甾醇(Stigmasterol)、β-谷甾醇(Beta-Sitosterol),其成分-靶点-通路图,见图7。

图6 狼毒活性成分-抗肿瘤相关靶点-信号通路图
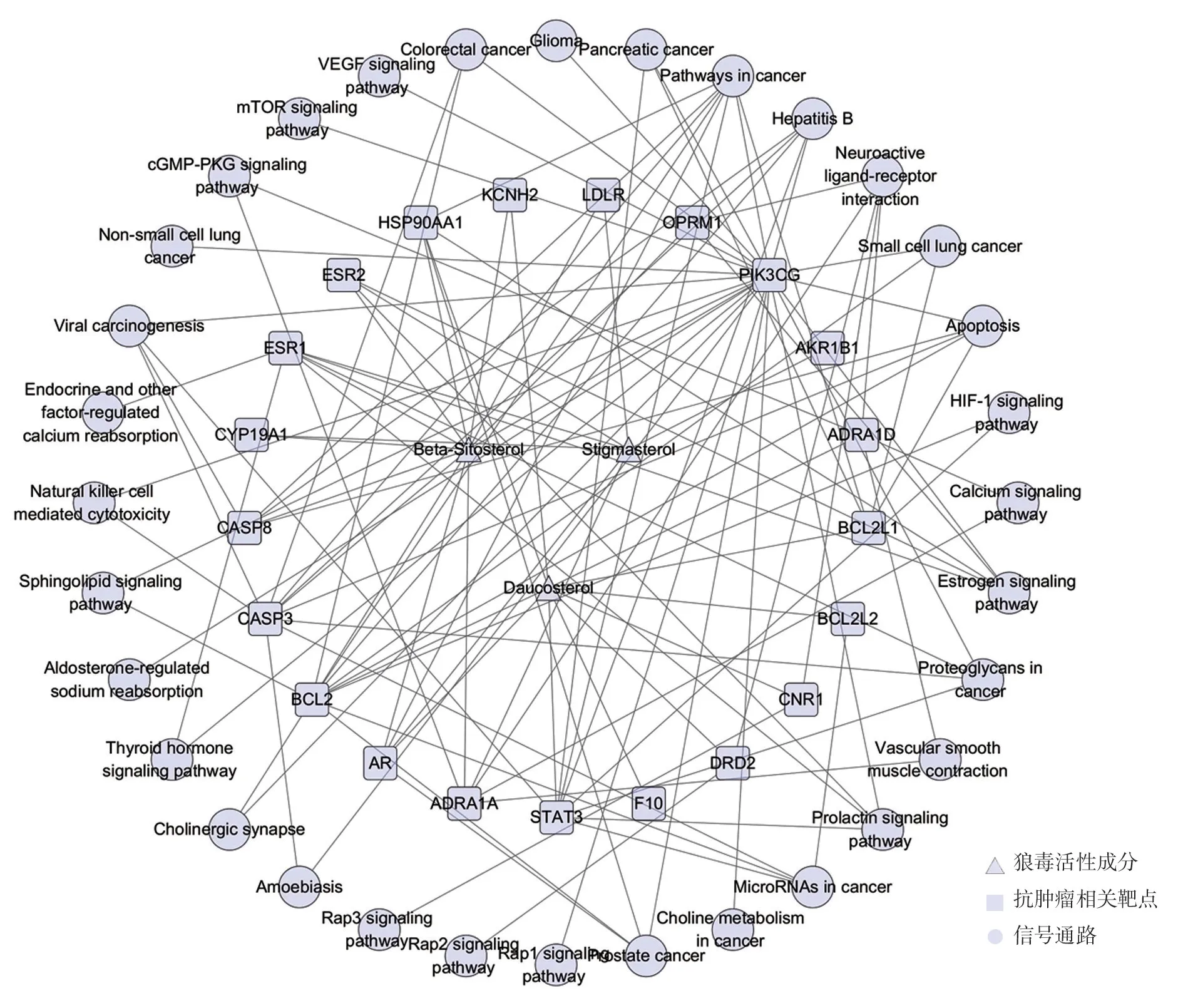
图7 狼毒主要活性成分-抗肿瘤相关靶点-信号通路图
3.6 狼毒的抗肿瘤作用
小鼠接种H22 瘤株后,第5 天长出手触可感觉的肿瘤,之后小鼠因肿瘤增长快,体质量迅速增加,自主活动降低。与模型组比较,狼毒组肿瘤和体质量增长均较慢,自主活动降低不明显,肿瘤抑制率为32.23%(P<0.05),见表4。小鼠耳肿胀结果显示,模型小鼠平均耳肿胀度为0.021±0.007,狼毒组平均耳肿胀度为0.013±0.003,肿胀抑制率为39.19%(P<0.05),见表5。瘤组织血管通透性检测表明,狼毒组的瘤组织伊文思蓝渗透性低于模型组(P<0.05),见表5。荷瘤小鼠小鼠凝血功能检测表明,狼毒组断尾和毛细管凝血时间均长于模型组(P<0.05),见表6。
表4 对小鼠H22 皮下肿瘤生长的影响()

表4 对小鼠H22 皮下肿瘤生长的影响()
与模型组比较,*P<0.05
表5 对荷瘤小鼠耳肿胀和瘤组织血管通透性的影响()

表5 对荷瘤小鼠耳肿胀和瘤组织血管通透性的影响()
与模型组比较,*P<0.05
表6 对荷瘤小鼠凝血功能的影响()

表6 对荷瘤小鼠凝血功能的影响()
与模型组比较,*P<0.05
4 讨论
网络药理学是通过系统方法分析药物对生物网络的作用和影响,从整体角度认识和预测药物靶点的方法,本研究利用网络药理学方法,筛出狼毒6 种活性成分,主要通过NR3C1、ESR1、CASP8、BCL2、CASP3、AR、PIK3CG、STAT3 等靶点,参与“HIF-1 信号通路”“PI3K-Akt 信号传导”“Rap1”等信号通路。HIF-1 信号通路是机体为了应对缺氧胁迫形成的复杂反应机制,参与VEGF 的表达以及肿瘤的生长[21-22]。HIF-1α 能被Hsp90、PI3K-Akt 激活,从而促进Cox-2 和BNIP3 等因子的表达。PI3K-Akt 信号通路可通过抗细胞凋亡,促进细胞增殖与分化,促进肿瘤细胞侵袭性转移,增加化疗耐药性等方面促进肿瘤的发生与发展[23]。Rap1 信号通路可促进细胞增殖,它参与整合素介导的细胞黏附过程,促进癌细胞增殖、黏附与侵袭[24]。狼毒活性成分可与上述信号通路中多个重要靶点发生作用,可能是狼毒抗肿瘤的主要机制,其中通路主要活性成分是胡萝卜苷、豆甾醇、β-谷甾醇。
狼毒中的β-谷甾醇、豆甾醇等活性成分通过GABR、PTGS、ESR、HSP90、NR3C1 靶点参与“NOD样受体信号通路”“NF-κB”等信号通路。NF-κB 信号通路与机体免疫调节、炎症反应、细胞周期调控、细胞分化等生理病理过程密切相关[25-26]。有研究发现,阻断NF-κB 介导的信号传导可减轻炎性损伤,而NOD 样受体家族的成员NOD1 可促进NF-κB激活,参与炎性损伤。狼毒活性成分也可与上述信号通路中多个重要靶点发生作用,这可能是狼毒抗炎、改善荷瘤小鼠生存质量的主要机制。
动物肿瘤模型是筛选和评价抗肿瘤药物的有效手段,常用的动物肿瘤模型有自发性肿瘤模型、诱发性肿瘤模型和移植性肿瘤模型,其中移植性肿瘤模型有实验周期短、肿瘤发病时间一致、肿瘤大小均匀等优点,是最常用于筛选和评价抗肿瘤的药物。本研究采用小鼠H22 肿瘤模型观察狼毒水煎液对肿瘤生长的影响,其肿瘤抑制率为32.23%,达到了抗肿瘤中药活性筛选标准,证实了其确切的抗肿瘤作用。因为炎症和肿瘤发展密不可分,本研究也在荷瘤小鼠体内观察了狼毒水煎液对耳肿胀的影响,发现其对荷瘤小鼠也有明显抗炎作用,与常规肿瘤化疗药物通常引起损伤性炎症明显不同。另外,本实验研究发现,狼毒也能降低肿瘤组织血管通透性和改善小鼠凝血,提示狼毒多途径抗肿瘤、抗炎改善小鼠生活质量。近年报道[27-28]狼毒提取物在抗白血病、抗病毒、抗菌、止痛及改善免疫功能方面也具有良好的效果。杨柯等[29]发现,狼毒大戟可将肿瘤细胞阻滞在G0/G1期,在促进癌细胞凋亡方面发挥了作用,证实了我们的预测结果。
综上所述,狼毒的抗肿瘤活性成分可能是胡萝卜苷、豆甾醇、β-谷甾醇,其抗肿瘤作用与阻止“HIF-1 信号通路”“PI3K-Akt 信号传导”“Rap1 信号通路”“NF-κB”等信号通路减轻荷瘤小鼠炎症,改善肿瘤组织血管通透性及小鼠凝血功能有关,为进一步研究其抗肿瘤组分和作用机制奠定了基础。
