miR-212在老年前列腺癌患者中的表达及其对癌细胞增殖、侵袭、转移的影响机制研究*
2021-02-23邬宇龙陈进渠许丽明
郑 博,刘 欣,邬宇龙,陈进渠,许丽明△
1.厦门市第五医院泌尿外科,福建厦门 361000;2.厦门医学院附属第二医院放射影像科,福建厦门 361000
前列腺癌是男性最常见的高异质性肿瘤,随着肿瘤细胞的增殖和浸润易发生骨转移。据报道,约70%前列腺癌患者可发生骨转移[1]。该病的高异质性给临床治疗带来巨大挑战,对患者短期生存率有较大影响。学者根据其异质性确定了前列腺癌患者不同基因组变化及其介导的不同信号通路,许多因子在上皮-间质转化(EMT)过程中发现其表达、分布及功能的改变,多为转化生长因子β(TGF-β)、Snail、catenin、基质金属蛋白酶(MMP)等[2-3]。最新研究显示,EMT通路参与细胞增殖、侵袭、转移等多种细胞行为学过程[4],且前列癌细胞不表达Snail、catenin等情况下仍能发生EMT,提示在前列腺癌复杂的生物学行为中可能存在其他更为特异性的调控机制。微小RNA(miRNA)是一类内源性非编码单链的高度保守RNA,为转录后调控因子,其与多种恶性肿瘤发生和发展的关系已有较多报道[5-6]。miR-212是近年发现的miRNA家族中的一个重要分子,具有较强特异度和灵敏度,考虑可能通过介导EMT信号通路参与前列腺癌生物学行为。本文主要探讨miR-212在老年前列腺癌患者中的表达及其对癌细胞增殖、侵袭、转移的影响机制,现报道如下。
1 材料与方法
1.1材料
1.1.1组织标本、细胞株 经病理档案室收集2017年10月至2019年10月于厦门市第五医院行手术确诊的前列腺癌患者60例的癌组织标本及配对癌旁正常组织标本为材料,术中组织液氨冷冻后放入-80 ℃保存;24株人前列腺癌PC-3细胞购自上海北诺生物科技有限公司,研究获得厦门市第五医院医学伦理会批准,实验符合癌细胞处理和使用相关规定。
1.1.2重组慢病毒转染细胞 接种对数生长期的PC-3细胞,加DMEM培养液(上海辅泽商贸有限公司;含10%胎牛血清,购自郑州九龙生物制品),置于WJ-3-160T型CO2培养箱(上海新诺仪器设备有限公司)中培养;待细胞融合度达到70%~80%,换无血清的培养基同步化24 h,按照Lipofectamine 2000转染说明书(上海恒斐生物科技有限公司)进行转染;将24株人前列腺癌PC-3细胞分为空白组(不作任何处理)、对照组(转染空白miR-212对照)、miR-212组(转染miR-212 mimics),每组各8株,转染72 h后观察转染效果。
1.2方法
1.2.1miR-212相对表达水平检测 PBS(Solarbio)冲洗癌细胞和癌旁正常细胞,RIPA蛋白裂解液(北京普利莱基因有限公司)裂解后取上清液,BCA试剂盒(武汉博士德生物科技有限公司)测定蛋白质水平;依次上样、电泳、转膜、封闭、漂洗,加miR-212一抗(1∶500)、GAPDH一抗(1∶2 000),4 ℃冰箱过夜;漂洗后加二抗,25 ℃摇床1 h;漂洗后用ECL发光试剂盒(上海联迈生物工程有限公司)曝光、显影。
1.2.2细胞增殖率检测 接种对数生长期PC-3细胞制成单细胞悬液,细胞贴壁后加10 μL CCK-8溶液,培养180 min;BIOBASE-EL10B酶标仪测定吸光度(A)值,细胞增殖率(%)= (A研究组细胞/A空白组细胞)×100%。计算转染后12、24、36、48 h的细胞增殖率。
1.2.3细胞侵袭能力检测 Transwell小室上室中加5×108/L的PC-3细胞和60 μL基质胶,下室中加600 μL含10%胎牛血清的DMEM培养液,培养24 h;取下室液体,4%多聚甲醛溶液(南京森贝伽生物科技有限公司)固定15 min,HE染色试剂盒染色30 min,观察并计算穿过小室膜的平均细胞数,以此表示细胞侵袭能力。
1.2.4细胞转移率检测 PC-3细胞中加0.25%胰蛋白酶(广州达晖生物技术股份有限公司)调整细胞浓度至2×108/L,接种并待细胞融合度达80%后,用枪头沿着与皿底垂直方向划痕;PBS缓冲液洗涤3次,加入无血清培养基,培养24 h,观察细胞迁移轨迹。
1.2.5双荧光素酶报告实验 参照生物信息预测网站预测miR-212和EMT结合片段,将扩增的EMT3′-UTR序列插入到含有miR-212质粒的位点中,构建EMT3′-UTR荧光素酶报告载体EMT-WT (野生型)及突变载体EMT-MUT(突变型);与空白组、对照组、miR-212组共转染至PC-3细胞,Dual-Luciferase报告基因试剂盒检测细胞荧光活性,分析miR-212与EMT结合的关系。
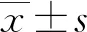
2 结 果
2.1前列腺癌组织和癌旁正常组织miR-212表达情况比较 miR-212在前列腺癌组织中呈低表达,在癌旁正常组织中呈高表达,见图1。前列腺癌组织和癌旁正常组织中miR-212的相对表达水平分别为1.78±0.25、3.38±0.41,前列腺癌组织中miR-212的相对表达水平低于癌旁正常组织,差异有统计学意义(P<0.05)。
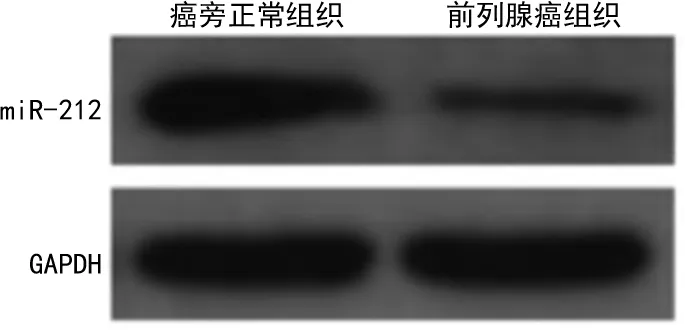
图1 前列腺癌组织和癌旁正常组织中miR-212表达图(Western blot法)
2.2空白组、对照组和miR-212组PC-3细胞增殖率比较 转染miR-212后,PC-3细胞增殖受到抑制;24、36、48 h时,miR-212组PC-3细胞增殖率低于对照组、空白组(P<0.05),空白组和对照组PC-3细胞增殖率比较差异无统计意义(P>0.05)。见表1。
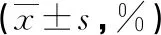
表1 空白组、对照组和miR-212组PC-3细胞在不同时间的增殖率比较
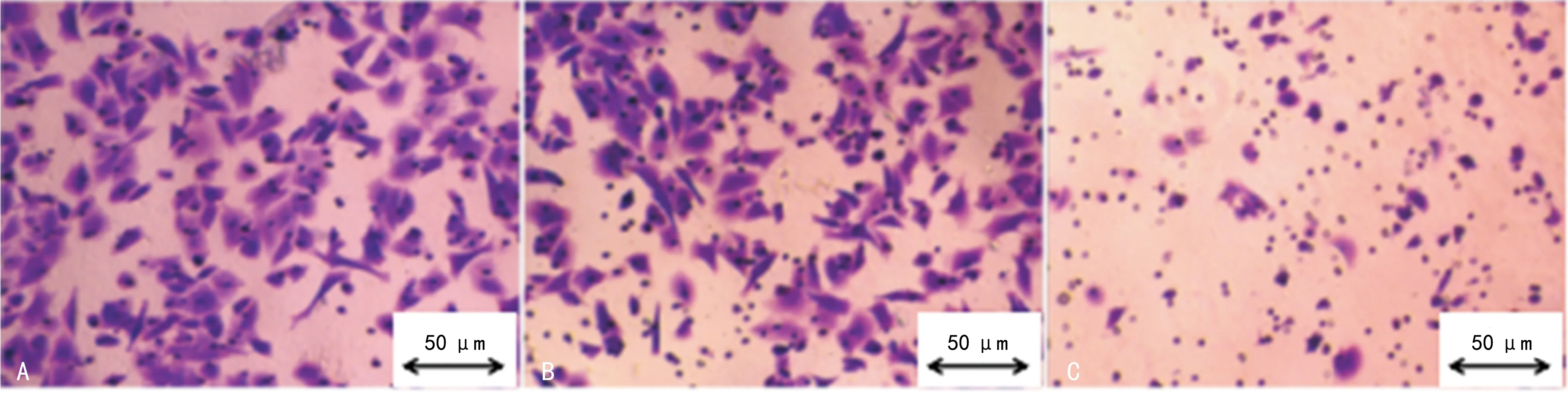
2.3空白组、对照组和miR-212组PC-3细胞侵袭能力比较 空白组、对照组PC-3细胞向器官表面靠拢,基底层可见较多伪足,形成的癌巢较大;miR-212组PC-3细胞较少,不见伪足或仅有少量伪足,未形成癌巢,见图2。转染miR-212后,PC-3细胞侵袭能力受到抑制;miR-212组PC-3细胞侵袭能力低于对照组、空白组(P<0.05);空白组和对照组PC-3细胞侵袭能力比较,差异无统计意义(P>0.05)。见图3。
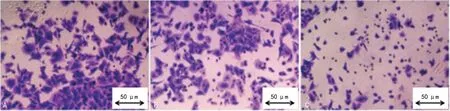
注:A表示空白组,B表示对照组,C表示miR-212组。
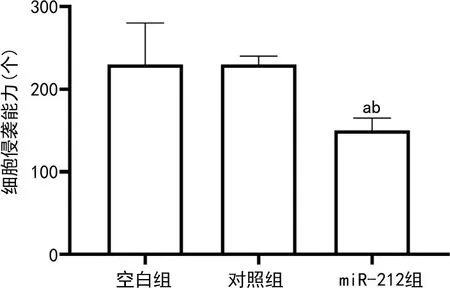
注:与空白组比较,aP<0.05;与对照组比较,bP<0.05。
2.4空白组、对照组和miR-212组PC-3细胞转移率比较 空白组、miR-212组PC-3细胞在划痕48 h后逐渐愈合,划痕变小,miR-212组PC-3细胞在划痕48 h后未发生愈合,划痕甚至变大,见图4。转染miR-212后,PC-3细胞转移能力受到抑制;miR-212组PC-3细胞转移率低于对照组、空白组(P<0.05);空白组和对照组PC-3细胞转移率比较,差异无统计意义(P>0.05),见图5。
2.5miR-212和EMT转染后荧光素酶活性分析 miR-212与EMT-WT共转染后细胞荧光活性显著低于对照组与EMT-WT共转染后细胞荧光活性(P<0.05);空白组与对照组比较,与EMT-WT共转染后细胞荧光活性差异无统计意义(P>0.05)。空白组、对照组、miR-212组与EMT-MUT共转染后细胞荧光活性差异无统计意义(P>0.05)。见图6。
注:A表示空白组,B表示对照组,C表示miR-212组。
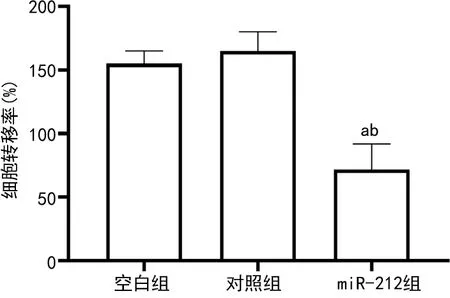
注:与空白组比较,aP<0.05;与对照组比较,bP<0.05。
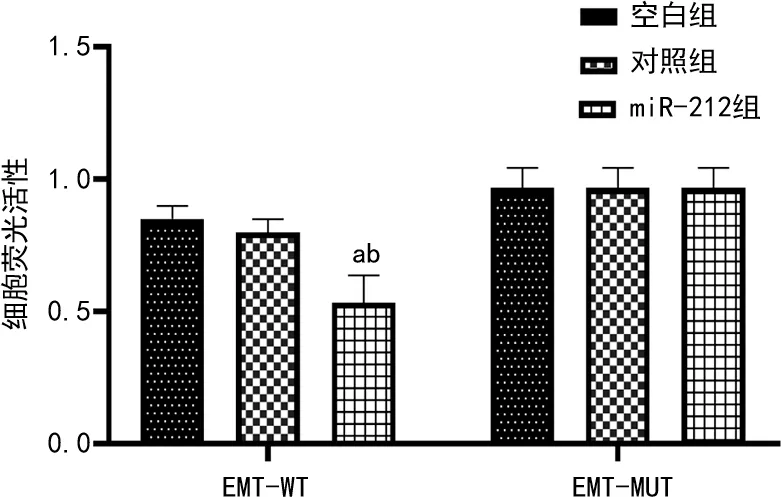
注:与空白组比较,aP<0.05;与对照组比较,bP<0.05。
3 讨 论
前列腺癌发生骨转移后可表现为骨骼疼痛、病理性骨折、瘫痪、行为能力降低、骨髓抑制性贫血等,直接影响患者预后和生存质量。随着分子治疗的深入研究,目前关于前列腺癌生物学行为、细胞基础、相关细胞因子及其与关键的细胞信号转导通路的报道较多,最新研究认为,EMT是促进前列腺癌增殖和转移的关键性因素[7-8]。且EMT过程中多种细胞因子发挥重要作用,笔者认为筛选出其中特异性因子可为前列腺癌的防治提供新的治疗靶点。miR-212自发现以来已被证实可参与多种肿瘤细胞的增殖、侵袭和转移过程。DING等[9]研究显示,miR-212在胰腺癌组织中低表达,且低表达miR-212组侵袭能力更高。李耀辉等[10]研究指出,高表达miR-212可促进膀胱癌细胞增殖、转移、侵袭过程。SHA等[11]的体外实验结果显示,miR-212在肝癌细胞中低表达,可调节肿瘤细胞与肿瘤微环境的相互作用。miR-212在前列腺癌中低表达,上调miR-212表达可抑制癌细胞血管浸润和淋巴结转移,且预示着该病预后较好[12]。本文前列腺癌组织中miR-212呈低表达,与上述研究一致。本文采用CCK-8法检测不同时间对前列腺癌PC-3细胞增殖的影响,结果显示出,过表达miR-212可有效抑制癌细胞生长增殖,提示miR-212在参与前列腺癌病理性进展中发挥抑癌作用。根据转染时间图发现,过表达miR-212对前列腺癌细胞作用机制呈时间依赖性,时间越长,抑制效果越明显。汤利等[13]的平板克隆实验结果显示,转染miR-212细胞可明显降低单细胞克隆形成率,达到有效抑制膀胱癌细胞增殖的作用。本文Transwell小室实验结果表明,转染组穿过小室膜的细胞数更低,细胞转移率也更低,表明miR-212可有效降低前列腺癌细胞侵袭、转移能力,证实miR-212是一种可在体内外调节肿瘤细胞侵袭和转移的调控因子。SHKURNIKOV等[14]研究发现,miR-212能扩大其他众多癌基因转录,其主要通过靶向调节特异性信号蛋白通路来抑制前列腺癌的侵袭能力。本文通过双荧光素酶报告实验结果显示,miR-212组与EMT-WT共转染后的细胞荧光活性显著低于对照组与EMT-WT共转染后的细胞荧光活性,结合国内外研究结果[15-16],提示miR-212可通过靶向调节EMT信号通路影响前列腺癌细胞的增殖、转移、侵袭能力。
miR-212在前列腺癌组织中呈低表达,过表达miR-212可通过靶向调节EMT信号通路抑制前列腺癌细胞的增殖、侵袭、转移能力,有望成为前列腺癌的一种新的生物治疗靶点。但由于时间限制,样本量小,且前列腺癌进展受多种因素影响,仍需设计更为严密的、多中心、大样本、双盲研究进一步分析相关生物学行为机制。
