纳豆银杏紫苏软胶囊毒理学安全性研究
2021-02-23张勋力张迎庆
王 婷,黄 妍,谭 蒙,彭 敏,张勋力,张迎庆
(1 湖北工业大学生物工程与食品学院,湖北 武汉 430068; 2 北京纳百恩食品有限公司,北京 102200)
纳豆、银杏、紫苏拥有悠久的食用或药用历史[1-3]。纳豆具有辅助降血脂、调节血糖、增强免疫力、抗衰老等功效[4-6];银杏具有抗氧化、拮抗血小板活化因子、降血脂、改善循环、保护心脏、提高免疫力、抗炎、抗病毒、抗肿瘤及抗衰老等作用[7-8];紫苏油具有降低血脂、减少心脑血管疾病、促进发育、增强智力、提高记忆力、调节免疫、延缓衰老、预防老年痴呆症等作用[10-13];本研究在前期研究[14]的基础上,探索纳豆冻干粉、银杏提取物、紫苏籽油复配软胶囊的动物毒理学安全性,并为研究和开发纳豆、银杏和紫苏同类产品提供参考。
1 材料和方法
1.1 样品
纳百恩牌纳豆银杏紫苏软胶囊,由北京纳百恩食品有限公司提供(主要原料有纳豆冻干粉、银杏叶提取物、紫苏籽油、蜂蜡,每100 g含有总黄酮1.5 g,a-亚麻酸40.3 g)。样品规格,0.5 g/粒;产品批号,20101011;储存条件,阴凉干燥处。口服,推荐每人(成人)2次/d,每次2粒,按60 kg为一个成人的体重计算,折合之后的计量为33.3 mg/kg BW。取纳豆银杏紫苏胶囊内容物作为试验的样品。
1.2 实验动物及环境
健康级别为SPF级的昆明种小鼠,由广西医科大学实验动物中心选育繁殖,用于实验中的动物生产许可证号为SCXK(桂)2009-0002,其质量合格证号为0001270;健康级别为SPF级SD种大鼠,由广东省医学实验动物中心选育繁殖,用于实验中的动物生产许可证编号为SCXK(粤)2008-0002,质量合格证号为0062774。实验中的动物室是一个屏障系统,其使用许可证号为SYXK(桂)2007-0003。动物室的温度为22~25 ℃,相对湿度为55%~70%。
1.3 小鼠急性经口毒性试验
采用最大剂量试验法[15],实验选用昆明种小鼠20只,体重在18~22 g区间内,雌雄各半。试验前期,小鼠禁食16 h,但是不限饮水。因为样品很难溶于水,所以用玉米胚芽油作溶剂,准确称量50.0 g样品,添加玉米胚芽油至100 mL后混合均匀,即配制成500 mg/mL浓度的溶液,然后对小鼠进行3次灌胃(每隔4 h一次),每次灌胃的剂量为0.4 mL/20 g BW,总计量为30000 mg/kg BW。灌胃后观察并记录下小鼠的中毒情况。每星期称量一次小鼠的体重,观察2个星期。试验结束后解剖小鼠,对小鼠进行大体观察。根据毒性分级标准评估受试物的急性毒性。
1.4 Ames 试验
采用TA97a、TA98、TA100、TA102进行试验。通过鉴定,选取符合要求的组氨酸缺陷型的鼠伤寒沙门氏菌。通过二甲基亚砜可以将样品分别配制成50、10、2、0.4、0.08 mg/mL等5个浓度,并将其作为受试溶液,对样品进行高压灭菌(0.103 MPa 20 min)处理后供试验用。用以PCB诱导的大鼠肝微粒体酶(S-9)作为实验的体外代谢激活系统。实验采用平板摻入法,首先将0.1 mL试验菌株增菌液、0.1 mL受试物溶液和0.5 mL S-9混合液(当需要代谢活化时)依次加入保温的顶层培养基中,混合均匀后再倒入底层培养基平板中。5个试验组的剂量分别为:5000、1000、200、40、8 μg/皿,同时设置回归对照组、溶剂对照组和阳性突变剂对照组。除了不加样品外,回归对照的其余条件均与样品组一致。在溶剂对照组中,用二甲亚砜替代样品,其余条件均与样品组保持一致。各个剂量组的各种菌株均做3个平行皿处理。在37 ℃的环境下培养48 h左右,计下每皿的菌落数,整个试验的流程在相同条件下重复做2次。如果受试物的回变菌落数的增加超过自发回变菌落数的2倍以上,且存在剂量-反应关系,即该诱变试验为阳性[16]。
1.5 小鼠骨髓细胞微核试验
试验采用2次经口灌胃的方法进行,每次时间间隔24 h。选取昆明小鼠50只作为实验动物,它们的体重均在25~30 g间,按照雌雄各半的要求随机分成5个组别,每组各10只小鼠。试验组设置为3组,3个剂量分别设为10000、5000、2500 mg/kg BW,用玉米胚芽油作为阴性对照,用40 mg/kg BW剂量的环磷酰胺(cp)作为阳性对照。分别依次准确称量20.0、10.0、5.0 g的样品,各自依次加入玉米胚芽油至40 mL,然后混合均匀,将其配制成500、250、125 mg/mL浓度的样品溶液,然后按0.4 mL/20 g BW 的剂量给小鼠进行灌胃,阴性对照组给予等量的玉米胚芽油进行灌胃,阳性对照组给予等量的环磷酰胺溶液(2 mg/mL)进行灌胃。在第2次给样后的6 h后,采用颈椎脱臼法处死小鼠,取出小鼠的胸骨骨髓然后用小牛血清稀释涂片,用甲醇固定,在光学显微镜下进行Giemsa染色,每1000个嗜多染红细胞(PCE)一只小鼠,用含微核的PCE千分率计算微核率,同时计数200个PCE,计算出PCE/NCE的值。统计处理采用泊松分布均数比较法[15]。如试验组的微核率高于阴性对照组,且两者之间存在显著的剂量-反应关系和统计学意义,即为阳性结果。
1.6 小鼠精子畸形试验
选取50只健康的昆明种雄性小鼠,其体重在25~35 g之间,将所选的小鼠随机分为5组,每组包含10只。设置3个试验组,剂量分别设为10000、5000、2500 mg/kg BW,用玉米胚芽油作为阴性对照,用40 mg/kg BW剂量的环磷酰胺(cp)作为阳性对照[17]。分别准确称量样品20.0、10.0、5.0 g,然后加入玉米胚芽油直至40 mL,混合均匀、最后可配制成500、250、125 mg/mL浓度的样品溶液,按照0.4 mL/20 g BW的剂量给小鼠进行灌胃,阳性对照组用等量的2 mg/mL环磷酰胺对小鼠进行灌胃。灌胃的频率为1次/d,连续灌胃5 d。小鼠在最后一次给样后的第30天被处死,取出小鼠副睾的精子涂片,用甲醇固定,伊红染色。在光镜下,每只小鼠统计1000个完整精子,采用χ2检验统计处理并计算精子畸形率。如果试验组的精子畸形率高于阴性对照组的精子畸形率,并且存在显著剂量-反应关系和统计学意义,即为阳性结果。
1.7 大鼠30 d喂养试验
1.7.1 剂量选择与受试物的给予方式选取健康级别为SPF级SD种大鼠80只,雌雄各一半,雄鼠的体重为74.4±3.6 g,雌鼠的体重为68.3±3.5 g。将所选的大鼠随机分为4组,1组为阴性对照组,3组为试验组,每组分别为20只大鼠,雌雄各半。3个试验组的剂量分别设为3333、2500和1667 mg/kg BW,这些剂量分别相当于人体推荐剂量的100、75和50倍。准确称量样品33.30、25.00、16.67 g,然后再加入玉米胚芽油至100 mL,混合均匀后将其配制成333.3、250.0、166.7 mg/mL浓度溶液,相应剂量组按1.0 mL/100 g BW的剂量给大鼠进行灌胃,阴性对照组给大鼠灌给等量的玉米胚芽油,1次/d,连续灌胃30 d。
1.7.2 实验方法在实验过程中,所有大鼠在一个笼子里饲养,且都用普通饲料喂养,并且令大鼠自由摄食饮水。每天观察大鼠的生长发育和食物利用率。在实验后期,大鼠禁食过夜(禁食16 h,不限制饮水),称大鼠空腹时的体重,并处死大鼠,采集2份血样,取其中一份血抗凝用血球计数仪检验Hb、RBC、WBC及其分类、PLT等;取另一份血不抗凝分离出血清,然后用试剂盒和全自动生化分析仪检测血清AST、ALT、BUN、Cr、TC、TG、Glu、TP、Alb等项目。采血后,解剖大鼠并对其进行大体观察,称量肝脏、肾脏、脾脏和睾丸等器官的重量,计算脏器与机体的比值,然后对肝脏、肾脏、脾脏、胃、十二指肠、睾丸和卵巢等器官进行病理组织学检查[18]。各剂量组的大鼠大体肉眼检查没有看见明显病变和生化指标变化时,仅对高剂量组和对照组大鼠的主要器官进行组织病理学检查,如果发现有病变情况,再分别检查中、低剂量组相应器官及组织。
1.7.3 实验数据统计采用SPSS统计软件进行单因素方差分析。在统计分析过程中,首先要对数据的方差齐性进行检验。如果方差齐,则采用单因素方差分析进行总体比较,发现差异后,再用多剂量组均值与对照组均值的两两比较采用Dunnett检验。如果方差不齐,则应将数据转换为适当的变量,在数据满足方差齐性检验后,对转化后的数据进行统计分析;若转换后数据仍然不满足方差齐性的要求,则采用秩和检验的方法统计分析[19]。
2 结果
2.1 急性经口毒性试验
将纳豆银杏紫苏软胶囊对小鼠的急性毒性试验结果列入表1。从表1可以看出,对小鼠用最大剂量(剂量为30000 mg/kg BW)的样品进行灌胃后,小鼠生长状态良好,未出现中毒症状。试验结束后解剖小鼠,并对小鼠进行大体观察,肝、肾、脾、心、肺等主要器官均没有发现明显异常,故样品按急性毒性分级属无毒级。
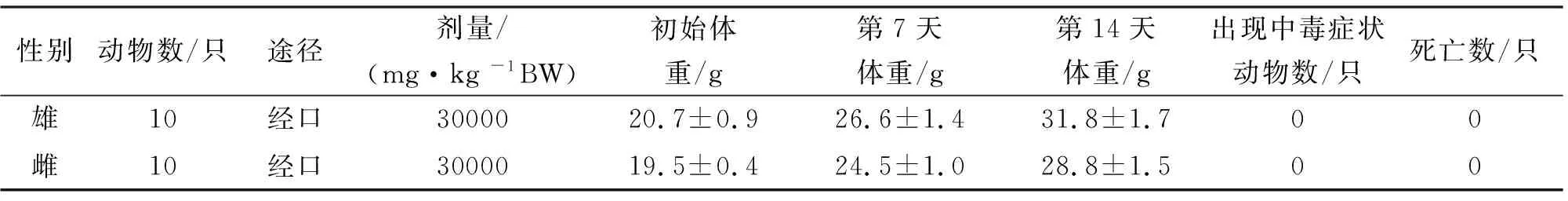
表1 纳豆银杏紫苏软胶囊对小鼠的急性毒性试验结果
2.2 Ames试验
从表2、表3可以看出,4种试验菌株TA97a、TA98、TA100、TA102,无论S-9有没有加入,样品各剂量组的回变菌落数都没有超过自发回变菌落数的2倍,也没有剂量-反应关系,表明该受试物诱变试验的结果为阴性。
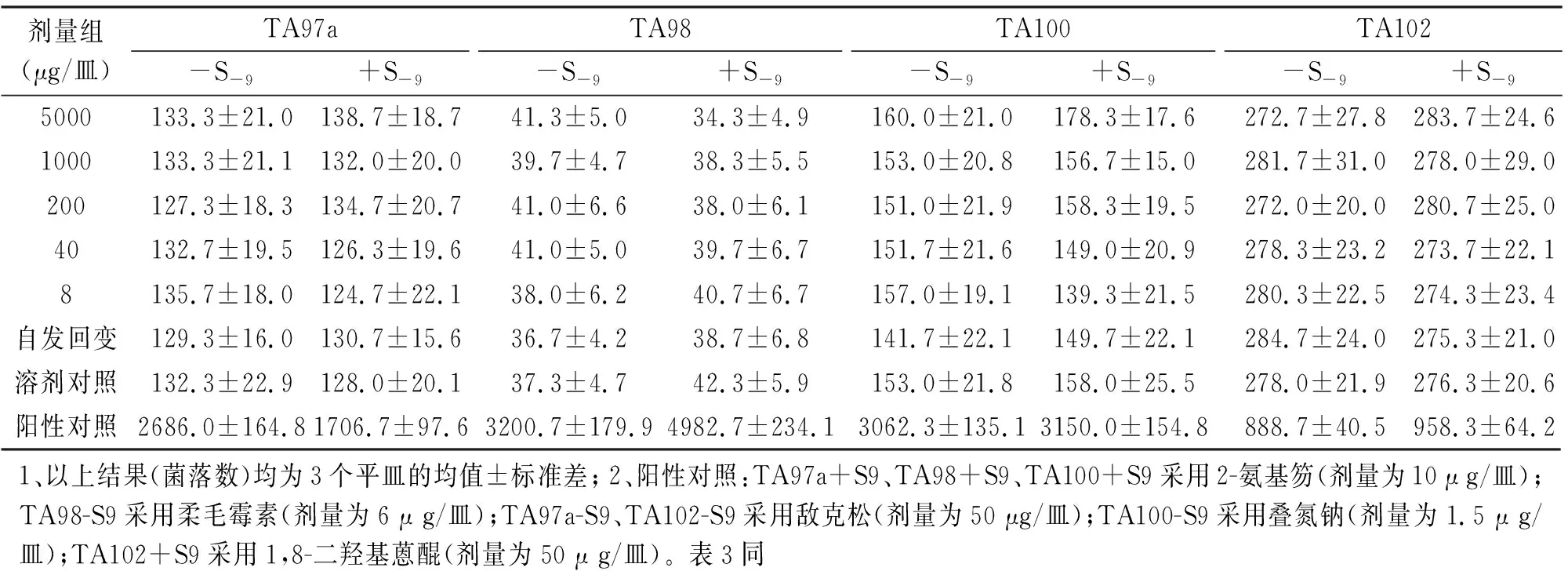
表2 纳豆银杏紫苏软胶囊Ames试验结果(第1次)
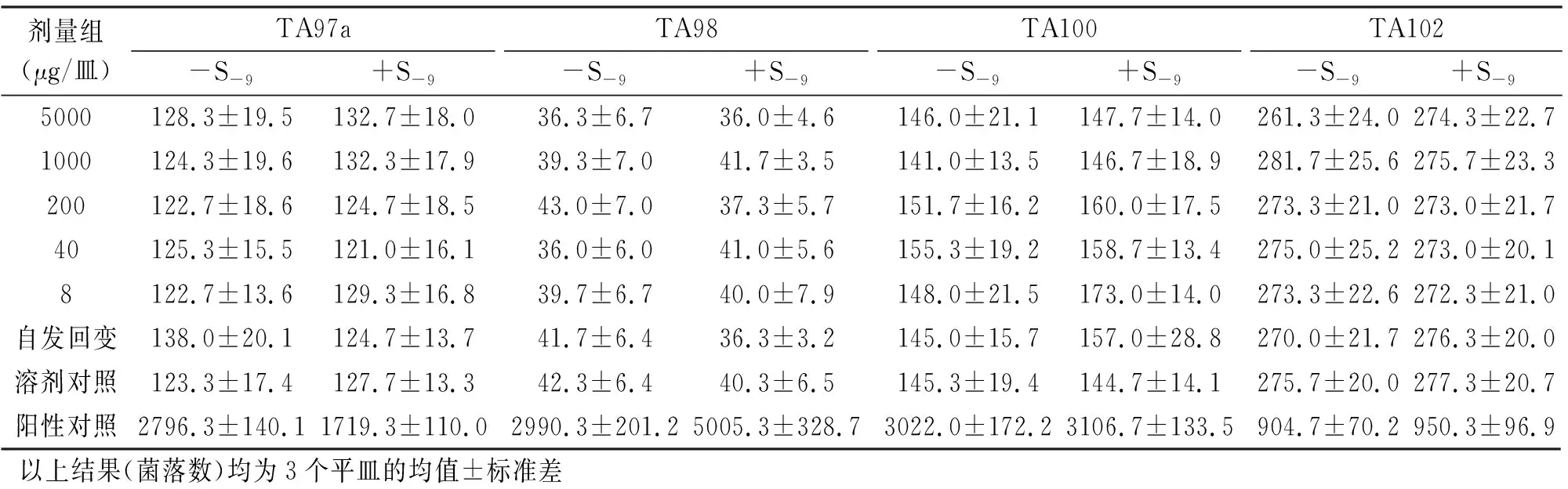
表3 纳豆银杏紫苏软胶囊Ames试验结果(第2次)
2.3 小鼠骨髓细胞微核试验
从表4可以看出,各剂量组小鼠的骨髓细胞微核率与阴性对照组比较无显著性差异(P>0.05),而阳性对照组与阴性对照组比较有极显著性差异(P<0.01)。该样品对小鼠的骨髓细胞没有产生损伤作用。

表4 纳豆银杏紫苏软胶囊对小鼠的骨髓细胞微核发生率的影响
2.4 小鼠精子畸形试验
从表5可以看出,试验小鼠精子畸形发生率并没有发生显著变化,样品各剂量组的精子畸形率与阴性对照组比较差异均无统计学意义(P>0.05),而环磷酰胺的阳性对照组与阴性对照组比较差异有统计学意义(P<0.01)。所以本实验样品对小鼠精子未产生畸变作用。
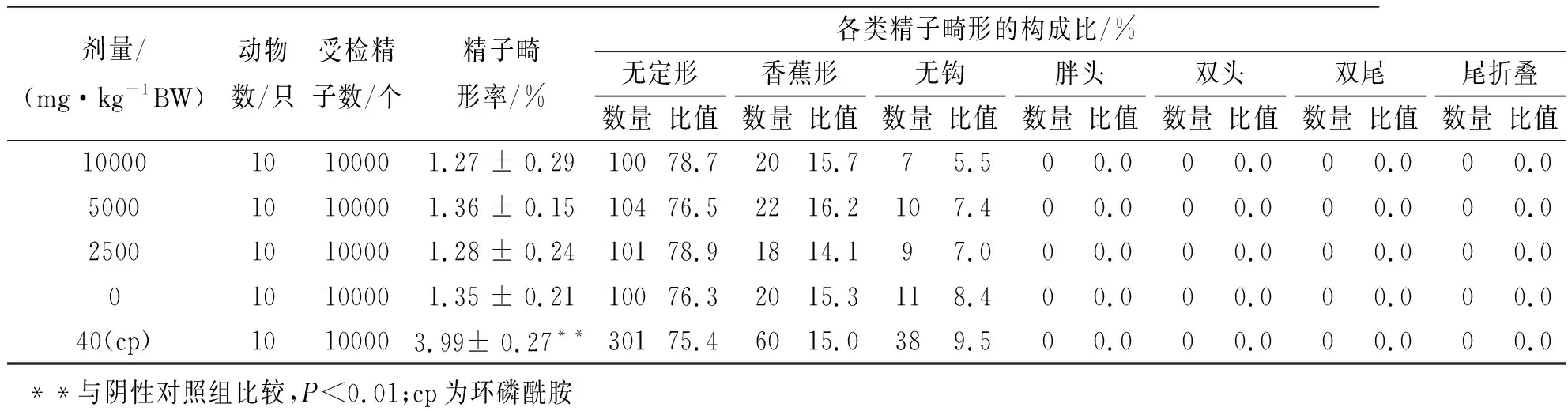
表5 纳豆银杏紫苏软胶囊对小鼠精子畸形发生率的影响
2.5 大鼠30 d喂养试验
2.5.1 动物一般表现在实验过程中,各组大鼠生长发育状态良好,没有大鼠出现异常行为和中毒表现。
2.5.2 样品对大鼠体重及食物利用率的影响对大鼠用3333、2500、1667mg/kg BW剂量的纳豆银杏紫苏软胶囊内容物进行灌胃30 d。在实验过程中,样品的每个剂量组雌雄大鼠的体重,每周的体重增量、每周食物摄入量及食物总摄入量、每周食物利用率及总食物利用率与对照组对比,没有显著性差异(P>0.05),这就表明,该样品对大鼠的体重增长和食物利用率均没有明显的影响。
2.5.3 样品对大鼠血常规指标的影响对大鼠用3333、2500、1667 mg/kg BW剂量的纳豆银杏紫苏软胶囊内容物进行灌胃30 d,样品的各剂量组雌、雄性大鼠的血红蛋白、红细胞总数、白细胞总数及其分类、血小板数与对照组相应各指标比较,均无发现显著性差异(P>0.05),可知该样品对大鼠的血常规指标没有明显的影响效果。
2.5.4 样品对大鼠血液生化指标的影响对大鼠用3333、2500、1667 mg/kg BW剂量的纳豆银杏紫苏软胶囊内容物进行灌胃30 d,比较样品各剂量组雌、雄性大鼠的血清谷草转氨酶、谷丙转氨酶、尿素氮、肌酐、胆固醇、甘油三酯、总蛋白、白蛋白、血糖与对照组的相应指标,并没有出现显著性差异(P>0.05),大鼠的血液生化指标无明显变化,即样品对其无明显影响。
2.5.5 样品对大鼠脏器重量及脏器/体重比值的影响对大鼠用3333、2500、1667 mg/kg BW剂量的纳豆银杏紫苏软胶囊内容物进行灌胃30 d,每个剂量组的大鼠的肝、肾、脾、雄鼠睾丸重量和肝/体、肾/体、脾/体、雄鼠睾丸/体比值与对照组相比较,均没有出现显著性差异(P>0.05),大鼠的脏器重量及脏器/体重比值也没有明显的变化,即样品对大鼠的脏器重量及脏器/体重的比值没有明显影响。
2.5.6 解剖大体观察及组织学检查结果实验结束对大鼠进行解剖,然后对各组大鼠进行大体观察,均没有发现明显病变状况。因此仅选择高剂量组和阴性对照组动物的主要器官进行组织病理切片检查。结果表明,高剂量组仅有1例、对照组仅有2例雄性大鼠的肝脏组织可见肝细胞轻度脂肪变性,两组各有1例雌性大鼠的肝组织可见肝细胞点状坏死,高剂量组仅有1例雄性,而对照组有1例雄性和1例雌性大鼠的肝脏汇管区可见少量的炎性细胞浸润;高剂量组和对照组均有1只雌鼠肾脏皮质间质有少量的炎性细胞浸润。上述组织病变属于动物自发的轻度病变,并且两组动物的组织病变程度很相似,所以,样品所致的可能性可以基本排除。其他脏器组织没有出现组织病理学改变,说明该样品对大鼠的上述脏器组织没有损伤作用。
3 结论
给予小鼠最大剂量(剂量为30000 mg/kg BW)的样品灌胃后,没有出现动物有中毒症状或死亡现象,所以样品的急性经口毒性为无毒级。3种遗传毒性试验(Ames试验、小鼠骨髓细胞微核试验、小鼠精子畸形试验)的结果全部为阴性;30 d喂养试验中,用3333、2500、1667 mg/kg BW 等3个剂量(分别相当于人体推荐剂量的100、75、50倍)的样品连续30 d给大鼠进行灌胃,在实验过程中,动物的生长发育正常,各剂量组大鼠的体重、增重量、进食量、食物利用率、血常规指标、血液生化指标、脏器重量及脏器/体重的比值等都没有受到明显影响;对解剖后的大鼠进行大体观察和组织病理学检查,均未出现与样品有关的异常改变。在试验剂量范围内,没有出现该样品对大鼠产生毒副作用,即纳豆冻干粉、银杏提取物、紫苏籽油复配软胶囊具有良好的安全性,对动物健康无任何损害作用和毒副作用。
