人外周血单个核细胞的采集、分离和保存
2021-02-22ChinaMedicinalBiotechAssociation
·中国医药生物技术协会团体标准·
人外周血单个核细胞的采集、分离和保存

目 次
前言……………………………………………………………………………………………………………… 87
1 范围…………………………………………………………………………………………………………… 88
2 规范性引用文件……………………………………………………………………………………………… 88
3 术语和定义…………………………………………………………………………………………………… 88
4 总则…………………………………………………………………………………………………………… 89
5 实验原理……………………………………………………………………………………………………… 89
6 实验方法……………………………………………………………………………………………………… 89
7 质量控制……………………………………………………………………………………………………… 92
参考文献………………………………………………………………………………………………………… 93
前 言
本文件按 GB/T 1.1-2020 给出的规则起草。
本文件由中国医药生物技术协会归口。
本文件起草单位:中国医药生物技术协会组织生物样本库分会、生物芯片上海国家工程研究中心、上海芯超生物科技有限公司、广州中医药大学第二附属医院(广东省中医院)。
本文件主要起草人:郜恒骏、沈晓莹、杜莉利、亓垚、张小燕、许靖曼、陈明敏、陈曲波、叶扬、李迪。
人外周血单个核细胞的采集、分离和保存
1 范围
本文件规定了采集、分离和保存人外周血单个核细胞的实验原理、实验方法和质量控制。
本文件适用于科研用人外周血单个核细胞的采集、分离和保存,若用于临床,应按照临床相关要求进行操作。
2 规范性引用文件
下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 38576-2020 人类血液样本采集与处理
3 术语和定义
以下术语和定义适用于本文件。
3.1
外周血单个核细胞 peripheral blood mononuclear cell, PBMC
外周血中具有单个核的细胞,包含淋巴细胞、单核细胞、树突状细胞和其他少量细胞(造血干细胞等)。
3.2
淋巴细胞分离液 lymphocyte separation medium
一种密度介于1.075 ~ 1.090 g/ml 之间而近似于等渗的溶液,用它做密度梯度离心,使一定密度的细胞按相应密度梯度分布,从而将各种血细胞加以分离。
3.3
RPMI-1640 培养基 RPMI-1640 medium
洛斯维•帕克纪念研究所(Roswell Park Memorial Institute,RPMI)研发的一类细胞培养基,1640 是培养基代号。
3.4
二甲基亚砜 dimethyl sulfoxide, DMSO
非质子极性溶剂,常用于化学反应、PCR 反应以及在细胞、组织和器官的保存中用作玻璃化低温冷冻防护剂。DMSO 用于细胞冷冻培养基内,可以保护细胞免受冰晶引起的机械性损伤。它也可以用于主培养、亚培养、重组异倍体、杂交瘤等系列细胞株,胚胎干细胞(ESC)和造血干细胞的冷冻保藏。另外常常与BSA 或FBS 混合使用。
3.5
台盼蓝 trypan blue
也称台盼兰、锥虫蓝、曲利苯蓝,细胞活性染料,常用于检测细胞膜的完整性,检测细胞是否存活。活细胞不会被染成蓝色,而死细胞会被染成淡蓝色。台盼蓝可被巨噬细胞吞噬,故可用于巨噬细胞的活体染色剂。
3.6
知情同意 informed consent
供体对生物样本(本文件中为“外周血”)捐赠的目的和研究用途等明了和认可。以生物样本供体自愿同意参与为原则,以当事双方共同签署知情同意书为具体体现。
3.7
脱氧核糖核酸 deoxyribonucleic acid, DNA
染色体主要组成成分,同时也是主要遗传物质。
3.8
核糖核酸 ribonucleic acid, RNA
存在于生物细胞以及部分病毒、类病毒中的遗传信息载体。RNA 由核糖核苷酸经磷酸二酯键缩合而成的长链状分子。一个核糖核苷酸分子由磷酸、核糖和碱基构成。
4 总则
本文件采用密度梯度离心法进行人 PBMC 的分离,此方法适用范围广、性价比高、结果稳定。此外还有加速红细胞沉降法、塑料吸附法、Colotta 法、分离管法等。这些方法分离的 PBMC 应符合后续实验要求。
5 实验原理
外周血各种血细胞的密度不尽相同,利用淋巴细胞分离液作密度梯度离心,使一定密度的细胞群按相应密度梯度分布,从而将各种血细胞加以分离。红细胞、粒细胞密度大,离心后沉于管底;PBMC 的密度小于或等于分离液,离心后漂浮于分离液的液面上,也有少部分细胞悬浮在分离液中。吸取分离液液面的细胞,就可从外周血中分离到PBMC。
6 实验方法
6.1 材料
6.1.1 主要设备:生物安全柜、低温水平式离心机、血球计数板、显微镜、血细胞分离机等。
6.1.2 主要耗材:真空采血管(ACD/EDTA/肝素抗凝)、离心管、移液管、无菌吸头、冻存管、巴氏吸管、移液器、辅助移液器、注射器、无菌棉球、镊子、橡皮止血带等。
6.1.3 主要试剂:RPMI-1640 培养基、胎牛血清、DMSO、淋巴细胞分离液(20 ℃时密度为1.077 ±0.001 g/ml)、台盼蓝染色液、碘酒、75% 酒精等。
注:培养基也可用无血清培养基和营养添加物替代。
6.2 步骤
6.2.1 PBMC 的采集
6.2.1.1 获得供体知情同意后,按照 GB/T 38576-2020 常规无菌抽取新鲜外周血至 ACD/EDTA/肝素抗凝管中。
6.2.1.2 获得供体知情同意后,使用血细胞分离机,按照操作手册规范地采集;采集到的血液或细胞在采集、处理和运输过程中避免冷冻和冷藏,并尽快分离 PBMC。
6.2.2 PBMC 的分离
6.2.2.1 分离前的准备:洁净实验室(净化等级不低于百万级)的常规消毒,紫外灯照射洁净间和生物安全柜,且保持台面的整洁;准备好本次分离所需无菌耗材、RPMI-1640 培养基、胎牛血清、DMSO、淋巴细胞分离液等。淋巴细胞分离液和RPMI-1640 培养基应提前置于室温。
6.2.2.2 分离PBMC:取出无菌离心管,加入淋巴细胞分离液;同时将所得外周血样本用生理盐水/PBS 等体积稀释,并充分混匀,形成外周血的稀释液;再将稀释液加入到淋巴细胞分离液中,应将稀释液缓慢匀速地加至淋巴细胞分离液面之上,确保血液稀释液和淋巴细胞分离液形成明显分层(上层为血液稀释液,下层为淋巴细胞分离液)。
6.2.2.3 室温低速离心(500 ×,下同)20 min。
6.2.2.4 离心毕,可见离心管中液体形成明显分层,从上到下依次为血浆与生理盐水/PBS 混合液层、单个核细胞白膜层、人淋巴细胞分离液层及红细胞层。用巴氏管或无菌吸头小心吸取白膜层,置于新的离心管中,注意不要吸到淋巴细胞分离液;补充适量的细胞培养基或缓冲液,用移液管吹打均匀。
6.2.2.5 室温低速离心10 min。
6.2.2.6 吸弃上清液,保留细胞沉淀,补充适量的细胞培养基或缓冲液,轻柔且充分吹打均匀后,离心洗涤细胞:4 ℃低速离心5 min。
6.2.2.7 重复步骤6.2.2.6。
6.2.2.8 离心毕,吸弃上清液,进行活细胞计数。
6.2.2.9 将PBMC 按照一定密度种入培养板或培养瓶继续培养,也可将PBMC 冻存备用。
6.2.3 PBMC 的冻存和复苏
6.2.3.1 进行活细胞计数,根据计算得到的 PBMC 总数,计算冻存所需管数。
6.2.3.2 取出所需数量冻存管,标记好细胞编号、细胞总数和冻存日期。
6.2.3.3 配制冻存液。
6.2.3.4 在 PBMC 细胞沉淀中加入一定体积配制好的细胞冻存液,轻柔且充分吹打均匀;将吹打均匀的细胞悬液分装入冻存管中,1 ml 冻存液可用于5 × 105~ 5 × 106个细胞的冻存。
6.2.3.5 常规将细胞程序性降温。
注:某些细胞冻存液无需程序性降温。
6.2.3.6 将经过程序性降温的冻存管转入液氮容器中,并记录好细胞冻存管放置的位置。
6.2.3.7 PBMC 复苏时,提前将复苏设备预热至37 ℃,操作人员注意做好防护,迅速从液氮中取出所需管数细胞,将冻存管轻轻放入复苏设备,使细胞快速融化。
6.2.3.8 在无菌离心管中加入适量的完全培养基,将细胞冻存管中细胞悬液吸出置于离心管中,室温低速离心10 min,计数,按一定密度接种于培养板或培养瓶。
注:完全培养基指的是90% 培养基+ 10% 胎牛血清。
6.2.4 用于 RNA 抽提的 PBMC 预处理
6.2.4.1 将含有 PBMC 的细胞悬液转移至离心管,室温低速离心。
6.2.4.2 离心毕,去掉上清,加入适量 PBS 小心将细胞沉淀吹打均匀,室温低速离心。
6.2.4.3 重复 6.2.4.2 操作两次。
6.2.4.4 将细胞重悬浮于RNA 保护液中,转移至无核酸酶的离心管中。4 ℃可保存1 ~ 3 天,–20 ℃ 可保存30 天左右,如需长期保存,请置于–80 ℃冰箱或液氮罐中。
6.2.4.5 RNA 抽提时,将保存PBMC 的离心管从存储设备中取出,恢复至室温后,立即进行RNA抽提。
6.2.5 用于 DNA 或蛋白抽提的 PBMC 预处理
6.2.5.1 将含有 PBMC 的细胞悬液转移至离心管,室温低速离心。
6.2.5.2 离心毕,去掉上清,加入适量 PBS 小心将细胞沉淀吹打均匀,室温低速离心。
6.2.5.3 重复 6.2.5.2 操作一次。
6.2.5.4 加入适量 PBS 缓冲液将细胞沉淀吹打均匀,将细胞悬液转移至无核酸酶的离心管,室温低速离心。
6.2.5.5 去掉上清,将细胞沉淀 –80 ℃冻存。
6.2.5.6 DNA 抽提时,将保存PBMC 的离心管从存储设备中取出,待细胞沉淀融化后,立即进行DNA 抽提。蛋白抽提时,将保存PBMC 的离心管从存储设备中取出,置于冰上,待细胞沉淀融化后,立即进行蛋白抽提。
7 质量控制
7.1 活细胞计数
7.1.1 总则
选择合适的活细胞计数法进行计数,常用的有台盼蓝染色等方法。
7.1.2 台盼蓝染色方法
将细胞沉淀用RPMI-1640 培养基补充,充分吹打均匀后,用精确量程的移液器吸取适量细胞悬液,置于EP 管中,随之在EP 管中加入适量台盼蓝,使其终浓度为0.04%,充分混匀,台盼蓝染色3 min,取适量细胞悬液匀速加入血细胞计数板,倒置相差显微镜下计数:分别计数四大格未染成蓝色的细胞总数和染成蓝色的细胞总数,将结果记录在专用计数本上。利用如下公式计算分离所得PBMC 总数和存活率:
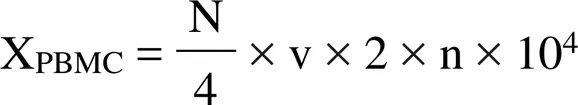
注:X:细胞总数;Y:四大格染成蓝色细胞总数;N:四大格细胞总数;n:细胞悬液稀释倍数;v:细胞悬液总体积;S:细胞存活率(%)。
7.2 RNA 的质量控制
应对RNA 的浓度、纯度与完整性进行质量检测。
7.2.1 RNA 的浓度可使用分光光度、荧光染料等方法进行检测。
7.2.2 RNA 的纯度可使用分光光度、琼脂糖凝胶电泳等方法进行检测。
7.2.3 RNA 的完整性可使用微流控分析、琼脂糖凝胶电泳等方法进行检测。
7.3 DNA 的质量控制
应对DNA 的浓度、纯度与完整性进行质量检测。
7.3.1 DNA 的浓度可使用分光光度、荧光染料等方法进行检测。
7.3.2 DNA 的纯度可使用分光光度、琼脂糖凝胶电泳等方法进行检测。
7.3.3 DNA 的完整性可使用琼脂糖凝胶电泳等方法进行检测。
[1] Higdon LE, Lee K, Tang Q, et al. Virtual global transplant laboratory standard operating procedures for blood collection, PBMC isolation, and storage. Transplant Direct, 2016, 2(9):e101.
[2] Yang J, Diaz N, Adelsberger J, et al. The effects of storage temperature on PBMC gene expression. BMC Immunol, 2016, 17:6.
[3] Grievink HW, Luisman T, Kluft C, et al. Comparison of three isolation techniques for human peripheral blood mononuclear cells: Cell recovery and viability, population composition, and cell functionality. Biopreserv Biobank, 2016, 14(5):410-415.
[4] Hummon AB, Lim SR, Difilippantonio MJ, et al. Isolation and solubilization of proteins after TRIzol extraction of RNA and DNA from patient material following prolonged storage. Biotechniques, 2007, 42(4):467-470, 472.
10.3969/j.issn.1673-713X.2021.01.016
