底部预置二维码冻存管在生物样本存储中的应用方法
2021-02-22张姗姗彭宏威邹聪刘南
张姗姗,彭宏威,邹聪,刘南
·技术与方法·
底部预置二维码冻存管在生物样本存储中的应用方法
张姗姗,彭宏威,邹聪,刘南
430071 武汉,湖北省人类遗传资源保藏中心/武汉大学中南医院生物样本库/武汉大学人类遗传资源保藏中心
随着转化医学和健康医疗大数据快速成为医学研究的热点[1-3],越来越多的研究者认识到人类遗传资源与信息是医学研究的宝贵资源,是精准医学的基石[4]。医学研究对生物样本的收集、保存和应用需求日益增加,高质量大规模生物样本库的建立对探索人类疾病新治疗途径和提高科研效率极具帮助[5-6]。生物样本库一般使用冻存管储存生物样本,每个冻存管必须有明确的信息化标识。由于样本待标注信息很多,传统的手写标记已经无法满足样本库大批量样本的需求,使用条形码标识成为必须。常用的条形码有一维码、二维码和无线射频识别。其中,二维码有明显优势,且底部预置的方式是大势所趋。目前关于底部预置二维码冻存管在样本存储过程中的应用方法在各项操作指南和最佳实践中均没有详细的说明,相关的文献报道也很少[7-9]。本文就此应用进行介绍,以期为综合型样本库的初期运行提供参考。
1 冻存管的信息化标识
一维码信息录入速度快,具有校验功能以防止错读,但其数据容量仅能达到 30 个字符左右,只能用数字、字母和符号在水平方向上表达信息,空间利用率较低且一旦发生污损将被拒读。二维码始于 20 世纪 80 年代末,比一维码更高级,数据容量升级至 250 倍储存量,能额外使用声音、文字、图形和指纹等在横向和纵向同时表达信息,空间利用率高,成本低,易制作,持久耐用[10]。此外,它有强大的纠错和加密功能,因穿孔、污损等引起局部损毁时,损毁面积达30% 仍可读取完整信息,只是需要使用专用的图像式阅读器[11]。
鉴于二维码的优势,早期大多数样本库通过对不同类型的样本设置相应的编码规则进行样本管理。如,郭爱华等[12]根据血液样本编码规则生成以下编码SCMC2012KSCIN80245654LX2D3G1,表示上海儿童医学中心 2012 年心内科采集门诊号为 80245654 患儿父亲血浆第 3 管样本。然后使用条码打印机将编码信息生成的标签贴到冻存管上。这种方法属于后印方式,可适用于多种材质储存容器(如聚丙烯管、聚碳酸酯管、玻璃管等),而且成本低廉,但存在以下缺点:编码规则不一致且复杂冗长,需自行编码、打印并粘贴,容易出现错误;存储过程中存在标签掉落的风险,造成样本信息缺失甚至混乱;对于需要低温冷冻的样本,标签还必须有良好的防冻性(如防液氮标签),这提高了使用成本。为了优化这些问题,底部预置二维码冻存管(简称二维码预置管)应运而生。
底部预置二维码是通过激光蚀刻在冻存管的底部,有以下优势:统一编码,每支冻存管都有唯一编号;机械化嵌入底部,脱落可能性低;批量制作,成本低;可灵活适应多种工作环境,量少时单支扫描人工操作,量多时整板扫码匹配自动化设备进行批量分装样本,可以大幅度提高识别效率,缩短样本出入库时长[13]。然而二维码预置管存在以下问题:预印码没有任何样本相关信息,使用前需根据样本处理的要求设置相应规则以保证信息一一对应,核对无误后才能入库;样本出库时无法直观地进行样本识别和查找,需结合数据库匹配;在深低温环境或环境温度变化时,可能会引起底部条码严重结霜,干扰识别准确度和效率[8]。针对这些问题,本文总结了二维码预置管在血液、尿液及组织样本的存储过程中的应用方法。
2 应用举例
2.1 血尿样本的存储
2.1.1 血尿样本的采集及临床信息对应 样本采集前需要制定研究方案确定保留成分、体积及数量,从而选择采集容器的类型和规格[14]。常规采集的每例血液样本为一支 2 ml 的 EDTA 抗凝全血,每例尿液样本为一支 10 ml 的晨间中段尿。血液及尿液样本采集后,在 4 h 内完成交接、转运和处理,样本分装至二维码预置管后尽快入库(图 1)。
处理血尿样本前,首先对样本进行编号以便与临床信息对应[15]。样本采集对象一般为获知并签署样本捐赠知情同意书的住院患者,其入院信息可以从医院信息系统(hospital information system,HIS)导出。每天将有样本的病区的入院信息导出,按入院时间降序排序后提取前一天信息合并至入院信息总表,查找住院号或姓名分别对血尿样本自然编号,将已编号的样本信息提取至当日信息表。在入院信息总表中,血尿样本均采集后可删除整行,其余编号全部改为√。未取样的入院信息保留 2 个月,若有重复入院,保留最新一次。
2.1.2 血液样本处理及其冻存管的编号、扫码、使用和信息对应 血样离心条件:4 ℃,2500 ×,10 min。2 ml 血样分层后分装 3 管 250 μl 上层血浆和 3 管 120 μl 中间白膜层(先留取 500 μl 至中间管,充分混匀再分装)。冻存管选用 0.5 ml 二维码预置管,每盒 96 管。若血样体积不足 2 ml,每种成分尽量保证第 1 管体积。不足 6 管的,仍按 6 管分装,空管体积为 0 μl。批量成分分装由自动化液体工作站完成,其余血样按同样规则手动处理。

图 1 底部预置二维码冻存管在样本全流程中的应用和信息对应
AB
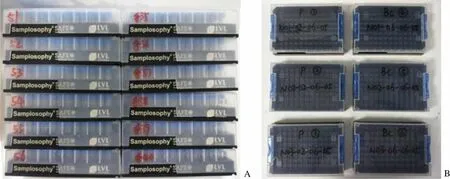
分装血样的空冻存管根据需求整盒编号、扫码并放入–20 ℃冰箱预冷待用。自动化液体工作站使用的冻存管无需提前扫码,为方便使用,在盒盖正前方左侧用冻存盒侧面一维码后两位进行自然编号,如 LVL100043351,记为 51(整箱连号使用,图 2A)。手动处理的冻存管则需要用整板扫码仪提前扫码。盒盖自然编号左边加上“手”字,标记此盒为手动处理用(图 2A)。将扫码表命名为 S-盒子一维码后五位,如 S-43351。
每例样本的 3 管血浆和 3 管白膜层分别放入 P①~ ③和 Bc④~ ⑥(图 2B),–80 ℃冰箱暂存,满盒后入库至 3 个气相液氮罐。每个液氮罐有 6 个分区,分别可放8 ~ 14 个冻存架,每个冻存架有 15 层,每层可放一个 2 英寸的 10 × 10 冻存盒,从下往上依次使用。冻存盒位置编号的规则如下:N02-02-06-05,表示 2 号液氮罐 2 区第 6 架从下往上第 5 层。每个冻存架满 5 盒后启用下一架。如 N02-02-06-05 入库后启用 N02-02-07-01。
当日处理完血样,在血样存储位置表录入每一管样本的临床信息、处理过程及冻存管号。分装后暂存于–80 ℃的血样,每满 6 盒扫码入库。扫码前充分除霜以保证 96 孔都完成识别。为避免样本冻融,此过程越快越好。目前效果较好的除霜方法如下:先用布擦除大部分表面的霜,再喷洒少量纯酒精到冻存管底部可使二维码完全显示(经过试验,冻存管浸泡在纯酒精 3 天后,底部二维码仍可完全识别,没有任何损害),若仍有少量冰渣,再用布擦拭除冰后即可扫码。扫码表命名为位置编号+ 盒子一维码后5 位,如 1435(N01-04-03-05)-43272。将扫码表和血样存储位置表中的冻存管号核对,确保分装正确。核对无误后,将样本按位置编号放入液氮罐并录入每管样本的位置信息和入库信息。
2.1.3 尿液样本处理及其冻存管的编号、扫码、使用和信息对应 尿样离心条件:常温,4000 r/min,10 min。10 ml 尿样分层后手动分装 4 管 1.5 ml 尿上清和 3 管 1 ml 尿沉渣(弃多余上清,留 3 ml 含沉渣的液体,充分混匀再分装)。冻存管选用 1.5 ml 二维码预置管(IBIO-GENE IBG-V9151,管侧有数字编码)。若尿样 < 9 ml,调整各成分数量体积并记录。若尿样< 3 ml,为不合格样本,需重新采集样本。
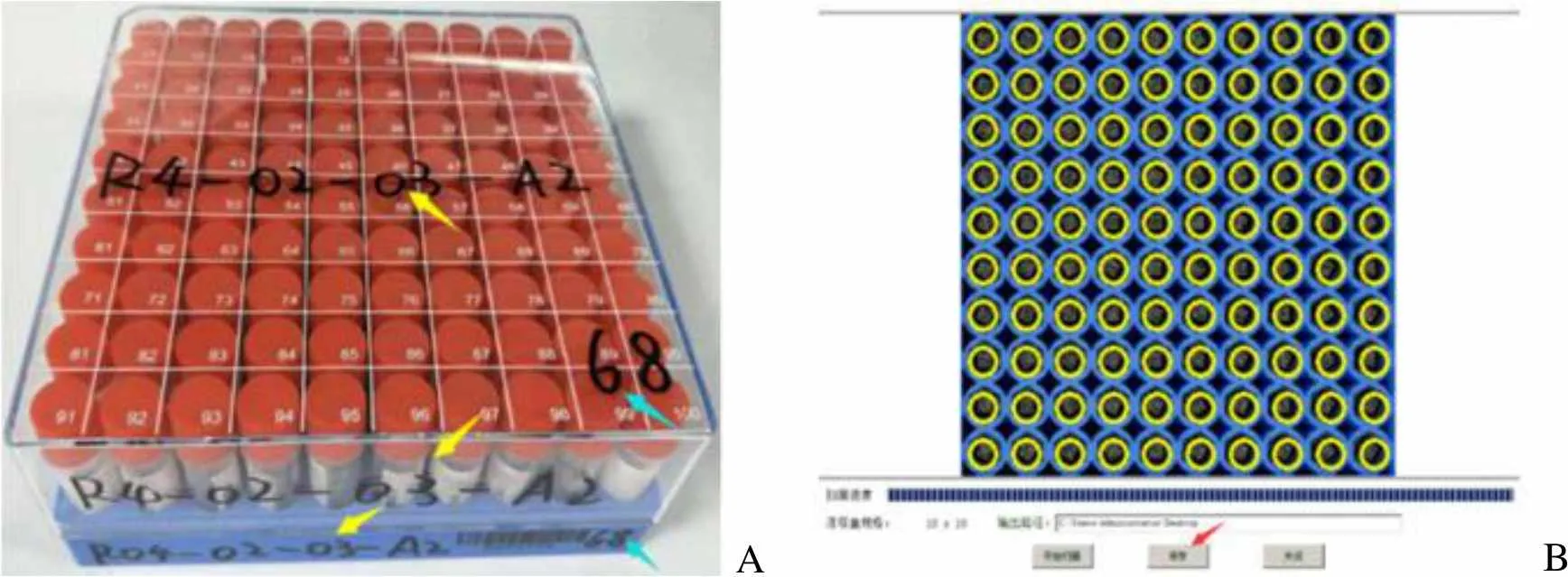
每例尿样分装后,按顺序放入已编号的 10 × 10 冻存盒,未装满时放入–80 ℃冰箱暂存,满盒后根据位置编号入库至–80 ℃超低温水冷冰箱。每台冰箱有三层,每层可放 4 个冻存架,每个冻存架有 6 行,每行可放 5 个 2 英寸的 10 × 10 冻存盒,每层共 120 盒。将 6 行从上到下依次编号为 A、B、C、D、E、F,每行从里到外编号为 1、2、3、4、5 列。如,R04-02-03-A2 表示 4 号冰箱第 2 层第3 架第 1 行第 2 列。为方便使用,在盒子一维码右边和盒盖右下角按顺序写自然序号 1-120,依次对应每层的位置编号(写在盒子一维码左边和盒盖上,图 3A)。
分装尿液的冻存管,每盒装满 100 支,整盒编号后扫码。打开扫码软件 ScanDM 10 × 10,盒子一维码侧朝外,右上角对齐设备 Epson Perfection V600 Photo 扫描区右上角。扫码后,显示图会闪烁一次并将成功扫描的冻存管圈出来(图3B),确保全部扫描成功。扫码表命名为 1-120,保存至每层相应文件夹并将一维码录入统计表。当日处理完尿样,在尿样存储位置表中录入每一管样本的临床信息、处理过程、冻存管号及存储位置。
2.2 组织样本的存储
2.2.1 组织样本的采集及临床信息对应 取样员从 HIS 导出当日需取样本的手术信息,在手术室随时注意手术进展动态,记录样本热缺血及冷缺血时间等。样本交接后尽快4 ℃转运至病理科取材室。
2.2.2 组织样本的处理及其冻存管的编号、扫码、使用和信息对应 取样员对标本拍照后由病理医生按照正常组织(如有)、癌旁组织、癌组织依次取材。取样员使用无菌器械切分标本约 0.5 cm × 0.5 cm × 0.5 cm大小。切分后的新鲜组织一半放入 0.5 ml 二维码预置管(IBIO-GENE IBG-V1052,管侧有数字编码),迅速转入暂存液氮罐;另一半放入加了 1 ml 的 RNAlater 溶液的 1.5 ml 二维码预置管(IBIO-GENE IBG-V1150,管侧有数字编码),4 ℃过夜充分浸润组织,尽可能地弃上清后入库至液氮罐[16]。组织取材使用的二维码预置管已提前整盒扫码并在管盖和管侧对应写上自然编号,取样时按顺序取用,对应登记样本信息。若因样本过小等问题导致无法取到相应样本,则冻存管不会被使用,可用于留取下一例样本。处理完组织样本,在组织存储位置表中录入每一管样本的基本信息、处理过程及冻存管号。
组织样本的收集时间较分散,虽然使用的冻存管不仅底部有二维码,管侧有一维码及数字编码,但是一般至少有8 位数字且编码不连续,在组织样本分装时不易肉眼识别。为优化此问题,每盒装满 100 支后,在每支管的管盖上方和管侧空白处用防液氮记号笔写自然编号 1 ~ 100(10 ×10 盒缺角处从左往右,从上往下)。其中,为了避免管盖上 6 和 9 等序号颠倒后混淆,将包含 6 的 1 行和 1 列数字、18 和 81 下方均加下划线(图 4)。使用时注意管盖和管子一一对应,避免样本信息错乱。编号后整盒扫码,扫码表命名为备用盒自然序号+ 冻存管规格+ 盒子一维码+ 科室+ 领用日期+ 用完日期,如,备 1 红 1.5-B065659骨科领用 190415-190523。使用完的空盒回收再用,已用完的扫码表移入已用完冻存盒文件夹中。
AB

图 4 底部预置二维码冻存管分装组织样本的自然编号规则
暂存罐中新鲜冻存的组织每周入库一次,分配至 3 个气相液氮罐。同一样本的复份数除以 3,整数为每个罐子至少分配的量,余数根据实际空间均匀分配。(如,1 号样本有 7 支,51 ~ 57 号,则 51 ~ 53 入 N07,54 ~ 55 入 N08,56 ~ 57 入N09)。位置分配可提前算好列出来,尽可能缩短分装时间。组织数量较多时,可先分装到 3 个中转低温冻存盒,再转移入液氮罐的相应冻存盒,拍照后录入样本位置。当组织样本满盒时,不采取整盒扫码核对,而是将管盖上的自然编号拍照后核对位置信息,以缩短样本在室温中暴露的时间,尽量避免样本冻融。
2.3 二维码预置管样本的出库流程
二维码预置管样本的出库需要结合完善的入库信息表。首先根据出库申请查询样本存储情况,将符合条件的样本标记为预出库。申请得到批准后,筛选必要信息生成预出库单,其中位置信息包括:冻存盒及冻存管位置、冻存管二维码、管号(自然编号,适用于组织样本)。将位置信息排序,方便快速取出冻存管。根据打印好的预出库单依次快速取出样本,按顺序放入预冷冻的空冻存盒。为了尽可能减少样本冻融的风险,整个过程在冰板上完成,控制在 15 min 左右,否则分批出库。将取出的样本快速底部除霜扫码后暂存至–80 ℃冰箱。将实际出库扫码与预出库单上的二维码信息通过 if 函数快速核对。若有不一致,分析并找出原因,如原始信息表录入有误、出库时拿错位置等。若核对有误,决定不出库时,将样本归回原位并标记清楚。样本出库的准确度依赖于入库信息的准确度,因此入库信息需定期核对,尽可能地避免信息录入错误导致样本无法识别。
3 小结
生物样本库中使用的冻存管容积较小,大多为 0.3 ~2 ml,标签可用空间有限。在冻存管底部设置二维码充分体现了二维码可以根据空间调节大小的优势。此外,底部预置结合整板扫码可以提高识别效率,促进样本的快速出入库,也能匹配自动化设备。因此,底部预置二维码冻存管是目前在样本库中应用最广泛的存储容器。然而预置二维码与样本信息没有关联且不能肉眼识别,如何提高使用效率及准确率是实际应用过程中需要不断克服的难题。
二维码预置管的使用核心在于样本信息的整合。本研究中涉及的样本主要来源于医院的临床样本,包括血液、尿液及组织。首先通过医院信息系统和实验室信息系统有效抓取正确的样本来源信息及相关检测结果,有助于后期的跟进随访。其次,样本自收集到出库使用的整个生命周期的全流程管理非常重要。样本的存储最终以投入使用为目的,因此针对不同项目的样本需要设计合理高效的预处理、分装、入库及出库流程,每个过程都涉及到冻存管的信息识别。最后,有必要定期核检已入库的样本的冻存管信息与存储位置是否对应。本研究总结发现,预置二维码的前提下,若规格允许(≥ 0.5 ml),批量生产时可以在管侧增加数字编码,增强实际操作中的肉眼识别度。尤其是信息核对有误时,自然编号的使用在组织样本存储过程中进一步增强了冻存管肉眼识别度,从而提高了使用正确率,也为样本的出库提供了便捷,缩短出库时间,减少样本冻融风险。另外,开发成熟的样本库管理系统来匹配自动化处理及存储设备,可进一步体现二维码预置管整板扫码的优势,同时也能很好地解决信息对应的问题。
[1] Fudge N, Sadler E, Fisher HR, et al. Optimising translational research opportunities: a systematic review and narrative synthesis of basic and clinician scientists' perspectives of factors which enable or hinder translational research. PLoS One, 2016, 11(8):e0160475.
[2] Ashley EA. The precision medicine initiative: a new national effort. JAMA, 2015, 313(21):2119-2120.
[3] Ji XL, Li Q, Lv ZB, et al. Biobank development in the context of precision medicine: roadblocks and countermeasures. Chin J Hosp Admin, 2016, 32(9):692-694. (in Chinese)
姬小利, 李倩, 吕志宝, 等. 精准医学背景下生物样本库发展中存在的问题及对策. 中华医院管理杂志, 2016, 32(9):692-694.
[4] Zhang YJ, Ye L, Gao FF, et al. Construction of biological sample library is the cornerstone for clinical medical research. Translational Med J, 2014, 3(6):347-351, 355. (in Chinese)
张育军, 叶磊, 高芳芳, 等. 生物样本库建设是临床医学研究的基石. 转化医学杂志, 2014, 3(6):347-351, 355.
[5] Shi XH, Guo J. The international development status of biobank. Chin J Clin Lab Manag (Electronic Ed), 2017, 5(1):19-23. (in Chinese)
史晓红, 郭健. 国际生物样本库的发展现状. 中华临床实验室管理电子杂志, 2017, 5(1):19-23.
[6] Gao HJ, Du LL, Zhang XY, et al. Status, opportunities and challenges of biobanks. Med J Peking Union Med Coll Hosp, 2018, 9(2):172-176. (in Chinese)
郜恒骏, 杜莉利, 张小燕, 等. 生物样本库发展的现状、机遇与挑战. 协和医学杂志, 2018, 9(2):172-176.
[7] China Medicinal Biotech Association. China Medicinal Biotech Association biobank standards (Trial). Chin Med Biotechnol, 2011, 6(1):71-79. (in Chinese)
中国医药生物技术协会. 中国医药生物技术协会生物样本库标准(试行). 中国医药生物技术, 2011, 6(1):71-79.
[8] Ji JF. Capacity building and best practice of biobank. Beijing: Science Publishing House, 2013:165-170. (in Chinese)
季加孚. 生物样本库的能力建设与最佳实践. 北京: 科学出版社, 2013:165-170.
[9] Simeon-Dubach D, Campbell L, Kozlakidis Z, et al. Isber best practices to guide repository activities. Cryobiology, 2019, 91:185-186.
[10] Wang Z, Zhao YR, Cao YZ. Full process management of large biobank based on Internet of Things. Translational Med J, 2018, 7(6): 350-353. (in Chinese)
王钊, 赵跃然, 曹永芝. 基于物联网的大型生物样本库全流程管理. 转化医学杂志, 2018, 7(6):350-353.
[11] Zhang LF, Feng F, Huang H. Analysis and study of the principle of the generation of QR code technology. Electronic Des Eng, 2017, 25(17): 1-5. (in Chinese)
张灵凤, 冯锋, 黄恒. 二维码技术的生成原理的分析与研究. 电子设计工程, 2017, 25(17):1-5.
[12] Guo AH, Zhang C, Yu YG, et al. Common problems and case study of patent application in medicinal biotechnology fields. Chin Med Biotechnol, 2012, 7(4):306-308. (in Chinese)
郭爱华, 张翠, 余永国, 等. 二维码技术在生物样本库编码中的应用与评价. 中国医药生物技术, 2012, 7(4):306-308.
[13] Dai HQ, Yu L, Li Y, et al. Application and expectation of automatic storage system in biobank. Chin J Clin Lab Manag (Electronic Ed), 2017, 5(1):46-50. (in Chinese)
戴涵清, 俞磊, 李艺, 等. 自动化存储管理系统在生物样本库领域的应用及展望. 中华临床实验室管理电子杂志, 2017, 5(1):46-50.
[14] Wu ML, Wang ZQ, Luo K, et al. The controllability collection and quality management of clinical biobank for blood biospecimen. Translational Med J, 2016, 5(6):327-332. (in Chinese)
吴曼丽, 王柱清, 罗凯, 等. 临床生物样本库血液样本的可控性采集和质量管理. 转化医学杂志, 2016, 5(6):327-332.
[15] Cheng M, Jiang F. Management of biosamples transferred from hospitals to laboratories: main problems and solutions. Chin J Tissue Eng Res, 2018, 22(16):2619-2624. (in Chinese)
程酩, 姜峰. 临床与基础研究中实验室生物样本对接管理的主要问题及对策. 中国组织工程研究, 2018, 22(16):2619-2624.
[16] Xing J, Yu KK, Zhang Y, et al. The standardized construction of thoracic tumor biobank in the era of precision medicine. Translational Med J, 2018, 7(4):204-206, 211. (in Chinese)
邢杰, 余科科, 张叶, 等. 精准医学时代下胸部肿瘤生物样本库规范化建设. 转化医学杂志, 2018, 7(4):204-206, 211.
湖北省卫生健康委员会联合基金(WJ2019H080)
刘南,Email:liunan427@126.com
2020-08-06
10.3969/j.issn.1673-713X.2021.01.013
