少见表现移植相关血栓性微血管病的诊治探讨
2021-02-22楼晓王安胡亮钉
楼晓,王安,胡亮钉
·临床研究·
少见表现移植相关血栓性微血管病的诊治探讨
楼晓,王安,胡亮钉
100071 北京,解放军总医院第五医学中心血液病医学部
移植相关血栓性微血管病(TA-TMA)是一组严重的急性临床病理综合征[1],其主要病理特征是内皮细胞肿胀脱落、内皮下绒毛状物质沉积、血管腔内血小板聚集形成微血栓、血管腔内栓塞及红细胞碎裂等微血管系统异常,其基本表现为血小板减少、溶血性贫血和微循环中血小板血栓造成的器官受累(肾、肺、肠、心、脑)。最近,Dvorak 等[2]初步提出了 TA-TMA 的“三打击假说”,如图1 所示:①具有补体激活潜在倾向或先前存在内皮损伤;②接受导致内皮损伤的预处理方案;③然后由药物、同种反应性、感染和(或)抗体引发额外的损伤。此外,还列出了治疗 TA-TMA 过程中需要加以关注的六个问题(图2)。
TA-TMA是一种严重的高致死性移植相关并发症,往往缺乏特异性表现。在造血干细胞移植的临床实践中,以左心衰为显著表现的移植相关血栓性微血管病非常少见,迄今国内外尚未见文献报道。现将其临床表现、实验室检查结果和诊治思路经过整理报告,并结合相关文献进行讨论分析。

图 1 移植相关血栓性微血管病发生发展的“三打击假说”
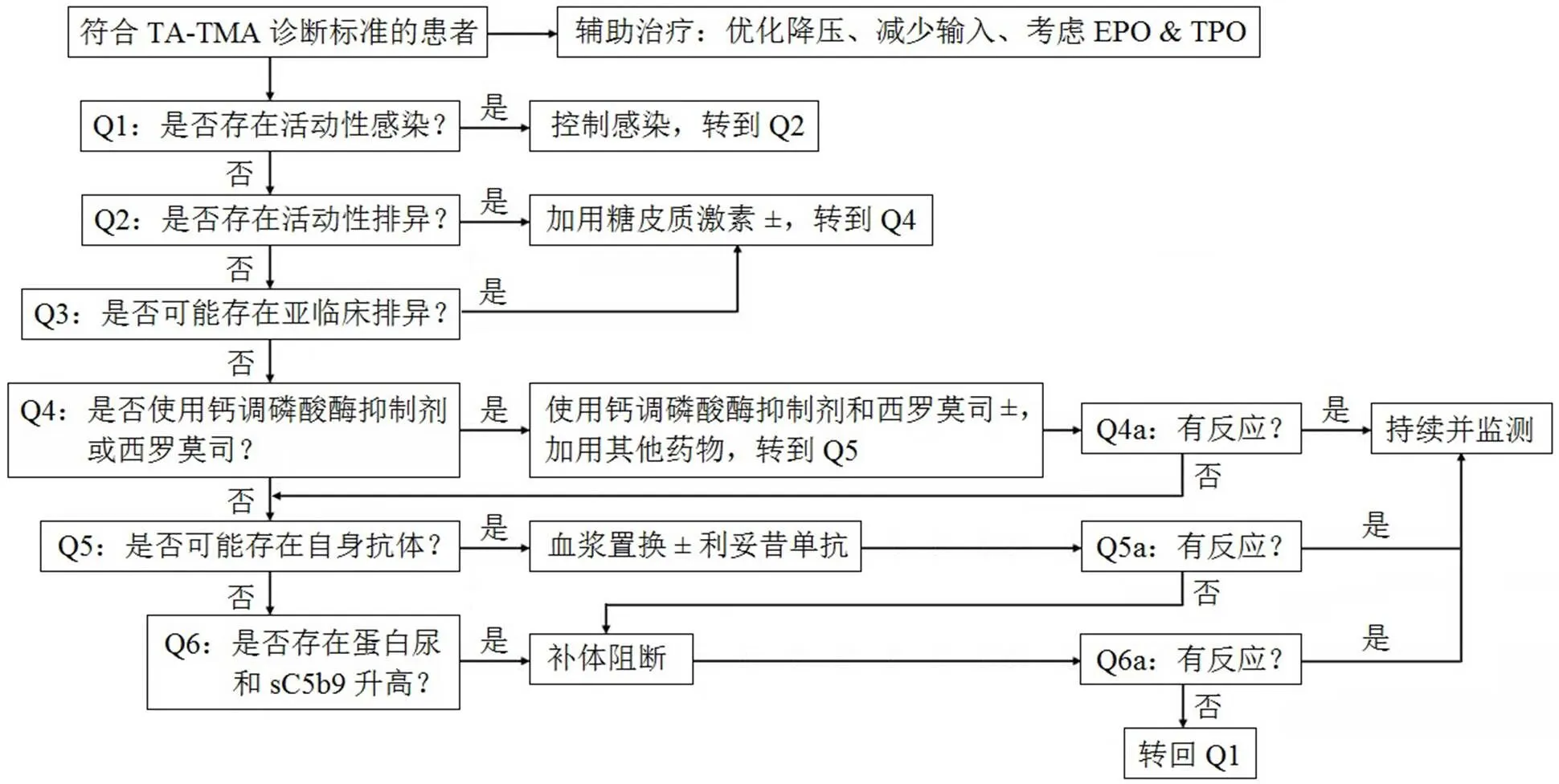
图 2 移植相关血栓性微血管病治疗过程中的六个问题
1 临床特点
患者,女,24 岁,经骨髓形态学、免疫分型、细胞遗传学、基因筛查和骨髓活组织病理等检查后确诊“重型再生障碍性贫血”,予环孢素和十一酸睾酮口服治疗。确诊后8 个月,患者签署相关知情同意书。在我科接受了 HLA 配型 9/10 相合非亲缘供者外周血干细胞移植,预处理方案为氟达拉滨(120 mg/m2)联合环磷酰胺(150 mg/kg),移植物抗宿主病预防采用兔抗人胸腺细胞免疫球蛋白 10 mg/kg 联合环孢素、甲氨蝶呤及吗替麦考酚酯。移植后 +2 天出现急性左心衰(中心静脉压17.5 cmH2O),给予强心利尿治疗后迅速好转,严格限制入量的同时口服地高辛片。+7 天出现超急性II 度肠道移植物抗宿主病(GvHD),床旁肠镜检查见“降结肠、乙状结肠、直肠广泛点状黑斑及散在片状红斑”,换他克莫司和甲强龙治疗后腹泻控制。+21 天出现端坐呼吸、心慌喘憋明显,咳粉红色泡沫痰,无畏寒发热,两肺可闻及粗湿啰音,双下肢轻度水肿,利尿效果不佳。床旁胸片大致见“两肺纹理增多,可见斑片状模糊影,两肺下野为著,双肺门模糊,上纵膈不宽,心影正常,双肋膈角消失”,心肌酶学:B 型钠酸肽 > 35000 μg/L、全血心肌肌钙蛋白 I 548 ng/L、全血肌红蛋白 128.90 mg/L、乳酸脱氢酶 1088 U/L、肌酸激酶同工酶 28 U/L。动脉血气分析示:pH 7.397,PCO234.6 mmHg,PO250.7 mmHg,BE-3.0。心电图示:窦性心律(100 次/分)、ST-T 显著压低。血细胞分析:白细胞计数 8.20 × 109/L、血小板计数 4 × 109/L、血红蛋白 99 g/L;血生化:总蛋白 56 g/L、总胆红素 86.30 μmol/L、直接胆红素 22.20 μmol/L、肌酐 133 μmol/L、钾 5.54 mmol/L、血清尿素氮 29.81 mmol/L、氯 91 mmol/L、钠 132 mmol/L、钙 2.09 mmol/L、镁 1.43 mmol/L;出凝血功能检查:FIB1.44 g/L、余正常(D-Dimer 59 ng/ml)。他克莫司血药浓度 19.10 ng/ml、霉酚酸酯血药浓度 4.91 μg/ml。外周血涂片示破碎红细胞比例 0.45%,床旁 B 超示肝脾双肾未见明显异常、腹腔内未见积液。尿蛋白定量 700 mg/24 h(> 30 g/L),Coombs 试验阴性,ADAMTS-13 活性 47%。
2 诊治策略分析
患者移植后早期出现乳酸脱氢酶、胆红素、肌酐异常升高、伴血小板下降,破碎红细胞比例 0.45%,尿蛋白 > 30 g/L,合并存在急性左心衰、急性肾损伤和 I 型呼吸衰竭,临床诊断为移植相关血栓性微血管病(无组织病理学依据),遂停用他克莫司,并将吗替麦考酚酯调减剂量,先后在 +22、+23、+24、+25、+29、+33、+34、+35 天予连续肾脏替代疗法及血浆交换 8 次(2000 ml/次),以及在 +24、+32 天分别给予两剂 500 mg/次利妥昔单抗。患者诊断 TA-TMA 以后,症状曾一度减轻,+25 天病情再次加重,血压居高不下,陷入嗜睡状态、瞳孔对光反射迟钝,呼吸频率变慢;+29 天出现意识恍惚、计算能力下降、无法正确对话作答,查颅脑 MRI 未见明确异常信号。期间并发多次菌血症(产酸克雷伯菌、缓症链球菌、屎肠球菌),病毒性膀胱炎,肺曲霉病以及巨细胞病毒性肺炎,无缝持续综合施救。TA-TMA 相关指标水平变化情况(血小板、肌酐和胆红素)如图 3 所示,持续治疗至移植后 +74 天出院,当日白细胞计数 2.37 × 109/L、血小板计数 24 × 109/L、血红蛋白72 g/L。出院2 周后血象恢复至白细胞计数 7.28 × 109/L、血小板计数 127 × 109/L、血红蛋白 100 g/L。环孢素维持至移植后 18 个月停服,TA-TMA 无复发,至今无明显慢性移植物抗宿主病,生活质量高。
3 讨论
TA-TMA 血管内皮损伤的主要病理生理学过程包括:①激活内皮细胞产生促凝状态。当被预处理和其他药物损伤时,活化的内皮细胞会经历多重变化;②抗原呈递细胞(巨噬细胞和中性粒细胞)和淋巴细胞的活化。活化的内皮细胞进而导致许多免疫效应细胞的活化;③补体级联激活和微血栓形成。免疫反应激活替代与经典补体级联反应,促进微血栓的形成。

临床指标 移植后天数
在造血干细胞移植预处理中发生急性左心衰多与短期内注入液量过大且利尿不及时有关。第一次左心衰的发生可能与出入量不平衡有关,而第二次的左心衰事件归结为 TA-TMA 病理生理学机制所致的少见表现。患者长期严重贫血,导致心肌慢性缺氧而退行变性,使心脏贮备功能减退,移植前服用环孢素致内皮功能部分受损,预处理时环磷酰胺的心脏毒性,这些因素也参与了本例 TA-TMA 相关急性左心衰的诱发过程。
由于临床表现多样性、病情严重程度不等、临床医生认识水平不一、实验室检测技术高低以及基于回顾性研究归纳的诊断门槛缺乏统一性,文献报道 TA-TMA 发生率从0.5% ~ 63.6% 或0.5% ~ 76% 不等[3-4],差别很大。经过治疗后的死亡率为 60% ~ 90%[3]。关于 TA-TMA 的第一个前瞻性研究[4]来自于美国辛辛那提儿童医院,TA-TMA 发生率为 39%,其中 92.3% 病例发生在移植后 100 天之内,中位发病时间是 32 天。
本例患者除了破碎红细胞比例未达到 2% ~ 4%,TA-TMA 的其余诊断标准[4]全符合,包括:血小板减少、血红蛋白降低、血清结合珠蛋白降低、血清肌酐升高、蛋白尿、乳酸脱氢酶升高、无凝血障碍、抗人球蛋白试验阴性、vWF 裂解蛋白酶 ADAMTS-13 活性 > 5%。TA-TMA 还需与免疫性溶血性贫血、弥散性血管内凝血、血栓性血小板减少性紫癜和溶血性尿毒症综合征进行鉴别诊断。伴有急性 GvHD 的 TA-TMA 发生率是不伴有急性 GvHD的四倍。本例即为先有肠道急性 GvHD 而后出现 TA-TMA。
钙调磷酸酶抑制剂(如环孢素和他克莫司)可导致内皮功能障碍、增加血小板聚集、抑制前列腺素的分泌来损伤肾脏。治疗 TA-TMA 的第一步就是撤除钙调磷酸酶抑制剂并对症支持,其中 50% ~ 63% 的病人可以逐渐恢复。血浆交换在治疗初期应用较为普遍,并非是因为其有效率高,而是由于 TA-TMA 早期难以与血栓性血小板减少性紫癜、非典型溶血性尿毒症综合征进行确切鉴别。Obut 等[3]的研究结果显示,两组病例血浆交换的反应率为24% ~ 35%,但仅有 6% 的存活率。血浆交换对存在分泌性抗体的部分病人有一定的疗效。Jodele 等[6]报告了利妥昔单抗联合或不联合血浆交换治疗 TA-TMA 的反应率为 67%(4/6)。利妥昔单抗的作用机制可能与减少抗体分泌、或补体活化有关。目前还没有关于利妥昔单抗使用多长时间的共识或指南,较为常见的用法是 375 mg/m2、一周一次使用 4 剂。
补体系统功能失调参与了 TA-TMA 的发病过程,其中血浆 C3b 和 sC5b-9 异常升高[7-8]。依库珠单抗(eculizumab)是抑制末端补体成分活化的重组人源性单克隆抗体,能特异性与人末端补体蛋白 C5 结合,通过抑制补体 C5 向 C5a 和 C5b 的裂解,阻断炎症因子C5a的释放及膜攻击复合物 C5b-9 的组成,从而达到控制溶血、减少炎症反应、减少血栓形成的目的。目前依库珠单抗的价格高昂,对于国内大部分移植病人而言,依库珠单抗的可及性极低。德国 Bohl等[9]的结果表明依库珠单抗治疗重症 TA-TMA 的反应率为 85%(11/13),但仍有 70%(9/13)的死亡率(4 例在诱导期死亡、5 例在维持期死亡),中位生存时间为3.7 个月;主要死亡原因为感染(7 例)、TA-TMA 进展(2 例)。作者认为早期诊断 TA-TMA 和治疗过程中对感染的控制非常重要。我们报告的本例患者也可以见到并发了数轮严重感染,包括产酸克雷伯菌菌血症、缓症链球菌菌血症、屎肠球菌菌血症、病毒性膀胱炎、肺曲霉病和巨细胞病毒性肺炎,回顾整个救治过程真是坎坷波折、步步惊心。
激素耐药胃肠道 GvHD 是补体介导 TA-TMA 的危险因素,其驱动因素是替代和终末补体通路的异常活化[10]。伴随 TA-TMA 的 GvHD 意味着生存率极低、住院时间更长和医疗成本更高。目前尚不清楚针对 TA-TMA 的治疗能否改善 GvHD 的生存。
因此,在移植后早期阶段如发生难以解释的急性心衰时,需警惕 TA-TMA,及时完善包括血清 sC5b-9 含量等综合性诊断措施。
[1] George JN, Nester CM. Syndromes of thrombotic microangiopathy. N Engl J Med, 2014, 371(7):654-666.
[2] Dvorak CC, Higham C, Shimano KA. Transplant-associated thrombotic microangiopathy in pediatric hematopoietic cell transplant recipients: a practical approach to diagnosis and management. Front Pediatr, 2019, 7:133.
[3] Obut F, Kasinath V, Abdi R. Post-bone marrow transplant thrombotic microangiopathy. Bone Marrow Transplant, 2016, 51(7):891-897.
[4] Choi CM, Schmaier AH, Snell MR, et al. Thrombotic microangiopathy in haematopoietic stem cell transplantation: diagnosis and treatment. Drugs, 2009, 69(2):183-198.
[5] Jodele S, Davies SM, Lane A, et al. Diagnostic and risk criteria for HSCT-associated thrombotic microangiopathy: a study in children and young adults. Blood, 2014, 124(4):645-653.
[6] Jodele S, Licht C, Goebel J, et al. Abnormalities in the alternative pathway of complement in children with hematopoietic stem cell transplant-associated thrombotic microangiopathy. Blood, 2013, 122(12):2003-2007.
[7] Qi J, Wang J, Chen J, et al. Plasma levels of complement activation fragments C3b and sC5b-9 significantly increased in patients with thrombotic microangiopathy after allogeneic stem cell transplantation. Ann Hematol, 2017, 96(11):1849-1855.
[8] Jodele S. Complement in pathophysiology and treatment of transplant-associated thrombotic microangiopathies. Semin Hematol, 2018, 55(3):159-166.
[9] Bohl SR, Kuchenbauer F, von Harsdorf S, et al. Thrombotic microangiopathy after allogeneic stem cell transplantation: a comparison of eculizumab therapy and conventional therapy. Biol Blood Marrow Transplant, 2017, 23(12):2172-2177.
[10] Wall SA, Zhao Q, Yearsley M, et al. Complement-mediated thrombotic microangiopathy as a link between endothelial damage and steroid-refractory GVHD. Blood Adv, 2018, 2(20):2619-2628.
楼晓,Email:louxiao@163.com;胡亮钉,Email:huliangding@ sohu.com
2020-09-07
10.3969/j.issn.1673-713X.2021.01.015
