MTNR1B rs10830963基因多态性与中国人群2型糖尿病相关性的Meta分析
2021-02-22冯珊珊魏书瑶何斯马菲菲哈小琴
冯珊珊,魏书瑶,何斯,马菲菲,哈小琴
·调查与研究·
MTNR1B rs10830963基因多态性与中国人群2型糖尿病相关性的Meta分析
冯珊珊,魏书瑶,何斯,马菲菲,哈小琴
730000 兰州,甘肃中医药大学临床医学院(冯珊珊、魏书瑶、哈小琴);730000 兰州大学第二临床医学院(何斯);730070 兰州,甘肃农业大学动物医学院(马菲菲);730050 兰州,中国人民解放军联勤保障部队第九四〇医院检验科(冯珊珊、哈小琴)
2 型糖尿病(T2DM)是由胰岛素抵抗和胰岛 β 细胞缺陷共同形成的以高血糖为主要特征的代谢异常综合征,目前也是继心血管疾病和肿瘤之后,第三位严重威胁人类生命健康的慢性疾病,其发病率和病死率全国范围内呈递增趋势。据世界卫生组织(WHO)最新报道,世界上总人口数约 9%(6.1 亿人)的人群患有糖尿病,预计到 2045 年患病人数将高达 7 亿人[1]。但迄今为止,关于 T2DM 确切的致病机制尚未阐明,有研究表明阳性家族史、肥胖史是诱发 T2DM 强独立危险因素[2];Gaulton[3]通过人体全基因组测序研究发现,有超过 100 个基因位点与 T2DM 风险增加密切相关。因此,除了环境因素(年龄、吸烟、肥胖、生活习惯等)外,基因遗传易感性因素与 T2DM 的发生发展也至关重要。
褪黑素受体 1B(MTNR1B)是一种主要参与褪黑素代谢过程的 G 蛋白偶联受体,主要位于 11q21 号染色体上。在现有的研究中,关于 MTNR1B 基因 rs10830963 是否与 T2DM 的发生发展有关,结果并不一致。有研究表明褪黑素受体(MTNR)在胰岛细胞中大量表达,且血浆褪黑素水平与胰岛素浓度呈负相关关系[4];Hu 和 Jia[5]通过调查研究发现,MTNR1B 单核苷酸多态性与血糖水平升高有关,其等位基因能增加亚洲人群 2 型糖尿病患病风险。最近也有报道显示,MTNR1B 基因多态性可能影响胰岛素分泌,而 MTNR1B rs10830963 可能是一个关键变异,该基因与胰岛素代谢水平密切相关,并且可导致妊娠期糖尿病(GDM)发病率的增加[6-7]。然而,Bai 等[8]通过 Meta 分析发现,MTNR1B 与亚洲人群T2DM 关联不大。因此,有必要重新对 MTNR1B 与 T2DM 相关性进行系统评价,以期更好地评估 MTNR1B 基因变异与中国人群 T2DM 之间的潜在联系,为 2 型糖尿病早期诊断、健康管理以及并发症的防治提供有利依据。
1 资料与方法
1.1 文献检索策略
以“褪黑素受体 1B”或“褪黑素受体-1B”、“2 型糖尿病”或“T2DM”、“多态性”为检索词,检索 4 个中文数据库:即中国知网、CBM、维普、万方。以“Melatonin receptor 1B” or “MTNR1B” or “MTNR-1B” or “MT2”、“type2 diabetes” or “T2DM”、“variant” or “polymorphism” or “mutant” 为检索词,检索 3 个英文数据库:PubMed、Web of Knowledge、Springer。收集 MTNR1B 基因多态性与 T2DM 关系的病例-对照研究,并对各研究的参考文献进行手工检索,检索时间从建库至 2020 年 6 月 1 日。
1.2 纳入和排除标准
纳入标准:①中国人群中 T2DM 病例-对照研究,病例组包括经不同标准确诊的 T2DM 患者,合并疾病及家族史无特殊限定,对照组为不患 T2DM 的健康人群或者同期体检人群;②MTNR1B 基因多态性;③病例组和对照组基因型分布及频率记录无缺失。
排除标准:①非中国人群研究或具有家族史人群研究;②未提供或无法获取基因型分布和结局的研究;③重复报道的个案报告、调查研究、生态学研究及综述等。
1.3 资料提取及质量评价
两位调查员根据纳入和排除标准独立筛检文献、交叉核对后提取最终资料数据。数据信息主要包括发表年份、第一作者、国家区域、种族、等位基因检测方法、病例组和对照组样本量及其基因型分布情况等。
应用 NOS 量表评分标准对入选文献进行质量评价,主要评分要素包括:研究对象的选择(最高 4 分)、组间可比性(最高 2 分)、暴露因素(最高 3 分)共 3 个方面,满分为 9 分,其中≥ 6 分即可纳入 Meta 分析。
1.4 统计学处理
本研究采用 RevMan 5.3 软件进行分析。通过计算各组等位基因、显性、隐性、纯合子、杂合子遗传等 5 个模型的合并值及 95%来评估 MTNR1B 基因多态性与 T2DM 的关系,检验水准 α = 0.05。利用2检验就对照组基因型分布情况进行 Hardy-Weinberg(HWE)定律平衡检验。此外,采用 Q 检验来评价组间异质性大小,当0.01 或 I2> 50% 时,代表存在一定的异质性,即采用随机效应模型合并计算值,否则,采用固定效应模型合并。漏斗图用来评估发表偏倚。
2 结果
2.1 文献检索结果
经两名调查员独立筛选,共同协定采用初筛文献共41 篇,排除重复文献 13 篇、综述类文献5 篇、数据不完整文献 16 篇,最终本研究纳入文献 6 篇(图 1)。包括外文 4 篇,中文文献 2 篇。研究对象为中国人群,研究方法均为病例-对照研究,病例组多为医院人群、对照组为同期健康人群或体检人群,两组可比性较好。以 rs10830963 为位点共纳入病例组6596 例,对照组7234 例,基因型检测方法采用 PCR-RFLP 技术 2 篇、其他方法 4 篇。所选文献基本特征及 rs10830963 位点基因频率分布情况详见表 1。
2.2 纳入文献的质量评价
纳入文献研究目的明确,T2DM 诊断标准与对照组筛选标准有准确的界定,所选样本具有代表性、样本量充足,基因检测方法合理,统计方法和数据准确,结果分析可靠,总体上纳入文献质量较高。依据 NOS 量表主要从 3 个方面(研究对象的选择、可比性、暴露因素)对纳入的 6 篇文献质量进行评价。结果如表2 所示,所有纳入 Meta 分析的文献质量评价得分均不小于 6 分,这也表明文献质量均较高。此外,对纳入研究对照组基因型分布进行 HWE 定律检验,通过统计学分析发现,所纳入研究对照组基因型分布符合 HWE 平衡,其检验水平值均大于 0.05。
2.3 Meta 分析
Meta 分析结果见表 3,杂合子遗传模型各研究间无异质性(Q= 0.46,I2< 60%),采用固定效应模型,其余四种基因模型研究结果均存在显著异质性(Q< 0.05 或I2> 60%),采用随机效应模型。以基因型 GG 为暴露因素,GC+CC 为非暴露因素作显性遗传模型,合并= 0.92,95%(0.85,0.99);以基因型 CC 为暴露因素,GC+GG 为非暴露因素作隐性遗传模型,合并= 0.89,95%(0.77,0.96),说明 rs10830963 位点与 T2DM 存在明显的相关性,且 CC 基因型可能是 T2DM 的保护基因型。以G 等位基因为暴露因素,C 等位基因为非暴露因素作等位基因遗传模型,其合并= 1.51,95%(1.18,1.67);以突变纯合子 GG 为暴露因素,CC 为非暴露因素的纯合子遗传模型,合并= 1.21,95%(1.09,1.35),差异具有统计学意义(< 0.01),表明rs10830963 与 T2DM 存在显著相关性,且 G 等位基因可能是 T2DM 的危险基因,携带 GG 基因型人群相对于 CC 基因型更容易发生 T2DM。

图 1 文献筛检过程流程图

表 1 纳入文献基本特征及 rs10830963 位点基因型分布情况

表 2 纳入文献的质量评价(分)

表 3 MTNR1B rs10830963 多态性位点 Meta 分析结果
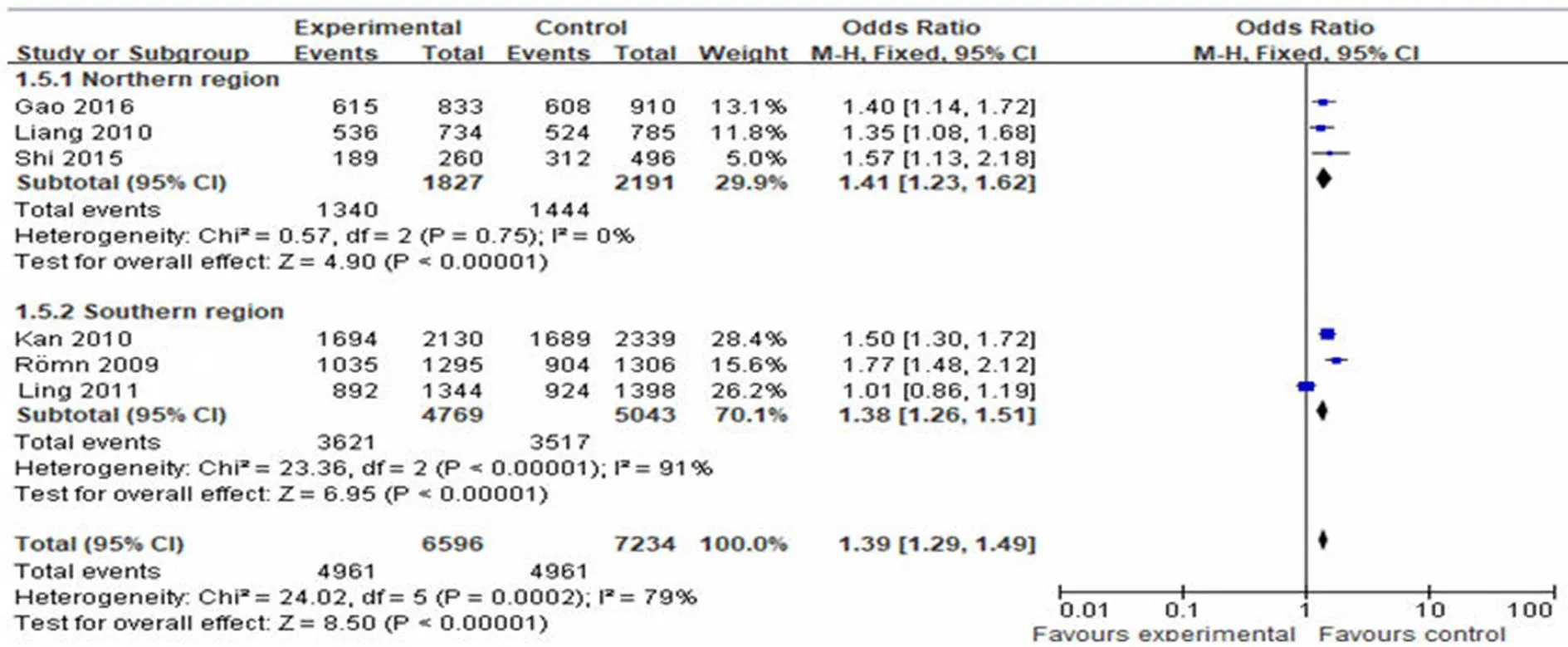
图 2 rs10830963 等位基因频率与 T2DM 关系的森林图
2.4 rs10830963 等位基因与 T2DM 的发病风险的亚组分析
Meta 结果显示,rs10830963 等位基因遗传模型(G vs C)异质性检验 I2值高达 90%(表 3)。故采用亚组分析进一步探讨其可能的异质性来源,将研究文献按我国区域划分为北方地区和南方地区,每区各 3 篇。分析结果如图2 所示,两地区等位基因异质性检验结果差异较大,其中,北方地区 I2= 0%(= 0.75),总效应= 1.41(95%:1.23,1.62);南方地区结果 I2= 91%,其差异具有统计学意义(< 0.01),总效应= 1.38(95%:1.26,1.51)。这也反映该等位基因与 T2DM 明显具有相关性,且异质性最可能来源于区域差异。
2.5 发表偏倚评价
评估 rs10830963 等位基因的发表偏倚,结果如图 3 所示。所纳入研究在漏斗图中基本呈对称分布,说明各文献之间发表偏倚较小。大部分散点相对集中于漏斗图上部,这也表明研究纳入的样本代表性较好、准确度较高。综上所述,未见明显的发表偏移。

图 3 rs10830963 等位基因频率与 T2DM 关系的漏斗图
3 讨论
近年来,有关 MTNR1B 基因多态性与糖尿病易感性之间的研究一度成为该领域研究热点之一。虽然一些临床研究通过等位基因效应探讨了 MTNR1B 基因对 T2DM 的影响,但在中国人群中,MTNR1B 多态性与 T2DM 之间的关系尚未阐明。另外,由于众多研究样本量较少,其研究结果的不一致性和不完整性对统计效应、临床应用价值均产生影响。因此,本研究通过严格的文献纳入及排除标准,对 MTNR1B rs10830963 多态性与中国人群 T2DM 相关性进行 Meta 分析,6 项病例对照研究被纳入,涉及中国西北、东北、西南、东南等四个地区,地域分布相对广泛。研究结果表明,等位基因或基因型效应模式下 rs10830963 基因与中国人群 T2DM 具有一定的相关性。在显性遗传模型、隐性遗传模型条件下,MTNR1B rs10830963 与 T2DM 相关性的合并分别为 0.92(0.85,0.99)、0.89(0.77,0.96),结果均具有统计学意义,由此可以推测等位基因 C 或基因型 CC 可能会降低 T2DM 的患病风险,两者属于 T2DM 保护基因。此外,等位基因遗传模型和纯合子遗传模型条件下,合并分别为 1.51(1.18,1.67)、1.21(1.09,1.35),且差异亦具有统计学意义(< 0.01),这表明 GG 基因型、G 等位基因可能是 T2DM 的危险基因,且携带 G 等位基因人群可能更易诱发 T2DM。
MTNR1B(MT2)是 G 蛋白偶联受体之一,通常情况下可与同源受体 MT1 共同参与褪黑素的代谢过程。而褪黑素作为一种主要由松果体分泌产生的活性神经激素,它主要存在于人体视网膜和大脑组织中,其分泌具有明显的昼夜节律性。有研究已证实这种昼夜节律可以调节胰岛素水平[15]。在国外一项调查研究显示,MTNR1B 基因变异与欧洲成年人空腹血糖平均水平显著相关,其中 rs10830963 G 基因型关联性最强,由此推断携带 G 等位基因能导致 T2DM 患病率增加[16];Rönn等[11]在上海的一项临床研究也表明 rs10830963 位点上 G 等位基因与中国汉族人血糖水平的升高以及 T2DM 的患病风险增加有关,具体机制尚不清楚。但这都反映出单核苷酸多态性位点 rs10830963 中 G 等位基因与早期的胰岛素反应以及 β 细胞对血糖的敏感性有重要的相关性[16]。本研究显示 GG 基因型、G 等位基因携带者 T2DM 患病风险分别是 CC 基因型携带者、C 等位基因携带者的 1.21 倍和 1.51 倍,这与上述研究结果基本一致。Lyssenko 等[17]已证实携带 rs10830963 风险基因型的个体中 MTNR1B 基因 mRNA 的表达与胰岛素水平分泌呈负相关,且 T2DM 患者中 MTNR1B 基因的表达水平增加,由此可以推测其致病机制可能是通过抑制 β 细胞功能从而诱导 T2DM 发生。
此外,本研究按照地区属性将纳入文献划分不同的区域,进而分析其异质性产生的原因,结果发现南方地区、北方地区异质性结果差异较大,且南方地区异质性检验结果差异具有显著统计学意义(< 0.01),这也说明其异质性最可能来源于区域差异,这与2012 年李慧[18]在北京、大连等地区的研究结果相似。除了地域因素能影响异质性外,仍然存在一些其他方面的影响因素,这可能与研究的局限性有关。
本研究局限性:首先,纳入文献的检测方法不完全统一、研究自身不可控变量较多,容易引起异质性差异;其次,T2DM 的多态性风险评估还与种族、年龄、性别、环境因素有关,而文章纳入文献有限,未能涉及不同种族,也未能将基因-环境因素多态性与 T2DM 的发病风险进行综合性评估,可能存在混杂偏移,因此有待扩大样本量进一步研究证实。
综上所述,中国人群 MTNR1B rs10830963 基因多态性与单纯 T2DM 发病具有一定的相关性,且携带 G 等位基因人群相对于携带 C 等位基因者可能更易诱发 T2DM。此次研究结果将对中国人群 T2DM 早期筛查诊断、防治和提高 T2DM“三级预防”水平等方面具有一定的参考价值。
[1] American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care, 2014, 37 Suppl 1:S81-S90.
[2] Papazafiropoulou AK, Papanas N, Melidonis A, et al. Family history of type 2 diabetes: Does having a diabetic parent increase the risk? Curr Diabetes Rev, 2017, 13(1):19-25.
[3] Gaulton KJ. Mechanisms of type 2 diabetes risk loci. Curr Diab Rep, 2017, 17(9):72.
[4] Lardone PJ, Alvarez-Sanchez SN, Guerrero JM, et al. Melatonin and glucose metabolism: Clinical relevance. Curr Pharm Des, 2014, 20(30):4841-4853.
[5] Hu C, Jia W. Linking MTNR1B variants to diabetes: The role of circadian rhythms. Diabetes, 2016, 65(6):1490-1492.
[6] Nisa H, Qi KHT, Leng J, et al. The circadian rhythm-related MTNR1B genotype, gestational weight gain, and postpartum glycemic changes. J Clin Endocrinol Metab, 2018, 103(6):2284-2290.
[7] Firneisz G, Rosta K, Al-Aissa Z, et al. The MTNR1B rs10830963 variant in interaction with pre-pregnancy BMI is a pharmacogenetic marker for the initiation of antenatal insulin therapy in gestational diabetes mellitus. Int J Mol Sci, 2018, 19(12):3734.
[8] Bai Y, Tan L, Li L, et al. The roles of ADIPOQ rs266729 and MTNR1B rs10830963 polymorphisms in patients with gestational diabetes mellitus: a meta-analysis. Gene, 2020, 730:144302.
[9] Ling Y, Li X, Gu Q, et al. A common polymorphism rs3781637 in MTNR1B is associated with type 2 diabetes and lipids levels in Han Chinese individuals. Cardiovasc Diabetol, 2011, 10:27.
[10] Gao K, Wang J, Li L, et al. Polymorphisms in four genes (KCNQ1 rs151290, KLF14 rs972283, GCKR rs780094 and MTNR1B rs10830963) and their correlation with type 2 diabetes mellitus in Han Chinese in Henan province, China. Int J Environ Res Public Health, 2016, 13(3):260.
[11] Rönn T, Wen J, Yang Z, et al. A common variant in MTNR1B, encoding melatonin receptor 1B, is associated with type 2 diabetes and fasting plasma glucose in Han Chinese individuals. Diabetologia, 2009, 52(5):830-833.
[12] Kan MY, Zhou DZ, Zhang D, et al. Two susceptible diabetogenic variants near in MTNR1B are associated with fasting plasma glucose in a Han Chinese cohort. Diabet Med, 2010, 27(5):598-602.
[13] Shi XE, Peng XJ, Wang ZT, et al. Correlation between MTNR1B gene rs10830963 polymorphism and type 2 diabetes mellitus in Gansu Bao-an population.Clin Focus, 2015, 30(5):544-547. (in Chinese)
石秀娥, 彭锡嘉, 王忠太, 等. 甘肃积石山县保安族人群MTNR1B基因rs10830963位点多态性与2型糖尿病关联性分析. 临床荟萃, 2015, 30(5):544-547.
[14] Liang SQ. Association of MTNR1B gene with type II diabetes in the people of the Han nationality of jilin region. Changchun: Jilin University, 2010. (in Chinese)
梁世倩. MTNR1B基因与吉林地区汉族人II型糖尿病的相关性研究. 长春: 吉林大学, 2010.
[15] Touitou Y, Reinberg A, Touitou D, et al. Association between light at night, melatonin secretion, sleep deprivation, and the internal clock: health impacts and mechanisms of circadian disruption. Life Sci, 2017, 173:94-106.
[16] Prokopenko I, Langenberg C, Florez JC, et al. Variants in MTNR1B influence fasting glucose levels. Nat Genet, 2009, 41(1):77-81.
[17] Lyssenko V, Nagorny CL, Erdos MR, et al. Common variant in MTNR1B associated with increased risk of T2DM and impaired early insulin secretion. Nat Genet, 2009, 41(1):82-88.
[18] Li H. Study of the association of MTNR1B rs1387153 gene and KLT14 rs972283 gene polymorphism with 2 diabetes mellitus in the northern area Chinese. Dalian: Dalian Medical University, 2012. (in Chinese)
李慧. 基因MTNR1B rs1387153及基因KLT14 rs972283的变异位点与中国北方人群T2DM的相关研究. 大连: 大连医科大学, 2012.
国家自然科学基金(81273568)
哈小琴,Email:haxiaoqin2013@163.com
2020-09-15
10.3969/j.issn.1673-713X.2021.01.014
