Hsp90抑制剂的研究进展
2021-02-22张钟元阎爱侠
张钟元,阎爱侠
·综述·
Hsp90抑制剂的研究进展
张钟元,阎爱侠
100029 北京化工大学化工资源有效利用国家重点实验室/生命科学与技术学院
Hsp90 是最丰富的热休克蛋白,它广泛存在于真核以及原核生物中。Hsp90 的主要作用是帮助其客户蛋白正确折叠和降解,这些客户蛋白中有许多是在癌症发生中起到重要作用的激酶和转录因子。还有许多客户蛋白对于其他疾病的发展都是必不可少的,包括阿尔茨海默病和其他神经退行性疾病以及病毒和细菌感染。Hsp90 抑制剂通过与 Hsp90 调节位点结合引起 Hsp90 构象改变,并诱导底物蛋白降解,从而发挥抑制作用。虽然目前还没有 Hsp90 抑制剂被批准上市,但是以 Hsp90 为靶点进行抑制剂的开发仍然具有重要意义,本文主要对其抑制剂的抗肿瘤活性研究进展进行综述。
1 Hsp90 的结构特点
Hsp90 是高度保守的 ATP 依赖性热应激蛋白,其表达是由应激相关转录因子热休克因子 1(HSF1)诱导的,在应激耐受性和蛋白质折叠中起着非常重要的作用[1]。它是维持、激活或折叠特定客户蛋白质的必需分子伴侣,这些客户蛋白中有许多是信号通路中重要的蛋白质,包括 RAF 激酶蛋白、酪氨酸激酶受体 2(ErbB2)、Cdk4 和类固醇激素受体等[2]。
在人源 Hsp90 中已经鉴定出 4 种亚型:存在于胞质内的 Hsp90α 和 Hsp90β,存在于线粒体基质内的肿瘤坏死因子相关蛋白 1(TRAP1)以及内质网中的葡萄糖调节蛋白 94(Grp94)[3]。所有亚型都包含一个保守结构,包括 N 末端 ATP 酶结合域、中间域以及 C 末端结合域。由于 4 个亚型在细胞中的位置不同,所以它们各自结合的蛋白也不相同。
Hsp90 在细胞中以同源二聚体形式存在,每个单体由 3 个结构域组成:一个 N 末端结构域(NTD),一个中间域(MD)和一个C 末端结构域(CTD)[4]。NTD 是 Hsp90 的主要 ATP 酶结构域,与组氨酸激酶和拓扑异构酶具有高度的结构相似性。MD 在 ATP 水解以及客户蛋白识别中起到重要作用,并且在 NTD 和 MD 中间由一段高电荷区域连接[5]。CTD 形成了 Hsp90 主要的二聚化界面,同时还包含 MEEVD 序列,该序列是对 TPR 域伴侣分子非常重要的相互作用位点[6]。
NTD 包含一个 ATP 结合位点,该位点负责 ATP 酶活性并提供伴侣蛋白循环所需的能量。NTD 包含 GHKL 超家族共有的一个“Bergerat fold”折叠区,该折叠区是一面由反平行的β 链,一面由单层α 螺旋组成的“双层三明治”结构[7]。不同于蛋白激酶表现出的典型延伸构象,这个结合口袋的 ATP 以独特的弯曲构象结合。ATP 结合口袋处于α 螺旋很深的裂隙中并一直延伸到疏水表面,天冬酰胺残基结合的Mg2+离子通过溶剂介导作用将 ATP 所有的磷酸酯部分连接到蛋白质,腺嘌呤部分的 N6 位氨基与 Asp93 形成氢键[8]。在过去的数十年中,开发的所有 Hsp90 N 端抑制剂均是在此区域与 ATP 竞争性结合达到抑制 Hsp90 的作用。
Hsp90 的 MD 由大中间域以及小中间域两部分组成,并且也是蛋白激酶 PKB/Akt 的结合位点[5]。由于 Hsp90 对 ATP 的亲和力很低,因此 NTD 中的结合位点必须与 MD 接触并且进行相互协同作用才能使 ATP 水解。
CTD 对于维持 Hsp90 同型二聚体的生物学活性构象非常重要,该结构域具有一个保守的 MEEVD 序列,该序列负责募集包含例如 Hsp70-Hsp90 组织蛋白在内的伴侣蛋白[9]。同时 CTD 包含第二个核苷酸结合位点,并且仅当 NTD 的 ATP 结合位点被占用时此位点才会被激活,此位点可变构调节 N 末端 ATP 酶的活性。NTD 对腺嘌呤具有特异性,而 CTD 的结合位点不仅可以结合嘌呤还可以结合嘧啶核苷酸[4]。
2 Hsp90 N 末端抑制剂
2.1 格尔德霉素及其衍生物
格尔德霉素(geldanamycin,GA)(图 1)属于苯醌安莎霉素,是鉴定出的第一个Hsp90 N 末端抑制剂,在过去几十年中已成为基于天然产物药物发现的原型[10]。Hsp90-GA复合物的晶体结构揭示了GA为 ATP 竞争性抑制剂,复合物的形成改变了 Hsp90 的构象,Hsp90 所需 ATP 酶的活性受到抑制,进而使得 Hsp90 不能与其客户蛋白形成正确复合体,最终导致其客户蛋白被蛋白酶体降解[11-12]。GA 的体外活性为Kd = 1.2 μmol/L,但在体内 Kd 值却增加50 ~ 100 倍。由于体内活性不佳以及严重的肝毒性限制了其在临床中的应用,针对 GA 的缺点进行改造,随后产生了一系列 GA 衍生物。
17-烯丙基氨基-17-去甲氧基格尔德霉素(17-AAG)(图 1)是 GA 第 17 位甲氧基被烯丙基氨基取代得到的衍生物,相比 GA,其生物活性有大幅提高(IC50= 31 nmol/L),并且毒性得到了改善[13]。17-AAG 已经完成 III 期临床试验[14],但是由于溶解度差以及脱靶毒性,其在治疗晚期肿瘤方面的功效存在一定局限性。为了达到最佳治疗效果,目前一般是将 17-AAG 与其他抗癌方案一起进行联合给药。17-AAG 还被发现可以通过削弱 T 细胞的功能从而减缓小鼠脑脊髓炎的发展;通过抑制 Hsp90 还破坏了 HIV 蛋白的表达;在体内靶向 Hsp90 还可以干扰诺如病毒的复制[14]。

图 1 格尔德霉素及其衍生物的化学结构
17-二甲基氨基乙基氨基-17-去甲氧基格尔德霉素(17-DMAG)(图 1)是 GA 第 17 位甲氧基被 N,N-二甲基乙胺取代得到的衍生物(IC50= 24 nmol/L),与 17-AAG 相比,由于可电离氨基的存在增加了水溶性,提高了口服生物利用度,并且具有更好的抗肿瘤活性[15]。17-DMAG 已经完成了 I 期临床研究[16],根据结果显示 II 期的推荐给药剂量为每周 80 mg/m2。17-DMAG 可以增加 CD8 阳性 T 细胞,从而减轻蛋白尿症;该药物在处理大疱性表皮松懈的小鼠模型中有效,并且可以干扰包括 IFN-γ、TNF-α 和 IL-17 在内的炎症因子的表达。
IPI-493(图 1)是 GA 第 17 位甲氧基被氨基取代的衍生物,IPI-493 较 GA 相比生物活性大幅提高(EC50= 34 nmol/L),并且毒性得到改善[17]。IPI-493 对胃肠道间质瘤具有很强的抗肿瘤潜力,单一给药时已经具有一定的抗肿瘤活性,当与伊马替尼或舒尼替尼联合使用时其治疗效果会进一步增强。而且如果将 Hsp90 抑制剂与酪氨酸激酶抑制剂联合使用可以潜在地克服肠道间质瘤患者对伊马替尼或舒尼替尼的耐药性问题[18]。
IPI-504(图1)是 17-AAG 的水溶性氢醌盐酸盐衍生物(EC50= 64 nmol/L),具有比 17-AAG 更好的亲和力以及水溶性,两者通过氧化还原酶的作用在体内以氧化还原平衡存在[19]。IPI-504 曾经被认为是衍生自格尔德霉素类的最有希望的抑制剂,但是在多发性骨髓瘤、非小细胞肺癌、乳腺癌以及胃肠道间质瘤患者中进行的 I ~ III 期临床试验中或是未能达到预期的疗效或是在治疗组中观察到较高的死亡率,临床试验均被终止。
2.2 间苯二酚衍生物
根赤壳菌素(radicicol,RD)是一种包含间苯二酚结构的大环内酯抗生素,最早是从真菌 Bonorden 分离得到的[20]。RD 的化学性质不稳定并且缺乏体内活性,但是进入临床试验中的许多抑制剂都包含间苯二酚核心结构,包括 NVP-AUY922、AT-13387 以及 ganetespib,这些小分子的结构见图 2。虽然这些小分子都不是通过直接改造 RD 而得到的,但是它们将间苯二酚核心结构作为与 Hsp90 结合的关键基团而明显类似于 RD 的作用效果。
NVP-AUY922 是基于 4,5-二芳基异噁唑骨架的 Hsp90小分子抑制剂,由英国癌症研究中心的研究员采用基于结构的合理药物设计方法合成,目前由诺华公司开发。在 Hsp90 荧光偏振竞争性结合实验中,IC50达到了21 nmol/L 的高活性,体外实验表明可以抑制多种人类癌细胞系的增殖[21]。在细胞水平上,NVP-AUY922 与阿霉素联合用药可以诱导 MCF-7 乳腺癌细胞株凋亡并下调血管内皮生长因子[22]。NVP-AUY922 主要用于患有复发或难治多发性骨髓瘤、非小细胞肺癌以及 HER2+和 Er+转移性乳腺癌的患者,目前已经完成多项 I/II 期临床试验。NVP-AUY922 对于小鼠脑脊髓炎、HIV 蛋白的表达以及对诺如病毒的复制与 17-AAG 作用一致。

图 2 间苯二酚衍生物的化学结构
AT-13387 是 Astex 公司科学家在进行片段筛选得到含有间苯二酚结构的目标化合物后,经过设计优化得到的小分子(Kd= 0.71 nmol/L)[23]。AT-13387 已经完成用于实体瘤患者的 I 期临床试验,用于胃肠道间质瘤经单独或与伊马替尼联用给药的 II 期临床试验,用于非小细胞肺癌单独或与克唑替尼联用给药的 I、II 期临床试验,用于前列腺癌单独或与乙酸阿比特龙联用给药的 I、II 期临床试验。
Ganetespib 是由 Synta 公司开发的含间苯二酚的三唑杂环化合物(IC50= 43 nmol/L),属于第二代 Hsp90 抑制剂,对多种癌症均具有抗肿瘤作用[24]。Ganetespib 用于 HER2 阳性转移性乳腺癌患者的 I 期临床试验表明,与低浓度的紫杉醇以及曲妥珠单抗联用的三联体疗法效果较好[25],显示 II 期临床的参考用药量为 150 mg/m2;用于晚期食管胃癌患者的 II 期临床试验结果表现出可控的毒性,但是由于单独给药活性不足而被提前终止了。
2.3 嘌呤类衍生物
PU-3(图 3)是 Chiosis 等[26]利用 Hsp90 与 ATP 酶结合具有的独特折叠特征,采用基于结构的方法设计的第一个合成的 Hsp90 抑制剂(IC50= 0.55 μmol/L)。作为嘌呤支架类的原型,PU-3 已经通过多种策略进行结构优化,产生了一系列具有更优类药性质的小分子 Hsp90 抑制剂。这些小分子具有一些共同特征:均包含一个连接于嘌呤或嘌呤样核心的氨基基团和一个相距约 0.5 nm 的芳香环部分作为与 Hsp90 结合的关键基团[27]。已经进入临床研究的小分子包括 PU-H71、BIIB021、BIIB028、MPC-3100 以及类似嘌呤的 Debio0932,这些小分子的结构见图 3。
PU-H71 是 PU3 的衍生物(IC50= 90 nmol/L),对 Hsp90 的 ATP 结合域具有高溶解度和特异性[28]。据报道 PU-H71 在许多临床前模型中均具有抗肿瘤作用,在三阴性乳腺癌细胞系中的 IC50为 65 ~ 140 nmol/L。针对实体瘤或淋巴瘤患者的两项 I 期临床试验由于药物供应中断而提前结束了。该药物自 2019 年以来正在积极招募患者进行晚期实体瘤、淋巴瘤和骨髓增生性疾病的 I 期临床试验评估。
BIIB021 是第一个基于口服、非格尔德霉素合成的 Hsp90 抑制剂(IC50= 310 nmol/L),在纳摩尔浓度的临床前模型中表现出抗肿瘤活性[29]。BIIB021 在嘌呤类别中具有结构特殊性,因为其芳基部分连接在嘌呤的 9 位,为了维持0.5 nm 的临界距离而将氨基移至 2 位[30]。该药物目前已经完成针对晚期实体瘤和淋巴瘤的 I 期临床试验和针对乳腺癌以及胃肠道间质瘤的 II 期临床试验。BIIB028 是第二代口服 Hsp90 抑制剂,是 BIIB021 的前药[31]。其在效力和耐受性方面都比 BIIB021 有所改进,并且增加了静脉给药的治疗窗口[32]。
MPC-3100 是由 Myrexis 公司开发的药物(IC50=540 nmol/L),已经完成了针对难治性或复发性癌症的 I 期临床研究,然而不良的溶解性以及制剂问题限制了该药物的进一步临床开发[33]。为了解决溶解度和生物利用度较差的问题,又设计并优化得到了前药 MPC-0767,该药物克服了MPC-3100 暴露出的一些缺点,但是目前 MPC-0767 还在进行临床前评估。
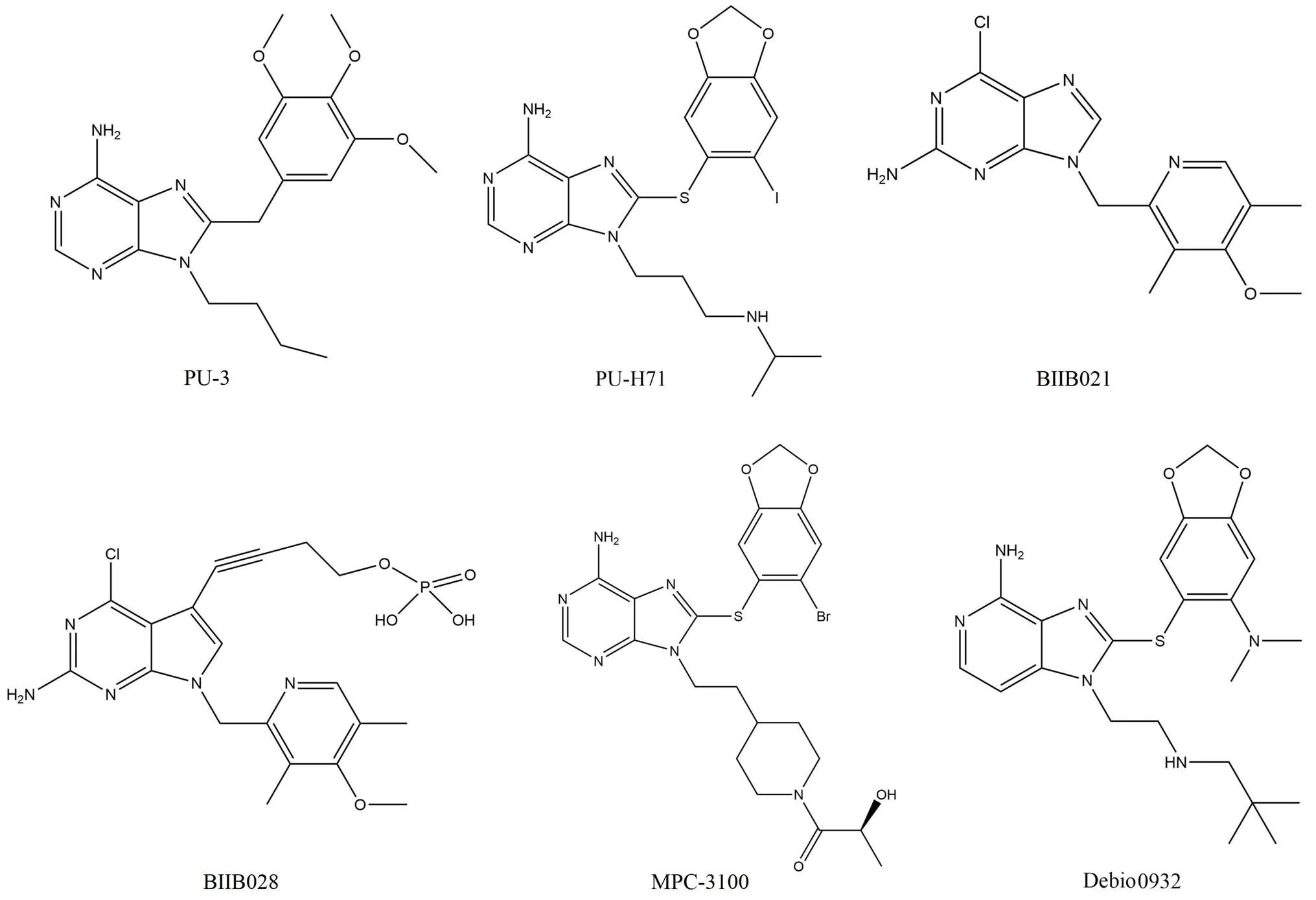
图 3 嘌呤类衍生物的化学结构
Debio0932 是具有咪唑并吡啶结构的第二代口服 Hsp90 抑制剂(IC50= 100 nmol/L),由美国Curis 公司的科学家用碳置换了 N3 得到的嘌呤样衍生物[34]。Debio0932 已经完成了针对晚期实体瘤或淋巴瘤的 I 期临床研究,试验结果显示该药物具有有限的临床活性以及可控制的毒性,进一步可以发展成为非小细胞肺癌的辅助治疗药物[35]。
2.4 苯甲酰胺衍生物
苯甲酰胺化合物是另一类代表性的合成 Hsp90 抑制剂,苯甲酰胺基团模拟腺嘌呤,酰胺基团与 Asp93 和 Thr184 之间形成氢键。
SNX-5422(图 4)是具有良好水溶性,可选择性地与 ATP 口袋结合的口服 Hsp90 抑制剂(IC50= 32 nmol/L),它也是 SNX-2112 的前药。SNX-5422 完成了针对晚期实体瘤和淋巴瘤患者的 I 期临床试验,尽管结果显示具有良好的耐受性,也达到了预期的抑制效果,但是由于眼毒性以及潜在的不可逆性视网膜损伤的不良反应,终止了 SNX-5422 的开发[36]。
TAS-116(图 4)是苯甲酰胺类衍生物,它是口服 Hsp90α/β 选择性抑制剂,并不抑制 Hsp90 旁系同源物(Hsp90α,Ki= 34.7 nmol/L;Hsp90β,Ki= 21.3 nmol/L)[37]。TAS-116 已经完成了在实体瘤患者中的 I 期临床研究,但是在临床环境中普遍观察到的不良事件是会不同程度导致视觉障碍[38]。
XL888(图 4)是一种选择性的 Hsp90 ATP 竞争性抑制剂。它可以抑制多种人类肿瘤细胞系的增殖,IC50值介于 0.1 ~ 45 nmol/L 之间,并导致包括 HER2、MET、突变型 BRAF 和突变型 EGFR 在内的客户蛋白显著降解[39]。目前正在针对大肠腺癌、转移性胰腺腺癌、黑色素瘤以及皮肤癌招募患者准备进行 I 期临床试验。
2.5 其他类
Hsp990 是一种可口服生物利用的合成小分子,可通过 ATP 结合位点抑制 Hsp90(Hsp90α,IC50= 0.3 nmol/L;Hsp90β,IC50= 0.8 nmol/L),导致泛素蛋白酶体途径驱动的客户蛋白降解并抑制多种癌蛋白。它的抗肿瘤作用在不同恶性肿瘤的临床前评估中得到证实,在针对晚期实体恶性肿瘤的 I 期临床研究中表现出相对较好的耐受性,神经毒性是最相关的剂量限制性毒性[40]。
3 Hsp90 C 末端抑制剂
3.1 新生霉素及其衍生物
新生霉素和香豆素A1(图 5)是从链霉菌种中分离得到的天然氨基香豆素类抗生素,也是第一个被报道的 C 末端 Hsp90 抑制剂[41]。尽管缺乏与抑制剂结合的 Hsp90 C 末端共晶体结构的报道,但是已经使用不同的技术来确认它们在 Hsp90 C 末端结合域的结合位点。使用固相结合测定方法、点突变分析方法、采用蛋白酶指纹图谱以及生物信息学分析的综合方法证实了新生霉素在该位点的结合[42]。
由于新生霉素对 Hsp90 的抑制活性较低(IC50约为700 nmol/L),因此通过构效关系研究设计优化得到了衍生物 A4[43]和 KU-32[44]。这些衍生物的结构可以模拟腺嘌呤和鸟嘌呤,并且提供氢键受体和供体以适应更高的特异性。

图 4 苯甲酰胺衍生物以及 Hsp990 的化学结构
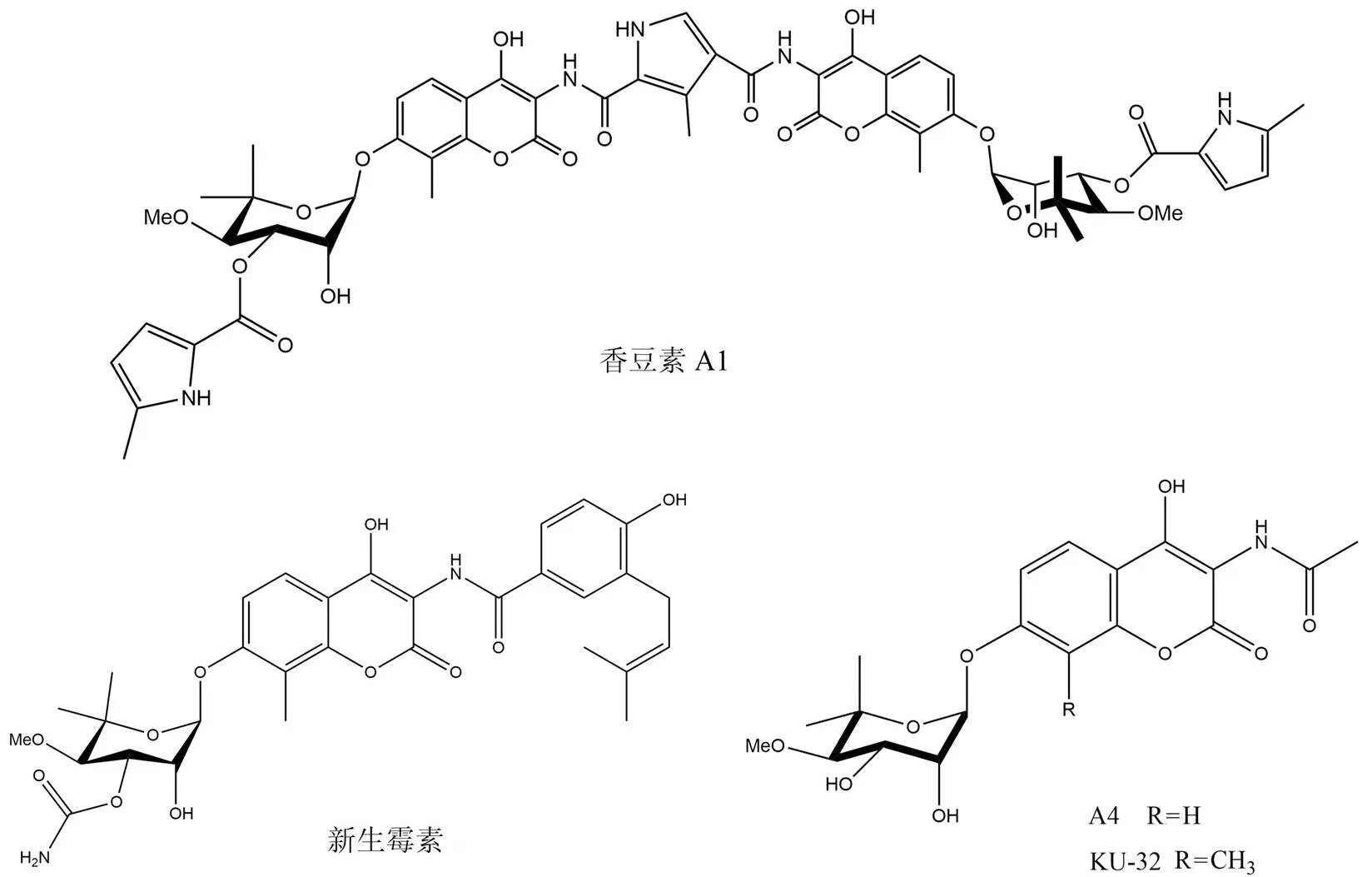
图 5 新生霉素及其衍生物的化学结构
3.2 表没食子儿茶素没食子酸酯
表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)(图 6)是一种来自绿茶茶树的多酚[45],同新生霉素一样也是与 C 端 ATP 结合位点结合的 Hsp90 抑制剂(IC50= 7.4 μmol/L)。EGCG 通过抑制 Hsp90 同型二聚体的功能降低了与癌症相关的几种 Hsp90 客户蛋白的水平,如 ErbB2、Raf-1、phospho-AKT、pERK 以及 Bcl-2[46]。近年来已经开发了一系列 EGCG 的半合成和合成类似物,目的是克服其由多个酚羟基部分和其结构中代谢不稳定的酯引起的不良的类药性质。这类化合物也在体外显示出更强的Hsp90 抑制剂作用以及抗肿瘤功效[47]。

图 6 EGCG 及黄酮类化合物的结构
3.3 黄酮以及类黄酮化合物
鱼藤素(图 6)是一种黄酮类化合物(IC50= 0.11 μmol/L),在各种癌细胞系以及动物实验中均表现出优异的抗增殖和抗肿瘤血管生成特性,随后的实验证明其是通过抑制 Hsp90 C 端 ATP 结合口袋发挥作用的[48]。然而在大鼠的实验中发现鱼藤素会诱发帕金森病样综合征,为了克服这种不利因素对其进行了结构类似物设计和改造,产生了其结构类似物 L80。L80 可以诱导癌细胞凋亡,并导致 Hsp90 客户蛋白降解以及磷酸化。通过实验证明了 L80 的结合位点也是属于 C 末端 ATP 结合区域,随后的分子对接研究进一步证实了同型二聚体的结合模式,其与 K615、S677 以及 S677' 之间形成关键相互作用[49]。
水飞蓟宾(图 6)是从水飞蓟果实中提取出的一种传统黄酮类药物,已被用于治疗肝胆疾病很多年,但是水飞蓟宾还显示出对许多癌细胞系的抗癌活性。该药物还被证明具有 Hsp90 C 端抑制活性,在导致依赖 Hsp90 客户蛋白降解的同时不会改变 Hsp90 水平,IC50约为200 μmol/L[50]。由于新生霉素和水飞蓟宾具有相似的生物学特性,因此开发了这两种天然产物的嵌合衍生物,从而产生了具有更好的 Hsp90 抑制活性的化合物[51]。
Derrubone(图 6)是通过高通量筛选分析发现的异戊烯基化的异黄酮类化合物(IC50= 9 μmol/L)。已有研究表明derrubone 及其合成类似物可以降解 Hsp90 客户蛋白 HER2,并且抑制乳腺癌和结肠癌细胞系的体外增殖[52-53]。已经开发了一系列新生霉素和derrubone 的异黄酮嵌合体,但是这些嵌合物并没有显示出明显的抗肿瘤作用[54]。
3.4 二氢吡啶
二氢吡啶已经被证实具有神经保护作用,在随后的研究中显示二氢吡啶 LA1011(图 7)可以与 Hsp90 结合产生抑制作用。但是与其他大多数 Hsp90 抑制剂的作用不同,并没有观察到 Hsp90 ATP 酶的活性受到抑制。使用等温滴定量热法可以证明 LA1011 与 Hsp90 C 末端区域结合,但是目前并没有充分的实验证据表明 LA1011 结合在 C 末端 ATP 结合位点[55]。
3.5 顺铂和 LA-12
顺铂(图 7)是目前常用的重金属铂类络合物,由于分子中铂的存在而广泛用于治疗各种癌症及实体瘤[56]。顺铂的抗癌活性是由于其形成链内或链间 DNA 加合物的能力,同时也可以与各种蛋白质、磷脂以及 RNA 相互作用。顺铂可以选择性地抑制 Hsp90 的某些功能,比如顺铂并不会诱导热休克反应,经亲和纯化和蛋白质指纹图谱进一步证实了顺铂与 Hsp90 C 末端区域结合。LA-12(图 7)是顺铂优化后的衍生物,与顺铂相比具有更高的 Hsp90 亲和力[57]。LA-12 可以诱导如突变体 p53、cyclin D1 和雌激素受体在内的一些 Hsp90 客户蛋白的降解,并且对多种癌细胞系,包括对顺铂耐药的癌细胞系也可以发挥抗肿瘤作用。
3.6 紫杉醇
紫杉醇(图 7)是治疗癌症的常见药物,其作用通过稳定微管和抑制有丝分裂实现。该药物可以诱导转录因子和激酶激活,从而模仿细菌脂多糖(LPS)的作用。与典型的 Hsp90抑制剂相反,紫杉醇会表现出刺激性反应,介导巨噬细胞的激活并发挥 LPS 拟态效应。并且有研究证明 17-AAG 与紫杉醇诱导的细胞凋亡具有协同作用[58]。
4 干扰Hsp90 辅助伴侣结合的抑制剂
Hsp90 的功能依赖于其许多核苷酸影响的构象。Hsp90 和辅助分子伴侣 Hsp70、Hsp40、HOP、p23、Cdc37 与客户蛋白等形成复合物保护客户蛋白不被蛋白酶体所降解。考虑到不同的伴侣分子产生不同的作用机制,可以通过破坏Hsp90 与其辅助分子之间的蛋白-蛋白相互作用来实现选择性的 Hsp90 抑制作用,从而降低毒性并提高选择性。
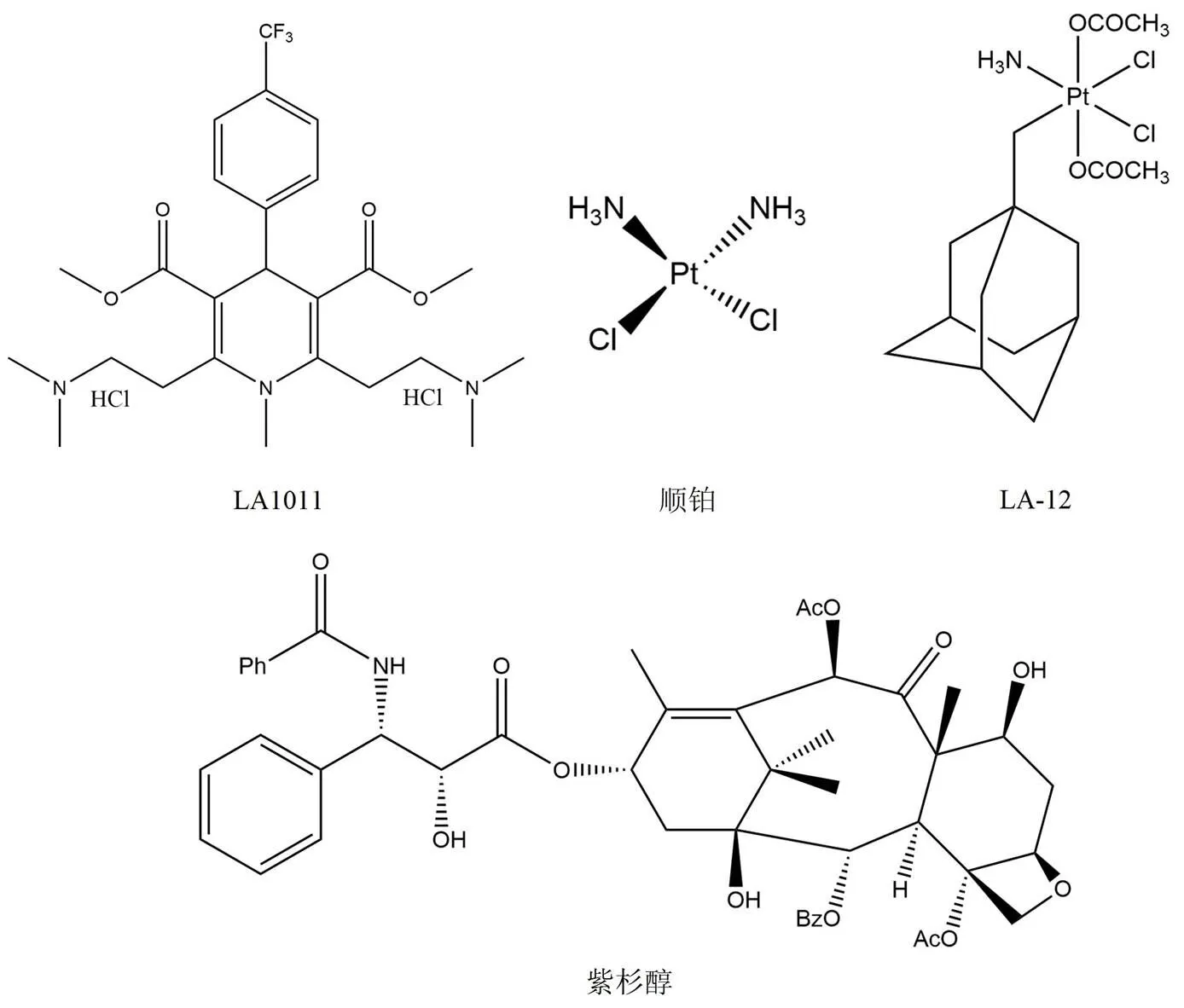
图 7 LA1011、顺铂、LA-12 以及紫杉醇的化学结构

图 8 干扰辅助伴侣结合的抑制剂化学结构
4.1 Hsp90-Cdc37 相互作用抑制剂
细胞分裂周期蛋白 Cdc37 可以帮助蛋白激酶结合到 Hsp90 上,这对于稳定 Hsp90 激酶复合物至关重要[59]。Cdc37 通过一个较大的相互作用表面与 Hsp90 相互作用,并且通过干扰 Hsp90 ATP 酶循环链过程中几个关键点,从而阻止 ATP 水解[60]。因此,抑制 Hsp90-Cdc37 之间的结合也为其他抑制机制提供一个协同途径。
南蛇藤素(图 8)是从植物中提取的五环三萜类化合物[61],它可以激活热休克因子 HSF-1 导致热休克蛋白的表达(IC50= 0.3 μmol/L),具有抗增殖和神经保护的作用[62]。有研究表明,南蛇藤素通过共价结合 Cdc37 上的半胱氨酸残基,从而阻止 Hsp90 及其协同分子 Cdc37 相互作用,进而导致客户蛋白的选择性降解,同时还可以防止胰蛋白酶对 C 末端区域的蛋白水解降解[63]。
类固醇内酯醉茄素 A(图 8)具有抗增殖和抗肿瘤血管生成活性,在细胞水平上可以导致 Akt、CDK4 以及 GR 等客户蛋白呈剂量依赖性降解。在免疫共沉淀实验中该化合物显示出阻断 Hsp90 与 Cdc37 的相互作用(IC50= 1.24 μmol/L),由 Grover 等[64]进行的两项分子对接研究提供了醉茄素 A在 Hsp90-Cdc37 界面可能的作用机制。
4.2 Hsp90-p23 相互作用抑制剂
小酸性蛋白 p23 通过 N 末端结构域和中间域与 Hsp90 相互作用,对于稳定类固醇激素受体是必需的[65]。葛杜宁(图 8)是从印度楝树中分离得到的三萜类化合物,在传统印度医学中已经用于抗疟疾和其他传染病。此外葛杜宁显示出对包括前列腺癌、结肠癌和卵巢癌在内的各种癌细胞系的抗增殖活性,同时可以导致 Hsp90 客户蛋白 Raf 和 HER2 降解(IC50= 8.84 μmol/L)[66]。在分子对接以及基因突变分析实验中,该化合物与 p23 结合阻断了 Hsp90 与其客户蛋白结合并干扰小蛋白 p23 的基因调控[67]。
4.3 Hsp90-HOP 相互作用抑制剂
Hsp90 C 末端结构域的末尾包含一段高度保守的MEEVD 序列,该序列与 TRP 结构域形成关键的相互作用[68]。TRP 结构域存在于各种 Hsp90 共聚物中,其中之一就是 Hsp70/Hsp90 组织蛋白(HOP)[69]。
Sansalvamide A(San A)(图 8)是从镰刀菌属海洋真菌中分离出的一种含有内酯部分的环状五肽,具有中等的抗肿瘤活性(IC50= 45 μmol/L)[70]。随后合成了 San A 的衍生物 San A-酰胺(图 8)[71],发现其活性是天然产物的10 倍左右(IC50= 4.5 μmol/L)。在进行机制研究时发现其对 Hsp90 ATP 酶的活性没有影响,破坏了 Hsp90 与 HOP 之间的相互作用。在过去的数十年中,开发了许多 San A-酰胺类似物,它们对包括胰腺癌、乳腺癌、前列腺癌和结肠癌在内的多种癌细胞系都表现出有效的细胞毒性[72]。
Yi 等[73]开发了一种高通量筛选测定法,该方法可以鉴定能够抑制 Hsp90-TRP 相互作用的小分子。他们使用该方法测定了一组嘧啶并三嗪-二酮骨架,其中包括化合物 C9(图 8)[74]。随后验证了体内活性,在治疗人乳腺癌细胞 BT474 以及 SKBR3 时会降低客户蛋白 HER2 的水平并诱导细胞凋亡。使用等温滴定量热法测量可以确定 C9 直接结合到了 TRP 域,C9 通过影响 Hsp90 依赖型蛋白折叠过程直接阻止了 Hsp90 与 HOP 的相互作用,进而对 Hsp90 产生了抑制作用[75]。
5 小结
数十年来,Hsp90 一直受到学术界和制药行业的广泛关注,N 末端抑制剂的开发已经取得重大进展,许多化合物已进行了临床评估。然而这些抑制剂的一些诸如引起热休克反应以及一系列毒性问题也日益凸显。一些 C 末端抑制剂在临床前研究中显示出较好的结果,但是其治疗效果尚未在患者中进行测试。现在随着靶点作用机制更加清晰、计算模拟方法指导配体优化更加成熟以及寻求抑制 Hsp90 新途径的开发,相信未来可以研发出用于临床应用的新型 Hsp90 抑制剂。
[1] Maloney A, Workman P. HSP90 as a new therapeutic target for cancer therapy: the story unfolds. Expert Opin Biol Ther, 2002, 2(1):3-24.
[2] Jolly C, Morimoto RI. Role of the heat shock response and molecular chaperones in oncogenesis and cell death. J Natl Cancer Inst, 2000, 92(19):1564-1572.
[3] Blagg BSJ, Kerr TD. Hsp90 inhibitors: small molecules that transform the Hsp90 protein folding machinery into a catalyst for protein degradation. Med Res Rev, 2006, 26(3):310-338.
[4] Harris SF, Shiau AK, Agard DA. The crystal structure of the carboxy-terminal dimerization domain of htpG, the Escherichia coli Hsp90, reveals a potential substrate binding site. Structure, 2004, 12(6):1087-1097.
[5] Jahn M, Rehn A, Pelz B, et al. The charged linker of the molecular chaperone Hsp90 modulates domain contacts and biological function. Proc Natl Acad Sci U S A, 2014, 111(50):17881-17886.
[6] Prodromou C, Roe SM, O'Brien R, et al. Identification and structural characterization of the ATP/ADP-binding site in the Hsp90 molecular chaperone. Cell, 1997, 90(1):65-75.
[7] Dutta R, Inouye M. GHKL, an emergent ATPase/kinase superfamily. Trends Biochem Sci, 2000, 25(1):24-28.
[8] Prodromou C, Roe SM, Piper PW, et al. A molecular clamp in the crystal structure of the N-terminal domain of the yeast Hsp90 chaperone. Nat Struct Biol, 1997, 4(6):477-482.
[9] Schmid AB, Lagleder S, Gräwert MA, et al. The architecture of functional modules in the Hsp90 co-chaperone Sti1/Hop. EMBO J, 2012, 31(6):1506-1517.
[10] Whitesell L, Mimnaugh EG, De Costa B, et al. Inhibition of heat shock protein HSP90-pp60v-src heteroprotein complex formation by benzoquinone ansamycins: essential role for stress proteins in oncogenic transformation. Proc Natl Acad Sci U S A, 1994, 91(18): 8324-8328.
[11] Stebbins CE, Russo AA, Schneider C, et al. Crystal structure of an Hsp90-geldanamycin complex: targeting of a protein chaperone by an antitumor agent. Cell, 1997, 89(2):239-250.
[12] Roe SM, Prodromou C, O'Brien R, et al. Structural basis for inhibition of the Hsp90 molecular chaperone by the antitumor antibiotics radicicol and geldanamycin. J Med Chem, 1999, 42(2):260-266.
[13] Schulte TW, Neckers LM. The benzoquinone ansamycin 17-allylamino-17-demethoxygeldanamycin binds to HSP90 and shares important biologic activities with geldanamycin. Cancer Chemother Pharmacol, 1998, 42(4):273-279.
[14] Chen F, Xie H, Bao H, et al. Combination of HSP90 and autophagy inhibitors promotes hepatocellular carcinoma apoptosis following incomplete thermal ablation. Mol Med Rep, 2020, 22(1):337-343.
[15] Hollingshead M, Alley M, Burger AM, et al. In vivo antitumor efficacy of 17-DMAG (17-dimethylaminoethylamino-17-demethoxygeldanamycin hydrochloride), a water-soluble geldanamycin derivative. Cancer Chemother Pharmacol, 2005, 56(2):115-125.
[16] Pacey S, Wilson RH, Walton M, et al. A phase I study of the heat shock protein 90 inhibitor alvespimycin (17-DMAG) given intravenously to patients with advanced solid tumors. Clin Cancer Res, 2011, 17(6):1561-1570.
[17] Tian ZQ, Liu Y, Zhang D, et al. Synthesis and biological activities of novel 17-aminogeldanamycin derivatives. Bioorg Med Chem, 2004, 12(20):5317-5329.
[18] Floris G, Sciot R, Wozniak A, et al. The novel HSP90 inhibitor, IPI-493, is highly effective in human gastrostrointestinal stromal tumor xenografts carrying heterogeneous KIT mutations. Clin Cancer Res, 2011, 17(17):5604-5614.
[19] Sydor JR, Normant E, Pien CS, et al. Development of 17-allylamino- 17-demethoxygeldanamycin hydroquinone hydrochloride (IPI-504), an anti-cancer agent directed against Hsp90. Proc Natl Acad Sci U S A, 2006, 103(46):17408-17413.
[20] Delmotte P, Delmotte-Plaque J. A new antifungal substance of fungal origin. Nature, 1953, 171(4347):344.
[21] Brough PA, Aherne W, Barril X, et al. 4,5-diarylisoxazole Hsp90 chaperone inhibitors: potential therapeutic agents for the treatment of cancer. J Med Chem, 2008, 51(2):196-218.
[22] Mohammadian M, Feizollahzadeh S, Mahmoudi R, et al. Hsp90 inhibitor; NVP-AUY922 in combination with doxorubicin induces apoptosis and downregulates VEGF in MCF-7 breast cancer cell line. Asian Pac J Cancer Prev, 2020, 21(6):1773-1778.
[23] Woodhead AJ, Angove H, Carr MG, et al. Discovery of (2,4-dihydroxy-5-isopropylphenyl)-[5-(4-methylpiperazin-1-ylmethyl)-1,3-dihydrois oindol-2-yl]methanone (AT13387), a novel inhibitor of the molecular chaperone Hsp90 by fragment based drug design. J Med Chem, 2010, 53(16):5956-5969.
[24] Ying W, Du Z, Sun L, et al. Ganetespib, a unique triazolone-containing Hsp90 inhibitor, exhibits potent antitumor activity and a superior safety profile for cancer therapy. Mol Cancer Ther, 2012, 11(2):475- 484.
[25] Jhaveri K, Wang R, Teplinsky E, et al. A phase I trial of ganetespib in combination with paclitaxel and trastuzumab in patients with human epidermal growth factor receptor-2 (HER2)-positive metastatic breast cancer. Breast Cancer Res, 2017, 19(1):89-97.
[26] Chiosis G, Timaul MN, Lucas B, et al. A small molecule designed to bind to the adenine nucleotide pocket of Hsp90 causes Her2 degradation and the growth arrest and differentiation of breast cancer cells. Chem Biol, 2001, 8(3):289-299.
[27] Taldone T, Chiosis G. Purine-scaffold Hsp90 inhibitors. Curr Top Med Chem, 2009, 9(15):1436-1446.
[28] Caldas-Lopes E, Cerchietti L, Ahn JH, et al. Hsp90 inhibitor PU-H71, a multimodal inhibitor of malignancy, induces complete responses in triple-negative breast cancer models. Proc Natl Acad Sci U S A, 2009, 106(20):8368-8373.
[29] Lundgren K, Zhang H, Brekken J, et al. BIIB021, an orally available, fully synthetic small-molecule inhibitor of the heat shock protein Hsp90. Mol Cancer Ther, 2009, 8(4):921-929.
[30] Kasibhatla SR, Hong K, Biamonte MA, et al. Rationally designed high-affinity 2-amino-6-halopurine heat shock protein 90 inhibitors that exhibit potent antitumor activity. J Med Chem, 2007, 50(12): 2767-2778.
[31] Lundgren K, Biamonte MA. The discovery of BIIB021 and BIIB028. //Machajewski TD, Gao Z. Inhibitors of molecular chaperones as therapeutic agents. RSC Publishing, 2013:158-179.
[32] Hong D, Said R, Falchook G, et al. Phase I study of BIIB028, a selective heat shock protein 90 inhibitor, in patients with refractory metastatic or locally advanced solid tumors. Clin Cancer Res, 2013, 19(17):4824-4831.
[33] Kim SH, Tangallapally R, Kim IC, et al. Discovery of an L-alanine ester prodrug of the Hsp90 inhibitor, MPC-3100. Bioorg Med Chem Lett, 2015, 25(22):5254-5257.
[34] Bao R, Lai CJ, Qu H, et al. CUDC-305, a novel synthetic HSP90 inhibitor with unique pharmacologic properties for cancer therapy. Clin Cancer Res, 2009, 15(12):4046-4057.
[35] Stenderup K, Rosada C, Gavillet B, et al. Debio 0932, a new oral Hsp90 inhibitor, alleviates psoriasis in a xenograft transplantation model. Acta Derm Venereol, 2014, 94(6):672-676.
[36] Rajan A, Kelly RJ, Trepel JB, et al. A phase i study of PF-04929113 (SNX-5422), an orally bioavailable heat shock protein 90 inhibitor, in patients with refractory solid tumor malignancies and lymphomas. Clin Cancer Res, 2011, 17(21):6831-6839.
[37] Ohkubo S, Kodama Y, Muraoka H, et al. TAS-116, a highly selective inhibitor of heat shock protein 90α and β, demonstrates potent antitumor activity and minimal ocular toxicity in preclinical models. Mol Cancer Ther, 2015, 14(1):14-22.
[38] Doi T, Kurokawa Y, Sawaki A, et al. Efficacy and safety of TAS-116, an oral inhibitor of heat shock protein 90, in patients with metastatic or unresectable gastrointestinal stromal tumour refractory to imatinib, sunitinib and regorafenib: a phase II, single-arm trial. Eur J Cancer, 2019, 121:29-39.
[39] Bussenius J, Blazey CM, Aay N, et al. Discovery of XL888: A novel tropane-derived small molecule inhibitor of HSP90. Bioorg Med Chem Lett, 2012, 22(17):5396-5404.
[40] Spreafico A, Delord JP, De Mattos-Arruda L, et al. A first-in-human phase I, dose-escalation, multicentre study of HSP990 administered orally in adult patients with advanced solid malignancies. Br J Cancer, 2015, 112(4):650-659.
[41] Marcu MG, Chadli A, Bouhouche I, et al. The heat shock protein 90 antagonist novobiocin interacts with a previously unrecognized ATP-binding domain in the carboxyl terminus of the chaperone. J Biol Chem, 2000, 275(47):37181-37186.
[42] Marcu MG, Schulte TW, Neckers L. Novobiocin and related coumarins and depletion of heat shock protein 90-dependent signaling proteins. J Natl Cancer Inst, 2000, 92(3):242-248.
[43] Yu XM, Shen G, Neckers L, et al. Hsp90 inhibitors identified from a library of novobiocin analogues. J Am Chem Soc, 2005, 127(37): 12778-12779.
[44] Kusuma BR, Zhang L, Sundstrom T, et al. Synthesis and evaluation of novologues as C-terminal Hsp90 inhibitors with cytoprotective activity against sensory neuron glucotoxicity. J Med Chem, 2012, 55(12):5797-5812.
[45] Kada T, Kaneko K, Matsuzaki S, et al. Detection and chemical identification of natural bio-antimutagens. A case of the green tea factor. Mutat Res, 1985, 150(1-2):127-132.
[46] Yin Z, Henry EC, Gasiewicz TA. (-)-Epigallocatechin-3-gallate is a novel Hsp90 inhibitor. Biochemistry, 2009, 48(2):336-345.
[47] Khandelwal A, Hall JA, Blagg BSJ. Synthesis and structure-activity relationships of EGCG analogues, a recently identified Hsp90 inhibitor. J Org Chem, 2013, 78(16):7859-7884.
[48] Sgobba M, Degliesposti G, Ferrari AM, et al. Structural models and binding site prediction of the C-terminal domain of human Hsp90: A new target for anticancer drugs. Chem Biol Drug Des, 2008, 71(5): 420-433.
[49] Lee SC, Min HY, Choi H, et al. Synthesis and evaluation of a novel deguelin derivative, L80, which disrupts ATP binding to the C-terminal domain of heat shock protein 90. Mol Pharmacol, 2015, 88(2):245-255.
[50] Zhao H, Brandt GE, Galam L, et al. Identification and initial SAR of silybin: an Hsp90 inhibitor. Bioorg Med Chem Lett, 2011, 21(9): 2659-2664.
[51] Zhao H, Yan B, Peterson LB, et al. 3-Arylcoumarin derivatives manifest anti-proliferative activity through Hsp90 inhibition. ACS Med Chem Lett, 2012, 3(4):327-331.
[52] Hastings JM, Hadden MK, Blagg BSJ. Synthesis and evaluation of derrubone and select analogues. J Org Chem, 2008, 73(2):369-373.
[53] Hadden MK, Galam L, Gestwicki JE, et al. Derrubone, an inhibitor of the Hsp90 protein folding machinery. J Nat Prod, 2007, 70(12):2014- 2018.
[54] Mays JR, Hill SA, Moyers JT, et al. The synthesis and evaluation of flavone and isoflavone chimeras of novobiocin and derrubone. Bioorg Med Chem, 2010, 18(1):249-266.
[55] Kasza Á, Hunya Á, Frank Z, et al. Dihydropyridine derivatives modulate heat shock responses and have a neuroprotective effect in a transgenic mouse model of Alzheimer's disease. J Alzheimers Dis, 2016, 53(2):557-571.
[56] Jordan P, Carmo-Fonseca M. Molecular mechanisms involved in cisplatin cytotoxicity. Cell Mol Life Sci, 2000, 57(8-9):1229-1235.
[57] Kvardova V, Hrstka R, Walerych D, et al. The new platinum (IV) derivative LA-12 shows stronger inhibitory effect on Hsp90 function compared to cisplatin. Mol Cancer, 2010, 9:147.
[58] Donnelly A, Blagg BSJ. Novobiocin and additional inhibitors of the Hsp90 C-terminal nucleotide-binding pocket. Curr Med Chem, 2008, 15(26):2702-2717.
[59] Taipale M, Krykbaeva I, Koeva M, et al. Quantitative analysis of HSP90-client interactions reveals principles of substrate recognition. Cell, 2012, 150(5):987-1001.
[60] Roe SM, Ali MMU, Meyer P, et al. The mechanism of Hsp90 regulation by the protein kinase-specific cochaperone p50cdc37. Cell, 2004, 116(1):87-98.
[61] Westerheide SD, Bosman JD, Mbadugha BNA, et al. Celastrols as inducers of the heat shock response and cytoprotection. J Biol Chem, 2004, 279(53):56053-56060.
[62] Hieronymus H, Lamb J, Ross KN, et al. Gene expression signature-based chemical genomic prediction identifies a novel class of HSP90 pathway modulators. Cancer Cell, 2006, 10(4):321-330.
[63] Zhang T, Li Y, Yu Y, et al. Characterization of celastrol to inhibit hsp90 and cdc37 interaction. J Biol Chem, 2009, 284(51):35381- 35389.
[64] Grover A, Shandilya A, Agrawal V, et al. Hsp90/Cdc37 chaperone/co-chaperone complex, a novel junction anticancer target elucidated by the mode of action of herbal drug Withaferin A. BMC Bioinformatics, 2011, 12 Suppl 1(Suppl 1):S30.
[65] Ali MMU, Roe SM, Vaughan CK, et al. Crystal structure of an Hsp90-nucleotide-p23/Sba1 closed chaperone complex. Nature, 2006, 440(7087):1013-1017.
[66] Brandt GE, Schmidt MD, Prisinzano TE, et al. Gedunin, a novel hsp90 inhibitor: semisynthesis of derivatives and preliminary structure-activity relationships. J Med Chem, 2008, 51(20):6495-6502.
[67] Patwardhan CA, Fauq A, Peterson LB, et al. Gedunin inactivates the co-chaperone p23 protein causing cancer cell death by apoptosis.J Biol Chem, 2013, 288(10):7313-7325.
[68] Horibe T, Kohno M, Haramoto M, et al. Designed hybrid TPR peptide targeting Hsp90 as a novel anticancer agent. J Transl Med, 2011, 9:8.
[69] Ciglia E, Vergin J, Reimann S, et al. Resolving hot spots in the C-terminal dimerization domain that determine the stability of the molecular chaperone Hsp90. PLoS One, 2014, 9(4):e96031.
[70] Carroll CL, Johnston JVC, Kekec A, et al. Synthesis and cytotoxicity of novel sansalvamide A derivatives. Org Lett, 2005, 7(16):3481- 3484.
[71] Alexander LD, Partridge JR, Agard DA, et al. A small molecule that preferentially binds the closed conformation of Hsp90. Bioorg Med Chem Lett, 2011, 21(23):7068-7071.
[72] Kunicki JB, Petersen MN, Alexander LD, et al. Synthesis and evaluation of biotinylated sansalvamide A analogs and their modulation of Hsp90. Bioorg Med Chem Lett, 2011, 21(16):4716- 4719.
[73] Yi F, Zhu P, Southall N, et al. An alpha screen-based high-throughput screen to identify inhibitors of Hsp90-cochaperone interaction. J Biomol Screen, 2009, 14(3):273-281.
[74] Yi F, Regan L. A novel class of small molecule inhibitors of Hsp90. ACS Chem Biol, 2008, 3(10):645-654.
[75] Pimienta G, Herbert KM, Regan L. A compound that inhibits the HOP-Hsp90 complex formation and has unique killing effects in breast cancer cell lines. Mol Pharm, 2011, 8(6):2252-2261.
国家自然科学基金(21675010)
阎爱侠,Email:yanax@mail.buct.edu.cn
2020-09-01
10.3969/j.issn.1673-713X.2021.01.008
