DIS3通过调控PI3K/AKT/mTOR信号通路促进人骨髓瘤细胞凋亡
2021-02-10王兰兰
王兰兰,张 婷,周 英,关 军,程 平,邹 亮
(武汉市第一医院血液内科,武汉 430022;*通讯作者,E-mail:zouliang0127@163.com)
多发性骨髓瘤(multiple myeloma,MM)是一种以骨痛与病理性骨折、贫血、复发性感染、高钙血症、肾衰竭和异常出血为常见临床表现的恶性肿瘤[1],其特征是单克隆浆细胞在骨髓中不受控制地增殖[2]。凋亡是一种程序化细胞死亡,许多针对血液系统恶性肿瘤凋亡的药物显示出较好的治疗效果[3]。因此,抑制骨髓瘤细胞过度增殖,促进凋亡是一个重要方向。DIS3基因突变被认为是MM发病原因之一[4],但其具体作用机制目前还不清楚。PI3K/AKT/mTOR信号转导通路调节各种生物过程,在细胞增殖、转移和凋亡等过程中发挥重要作用,阻断PI3K/AKT/mTOR通路已成为多种癌细胞治疗新的靶点[5]。研究显示,PI3K/AKT/mTOR与MM之间关系密切[6,7],因此,我们推测DIS3可能是通过调控PI3K/AKT/mTOR信号通路来发挥其作用。在本实验中,我们通过过表达及干扰骨髓瘤细胞中DIS3基因,研究由此所致的细胞凋亡及其潜在作用机制,为临床治疗MM提供些许思路。
1 材料与方法
1.1 主要材料
人骨髓瘤细胞株NCI-H929、RPMI 8226和U266购自美国模式菌种收集中心(ATCC)。RPMI-1640细胞培养基、胎牛血清及Lipofectamine 2000购于美国Invitrogen公司;真核表达载体PEGFP-N1购自美国Addgen公司;Annexin Ⅴ-FITC/PI凋亡检测试剂盒购自美国BD Biosciences公司;Bax、Bcl-2、Caspase-3、PI3K、AKT、mTOR、GAPDH以及山羊抗兔二抗IgG购自美国Abcam公司。
1.2 细胞的复苏、培养及转染
将人骨髓瘤细胞株NCI-H929、RPMI 8226和U266分别培养于RPMI-1640培养基中(含10% FBS,1%青链霉素溶液),置于37 ℃恒温培养箱中(5% CO2)进行培养。将PEGFP-N1-DIS3及DIS3-siRNA根据Lipofectamine 2000转染说明书对NCI-H929、RPMI 8226和U266细胞进行转染,转染8 h后更换培养基继续培养。
1.3 流式细胞术检测细胞凋亡
将3种细胞均按照以下模式分成5组:对照组(control)、DIS3-siRNA阴性对照(negative control, NC)组、DIS3空载组、DIS3过表达组、DIS3-siRNA组。将转染后48 h的各组细胞按104个/孔的浓度进行接种,每孔加100 μl细胞培养液,置恒温培养箱中培养。48 h后收集各组细胞,消化重悬后,4 ℃下1 000g,离心5 min,弃上清;加入1 ml预冷PBS后,1 000g,4 ℃离心5 min,然后分别加入Annexin Ⅴ-FITC和PI各10 μl,轻轻混匀,室温下避光孵育30 min后加入300 μl binding buffer,上机检测;使用CYEXPERT分析软件对所获数据进行分析。
1.4 RT-qPCR检测凋亡相关基因Bax、Bcl-2和Caspase-3及PI3K/AKT/mTOR信号通路相关基因mRNA的表达水平
48 h后收集各组细胞,分别提取各组细胞样本RNA,反转录成cDNA。采用20 μl PCR反应体系扩增:上、下游引物各0.5 μl,SYBR Green Mix 10 μl,cDNA模板1 μl,ddH2O 8 μl。引物序列见表1。PCR反应程序:95 ℃ 3 min;95 ℃ 5 s、56 ℃ 10 s、72 ℃ 25 s,39个循环;65 ℃ 5 s、95 ℃ 50 s。以GAPDH为内参基因,采用2-ΔΔCt法进行统计分析。

表1 凋亡相关基因和PI3K/AKT/mTOR信号通路相关基因的引物序列Table 1 Primer sequences of apoptosis-related genes and PI3K/AKT/mTOR signaling pathway-related genes
1.5 Western bolt检测凋亡相关蛋白Bax、Bcl-2和Caspase-3及PI3K/AKT/mTOR信号通路相关蛋白表达量
转染48 h后收集各组细胞,室温下充分裂解细胞,离心后取上清,用BCA法对蛋白进行测定。每孔上样20 μg蛋白,经12% SDS-PAGE电泳、分离、转移、封闭后,分别加入兔抗人Bax抗体(1 ∶800),兔抗人Bcl-2抗体(1 ∶1 000),兔抗人Caspase-3抗体(1 ∶500),兔抗人PI3K抗体(1 ∶500),兔抗人AKT抗体(1 ∶500),兔抗人mTOR抗体(1 ∶800)及兔抗人GAPDH抗体(1 ∶1 000)。4 ℃孵育过夜后,加入羊抗兔IgG二抗,室温孵育1 h,用PBST洗涤3次,每次5 min后,加入ECL化学发光剂,然后将膜置于全自动化学发光分析仪中检测。
1.6 统计学分析
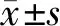
2 结果
2.1 DIS3过表达或干扰对细胞凋亡的影响
与DIS3空载组比较,DIS3过表达组细胞凋亡率明显升高(P<0.01);与DIS3-siRNA NC组比较,DIS3-siRNA组的细胞凋亡率明显降低(P<0.05或P<0.01,见图1)。

与DIS3空载组比较,**P<0.01;与DIS3-siRNA NC组比较,#P<0.05,##P<0.01图1 流式细胞术检测NCI-H929、RPMI 8226和U266细胞凋亡水平Figure 1 Apoptosis of NCI-H929, RPMI 8226 and U266 cells detected by flow cytometry

与DIS3空载组比较,**P<0.01;与DIS3-siRNA NC组比较,#P<0.05,##P<0.01图1 流式细胞术检测NCI-H929、RPMI 8226和U266细胞凋亡水平Figure 1 Apoptosis of NCI-H929, RPMI 8226 and U266 cells detected by flow cytometry
2.2 DIS3过表达或干扰对凋亡相关基因Bax、Bcl-2、Caspase-3表达水平的影响
与DIS3空载组相比,DIS3过表达组NCI-H929、RPMI 8226和U266细胞Bax和Caspase-3 mRNA表达量显著上调(P<0.01),Bcl-2 mRNA表达量显著下调(P<0.05或P<0.01);与DIS3-siRNA NC组比较,DIS3-siRNA组3种细胞Bax和Caspase-3 mRNA表达量显著下调(P<0.01),而Bcl-2 mRNA表达量显著上调(P<0.01,见图2)。
2.3 DIS3过表达或干扰对凋亡相关蛋白Bax、Bcl-2、Caspase-3表达的影响
与DIS3空载组比较,DIS3过表达组3种细胞Bax和Caspase-3蛋白相对表达量显著升高(P<0.05),Bcl-2蛋白相对表达量显著降低(P<0.05或P<0.01);与DIS3-siRNA NC组比较,DIS3-siRNA组细胞Bax和Caspase-3蛋白相对表达量显著降低(P<0.05),Bcl-2蛋白相对表达量显著升高(P<0.05,见图3)。

与DIS3空载组比较,*P<0.05,**P<0.01;与DIS3-siRNA NC组比较,##P<0.01图2 细胞凋亡相关指标Bax、Bcl-2、Caspase-3 mRNA水平的表达变化Figure 2 The mRNA levels of apoptosis-related indicators Bax, Bcl-2 and Caspase-3
与DIS3空载组比较,*P<0.05,**P<0.01;与DIS3-siRNA NC组比较,#P<0.01图3 细胞凋亡相关蛋白Bax、Bcl-2、Caspase-3表达量变化Figure 3 Changes in the expression of apoptotic proteins Bax, Bcl-2 and Caspase-3
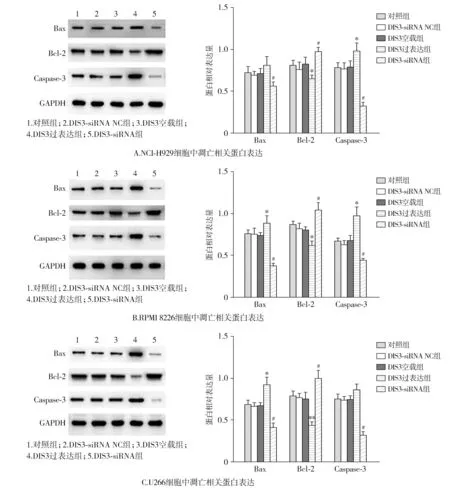
2.4 DIS3过表达或干扰对PI3K、AKT、mTOR基因表达水平的影响
与DIS3空载组比较,DIS3过表达组3种细胞PI3K、AKT、mTOR mRNA相对表达量显著上调(P<0.05或P<0.01);与DIS3-siRNA NC组比较,DIS3-siRNA组细胞PI3K、AKT、mTOR mRNA相对表达量显著下调(P<0.01,见图4)。
与DIS3空载组比较,*P<0.05,**P<0.01;与DIS3-siRNA NC组比较,##P<0.01图4 各组细胞PI3K、AKT、mTOR基因mRNA水平表达Figure 4 The mRNA level expression of PI3K, AKT, mTOR in three kinds of cells in each group
2.5 DIS3过表达或干扰对PI3K、AKT、mTOR蛋白表达的影响
与DIS3空载组比较,DIS3过表达组3种细胞PI3K、AKT、mTOR蛋白相对表达量显著升高(P<0.05或P<0.01);与DIS3-siRNA NC组比较,DIS3-siRNA组细胞PI3K、AKT、mTOR蛋白相对表达量显著降低(P<0.01,见图5)。
3 讨论
本课题组前期研究结果显示,DIS3过表达组及DIS3干扰组转染效果良好,其中DIS3-siRNA2对DIS3的沉默效果最佳[8],因此选用DIS3-siRNA2用于后续DIS3-siRNA组。本课题组前期研究结果显示[9],DIS3能使人骨髓瘤细胞阻滞在G0/G1期,且可降低肿瘤相关蛋白的表达。但其对骨髓瘤细胞表现出的恶性生物学特征的机制还有待进一步研究。王欣等[10]研究结果显示,MTH1抑制剂能明显抑制MM细胞增殖和诱导细胞凋亡,可有效治疗MM。提示抑制MM细胞增殖及促进MM细胞凋亡对于治疗MM具有重要意义。本研究结果显示,DIS3过表达能显著促进3种人骨髓瘤细胞的凋亡水平,表现为显著增加的细胞总凋亡率、促凋亡蛋白Bax、Caspase-3的表达升高以及抗凋亡蛋白Bcl-2的表达降低;反之,通过siRNA技术抑制DIS3的表达则从一定程度上抑制了癌细胞的凋亡进程,表现为细胞总凋亡率降低、促凋亡蛋白Bax、Caspase-3的表达下降以及抗凋亡蛋白Bcl-2的表达升高;提示对DIS3进行表达调控能显著影响骨髓瘤细胞的凋亡进程,其中过表达DIS3能对骨髓瘤细胞起到显著的促凋亡作用。
PI3K/AKT/mTOR是一种重要的信号通路,其可以精确调控细胞内外的信号进而调节细胞代谢、增殖和生存[11],其过度活化能够抑制细胞凋亡,增强细胞对低氧和营养缺乏的耐受能力[12,13]。因此,PI3K/AKT/mTOR也成为多种肿瘤药物的潜在作用靶点。研究表明,研究表明,在MM细胞中,敲低类固醇5α-还原酶I型基因表达通过PI3K/AKT/mTOR信号通路抑制了细胞凋亡和自噬的发生,提示MM细胞的恶性生物学特征的改变在一定程度上依赖于PI3K/AKT/mTOR信号通路的活化[14]。在本研究中,我们也检测了PI3K/AKT/mTOR信号通路相关基因在mRNA及蛋白水平上的表达,结果显示,DIS3过表达能显著促进PI3K、AKT、mTOR mRNA和蛋白表达量,而干扰DIS3表达能显著抑制PI3K、AKT、mTOR mRNA和蛋白表达量,提示DIS3的表达调控对骨髓瘤细胞凋亡进程的影响可能是通过调控PI3K/AKT/mTOR信号通路来实现的。

与DIS3空载组比较,**P<0.01;与DIS3-siRNA NC组比较,#P<0.05,##P<0.01图5 各组细胞PI3K、AKT、mTOR蛋白水平表达变化Figure 5 Protein expression of PI3K, AKT, mTOR in each group
综上所述,DIS3过表达能显著促进骨髓瘤细胞凋亡,促进促凋亡基因Bax、Caspase-3的表达水平并抑制抗凋亡蛋白Bcl-2的表达,其机制可能与激活PI3K/AKT/mTOR途径的活性有关。本实验在前期研究的基础上,进一步深入研究了DIS3对MM细胞凋亡的影响及其潜在的作用机制,这为靶向治疗MM的研究提供了一定的理论基础。
