PCT/ALB比值在脓毒症诊断与预后中的临床价值
2021-02-10侯晨涛成亚东
王 芳,侯晨涛,杨 晶,成亚东
(长治市人民医院重症医学科,长治 046000;*通讯作者,E-mail:maxub@163.com)
脓毒症是指由宿主对病原体感染失控引起的多器官功能障碍,其机制与病原体的构成、细菌载量[1]、内毒素移位[2]、炎性因子分泌失控[3]、免疫功能紊乱[4]、营养状况、凝血异常、维生素D缺乏等因素有关。尽管目前脓毒症的诊治已有所改善[5],但严重脓毒症病死率为25%-30%,脓毒性休克高达40%-50%[6]。目前研究多围绕在血清降钙素原(procalcitonin,PCT)对于脓毒症的诊断价值、严重程度的权重、预后的判断、抗感染疗程以及转出ICU指征等方面[7-9]。临床上发现脓毒症患者白蛋白下降,血清白蛋白[10](albumin,ALB)是肝细胞内合成的急性时相反应蛋白,脓毒症患者炎症相关因子在急性时相反应中引起ALB下降[11],学者Vavrova等[12]发现血清白蛋白水平与脓毒症患者炎症反应的严重程度密切相关,目前有关脓毒症与白蛋白及PCT的相关性研究较少,本研究旨在探讨血清ALB以及PCT/ALB比值在脓毒症患者诊断、不同感染部位来源的脓毒症分型以及预测28 d死亡的临床价值,从而为临床实践提供参考。
1 研究对象与方法
1.1 研究对象
收集我院2018年9月至2020年9月重症医学科收治的患者临床资料,参照2016年SCCM与ESICM国际脓毒症诊治指南Sepsis 3.0[12],对于感染或疑似感染的患者,当SOFA评分较基线上升≥2分可诊断为脓毒症;在脓毒症的基础上,出现持续性低血压,在充分容量复苏后仍需血管活性药来维持平均动脉压(mean arterial pressure, MAP)≥65 mmHg以及血乳酸浓度>2 mmol/L为脓毒性休克;筛选并确定脓毒症和脓毒症休克患者。病例入选标准:年龄≥18岁的脓毒症及脓毒症休克患者,且住重症监护室大于72 h。病例排除标准:发病前合并心功能不全、呼吸功能障碍、肝肾及凝血功能障碍及意识障碍的患者。该研究经过我院医学伦理委员会批准,所有患者签署治疗知情同意书。共纳入101例脓毒症患者。
1.2 分组
入组101例患者,按病情严重程度分为脓毒症组和脓毒症休克组;按感染部位分为肺部来源脓毒症组、腹部感染来源(包括胆道、胃肠、泌尿系及腹膜后)脓毒症组、血流来源脓毒症组(血管内导管、血管内植入物)及其他感染组;临床结局以入住ICU 28 d死亡为界限分为生存组和死亡组。
1.3 观察指标
观察入选患者的性别、年龄、入ICU 3 d内的血清PCT最高值、ALB最低值、血气分析以及白细胞最低值等生化指标,计算急性生理功能和慢性健康状况系统Ⅱ(acute physiology and chronic health eva-luation Ⅱ, APACHE Ⅱ)评分、感染相关性器官功能衰竭评分(sepsis related organ failure assessment, SOFA)评分、PCT/ALB比值最高分。比较脓毒症组和脓毒症休克组的差异,筛选出脓毒血症休克可能的高危因素;比较ALB及PCT/ALB比值在腹部来源脓毒症、肺部感染来源脓毒症、血流来源等组的差异;比较ALB及PCT/ALB比值在生存组和死亡组的差异。
1.4 统计学方法

2 结果
2.1 一般情况比较
入组脓毒症患者101例,脓毒症组61例(60.4%),脓毒症休克40例(39.6%);肺部感染来源41例(40.6%),腹部感染来源38例(37.6%),血性来源8例(7.9%),其他感染14例(13.9%);入院28 d死亡组21例(20.8%),生存组80例(79.2%)。脓毒症休克组与脓毒症组比较患者年龄、血清PCT、PCT/ALB、白细胞、中性粒细胞百分比(NE%)、APACHEⅡ评分、SOFA评分升高;血清ALB减少;腹部感染来源、血性感染来源的比例较肺部感染来源的比例升高;以上差异均有统计学意义(P<0.05,见表1)。

表1 脓毒症休克组及脓毒症组的一般资料比较Table 1 Comparison of general information between sepsis shock group and sepsis group
2.2 血清ALB、PCT/ALB与APACHEⅡ评分、SOFA评分的相关性
采用Pearson相关分析方法,血清ALB水平与APACHEⅡ评分(r=-0.678,P=0.000)和SOFA评分(r=-0.718,P=0.000)均呈负相关;PCT/ALB与APACHEⅡ评分(r=0.898,P=0.000)和SOFA评分(r=0.918 8,P=0.000)均呈正相关。
2.3 多因素logistic回归分析脓毒症休克可能的独立的高危预警因素
取表1单因素分析得到的高危因素行多因素logistic回归分析,结果显示PCT/ALB、PCT、APACHEⅡ评分、SOFA评分为脓毒症休克的独立高危因素(P<0.05或P<0.01);血清ALB在界定脓毒症与脓毒症休克方面差异无统计学意义(P>0.05,见表2)。

表2 多因素logistic回归分析脓毒症休克独立的高危预警因素Table 2 Mulitiple factor regression logistic analysis of independent risk warning factors for sepsis shock
2.4 血清ALB、PCT、PCT/ALB在不同感染来源组的比较
血清ALB、PCT、PCT/ALB在腹部感染来源脓毒症组、肺部感染来源脓毒症组、血行感染来源脓毒症组比较,差异有统计学意义(P<0.05);腹部感染来源组、血行感染来源组血清ALB、PCT、PCT/ALB高于肺部感染来源组,差异有统计学意义(P<0.05);腹部感染来源组与血行感染来源组血清ALB、PCT、PCT/ALB无统计学差异(P>0.05,见表3)。

表3 不同感染来源组的ALB、PCT及PCT/ALB比较Table 3 Comparison of ALB and PCT/ALB between sepsis patients with different infection
2.5 血清ALB、PCT、PCT/ALB在28 d死亡组、生存组的比较
血清ALB、PCT、PCT/ALB在入院28 d死亡组和生存组独立样本t检验差异有统计学意义(P<0.05);且PCT/ALB比值差异有统计学意义(P<0.01,见表4)。

表4 生存组和死亡组的ALB及PCT/ALB比较Table 4 Comparison of ALB and PCT/ALBbetween survival group and dead group
2.6 血清PCT/ALB对脓毒症休克及28 d死亡患者的预测价值
通过绘制PCT/ALB的受试者工作曲线(ROC)评估其对脓毒症休克及28 d死亡患者的预测价值,PCT/ALB预测脓毒症休克ROC曲线下面积(AUC)为0.784(P<0.01),且截断值、灵敏度、特异度分别为0.52,63%,73%(见表5,图1)。PCT/ALB预测脓毒症患者28 d死亡ROC曲线下面积(AUC)为0.802(P<0.01),且截断值、灵敏度、特异度分别为1.50,95%,55%(见表5,图2)。

表5 PCT/ALB比值对脓毒症休克及死亡患者的预测价值Table 5 Predictive value of PCT/ALB for the sepsis shock and 28-day mortality

图1 PCT/ALB比值对脓毒症休克的预测价值Figure 1 Predictive value of PCT/ALB for the sepsis shock
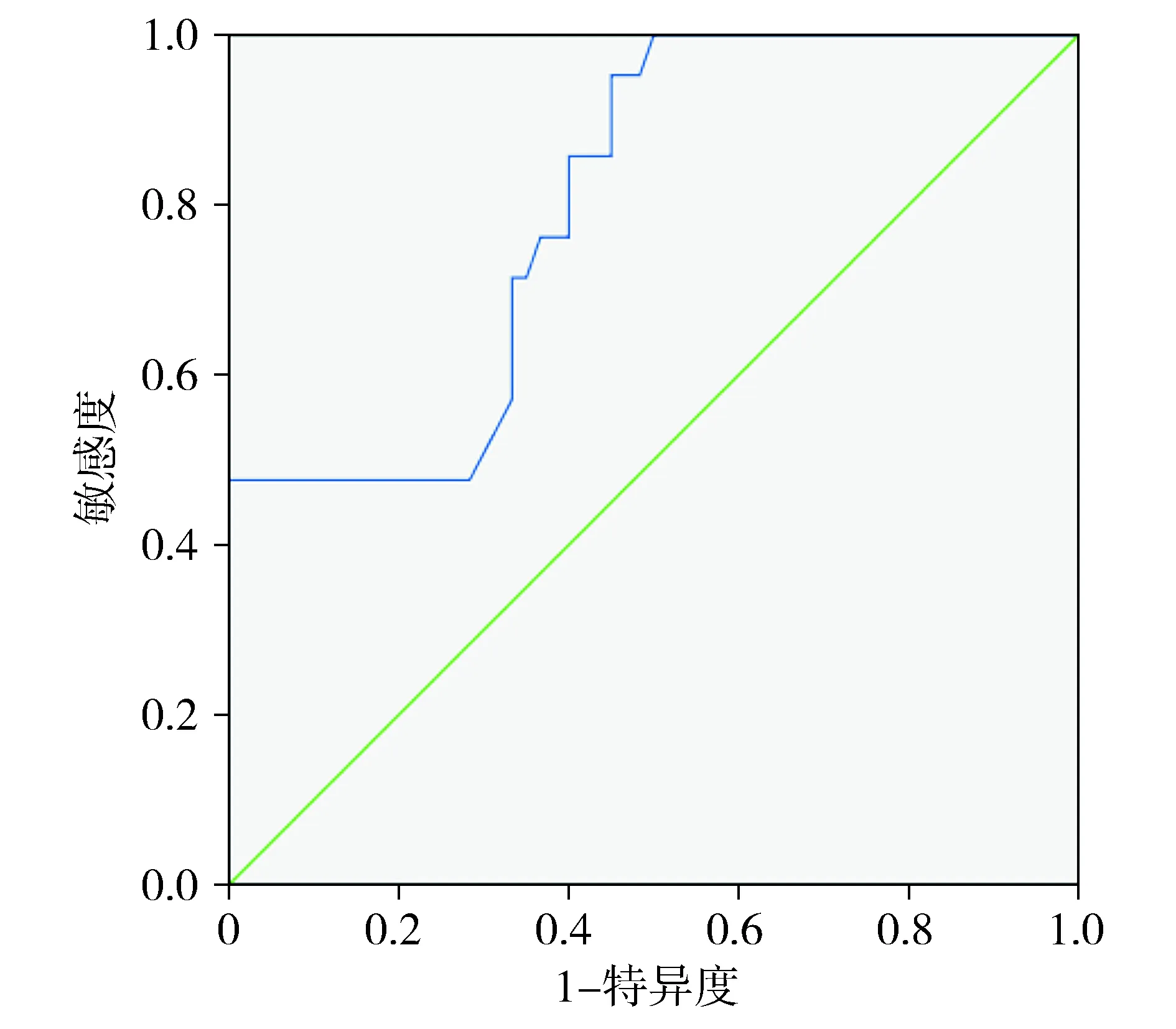
图2 PCT/ALB比值对28 d死亡率的预测价值Figure 2 Predictive value of PCT/ALB for 28-day mortality
3 讨论
降钙素原(PCT)是降钙素的前肽蛋白,生理情况下主要由甲状腺C细胞及肺内的神经内分泌细胞产生[13],在细菌感染、脓毒症、严重创伤刺激下全身各种组织的多种类型细胞都可诱导释放PCT[14],且其升高程度与不同疾病病情严重程度有良好的正相关性,1993年Assicot等[15]初次提出PCT可作为脓毒症相关蛋白。很多研究已经表明血清PCT对脓毒症诊断与预后均具有很好的正相关性[16]。目前白蛋白与脓毒症的相关性深入研究还比较少。
ALB是体内肝脏合成的一类分子量较小的水溶性蛋白质,可以与多种化合物包括水、脂肪酸、胆汁色素、钙离子、抗生素、抗癫痫药物等相结合[17]。即使初始营养状态良好血清白蛋白正常的患者,在严重的感染、创伤及麻醉后,血中白蛋白的水平也会迅速下降。低蛋白血症不仅对器官、组织结构及功能可造成严重损伤,同时反映并发症的状态,白蛋白对多种疾病状态下的器官功能起保护作用。而目前常用的脓毒症危重评分系统中均不包括血清白蛋白(ALB)水平,故应加强注意白蛋白对危重症的预测价值。重症感染时白蛋白明显下降有5个原因:脓毒症患者高分解、代谢亢进,机体代谢和能量底物需求量增加,且白蛋白在代谢途径之中亦可被作为能量底物被利用并提供三磷酸腺苷(ATP),白蛋白消耗增加;脓毒症严重感染致血中炎性细胞因子明显增加,大量释放的炎性细胞因子使毛细血管内皮细胞遭到破坏,全身毛细血管通透性增加,血管内白蛋白漏出血管外,造成血清ALB水平下降;脓毒症患者体内的肿瘤坏死因子(TNF)等炎症介质抑制肝细胞白蛋白mRNA表达所致肝脏合成白蛋白功能减低;淋巴系统功能障碍及淋巴回流下降等所致血浆白蛋白含量减少;优先合成CRP、IL6、TNF等炎症及免疫应急相蛋白。李维勤等[18]用125I标记人体血清白蛋白,观察到感染时ALB从血管内到血管外的分布速率明显增加,其分解速率也显著增加。
本研究发现脓毒症休克组血清白蛋白较脓毒症组降低,差异有统计学意义,脓毒症患者白蛋白越低越提示患者处于休克状态。学者段红杰等[19]同样发现低蛋白血症是危重病患者病情严重程度、并发症发生率以及病死率预测增加的独立危险因素,且低蛋白血症降低程度、持续时间与疾病预后呈正相关。脓毒症的早期识别及治疗过程中应关注血清白蛋白的变化。PCT及ALB水平变化在脓毒症患者中的单一价值已明确,但两者反映脓毒症严重程度的作用及相关性正负不同,PCT/ALB的应用可能更有价值。本研究结果表明脓毒症休克组PCT/ALB比值较脓毒症组明显升高(P<0.01),比PCT与ALB单一指标统计学意义更大。相关性分析发现血清白蛋白与APACHEⅡ评分、SOFA评分呈负相关,PCT/ALB比值与APACHEⅡ评分、SOFA评分呈正相关,且PCT/ALB的相关性比PCT与ALB单一指标相关性更大。表2多因素logistic回归分析结果示PCT/ALB、PCT、APACHEⅡ评分、SOFA评分为脓毒症休克可能的高危预警因素(P<0.05),是早期诊断及预后的重要指标,且PCT/ALB的统计学意义大于PCT、ALB单一指标的意义(P<0.01)。在脓毒症的治疗中应该关注血清白蛋白与降钙素交互变化及联系。
本研究结果发现血清白蛋白、PCT、PCT/ALB在腹部感染来源脓毒症及休克组、肺部感染来源脓毒症及休克组、血行感染来源脓毒症及休克组差异也具有统计学意义,且以腹部感染来源和血行感染炎症反应较重。腹部感染来源脓毒症组常见感染部位为胃肠道、胆囊、泌尿系及腹膜后,腹膜表面积大,且血管丰富,容易吸收腹腔内的各种细菌和毒素进入血液,引起细菌移位,导致多发性腹腔脓肿、腹膜后脓肿或弥漫性腹膜炎等全身性炎症反应;研究[20]证实腹腔内感染(intra-abdominal infection, IAI)的病原菌多为革兰氏阴性杆菌,其感染分泌较多的内毒素,能易引发严重的脓毒症及休克;腹腔内感染能引起患者肠道功能的紊乱,加剧了患者肠黏膜屏障的损害,更促进了炎症反应的进一步发展,在体内形成恶性循环。故腹腔内感染引起的脓毒症在发病机制、病理过程、临床表现、预后转归方面均有其特殊性,是症状较重的一种类型。
血行感染是指病原微生物及毒素侵入血液循环,引起全身炎性反应,并可进一步导致器官衰竭、脓毒性休克和死亡。ICU是医院是治疗和抢救危重患者的场所,随着医疗侵袭性操作的不断增加及广谱抗菌药物、皮质激素等药物的不合理应用,血行感染的发病率及病死率居高不下。血流感染在免疫缺陷、手术治疗、多器官功能障碍、需要机械通气和肾脏替代治疗的患者中较为多见[21]。血管内导管置入后被纤维蛋白鞘包绕于导管表面,当发生CR-BSI时病原菌可在其中繁殖,此外,病原菌可沿导管表面向体内迁移风险,形成感染源,感染源的细菌及毒素可持续入侵血液导致菌血症、全身炎性反应综合征、脓毒症、多器官功能衰竭综合征等并发症[22],同样血行感染引起的脓毒症症状也是症状较重的一种类型。
肺部来源的感染常见菌为及革兰氏阳性球菌及肺炎克雷白杆菌、鲍曼不动杆菌等,炎症反应相对较轻。我国学者王静等[23]发现低血清白蛋白水平组的严重脓毒症患者的重症感染(腹盆腔感染、血流感染)发生率更高。
本研究结果显示,血清白蛋白、PCT、PCT/ALB在28 d生存组和死亡组差异有统计学意义,死亡组患者白蛋白较生存组患者降低,降钙素升高,PCT/ALB更高。且PCT/ALB在预测28 d死亡率方面的统计学意义大于PCT、ALB单一指标的意义(P<0.01)。通过绘制PCT/ALB的受试者工作曲线(ROC)评估其对脓毒症休克及28 d死亡患者的预测价值,结果证实PCT/ALB比值在脓毒症和脓毒症休克的界定以及28 d死亡率具有预警意义。
综上所述,PCT/ALB比值为预测脓毒症休克、感染来源及28 d死亡率的重要指标,诊断脓毒症休克及28 d死亡率比单一指标PCT或ALB具有更大的预警意义,在临床工作中有一定的参考价值。
