奥沙利铂诱导的结肠癌细胞衰老模型的特性
2021-02-10潘鹭翔程柏杨朱茂荣顾锦涛
潘鹭翔,贺 维,程柏杨,2,朱茂荣,2,顾锦涛,张 毅*
(1空军军医大学药学系生物制药学教研室,西安 710032;2空军军医大学基础医学院;*通讯作者,E-mail:zhangyi@fmmu.edu.cn)
奥沙利铂(Oxaliplatin, OXA)是第三代铂类抗癌化合物,以铂原子与DNA形成交叉联结对细胞发挥基因毒性作用[1],以奥沙利铂为基础的联合化疗常规应用于晚期和转移性结直肠癌[2]。然而,晚期结肠癌患者常常因肿瘤复发、转移导致治疗的失败,最新研究表明,基因毒性类化疗药物会对肿瘤细胞造成治疗性衰老(therapy-induced-senescence, TIS)[3],其会表现出衰老细胞的特性,并在肿瘤微环境中发挥其功能[4]。其中包括通过衰老分泌相关表型(senescence-associated secretory phenotype, SASP)引起肿瘤的复发、转移[5];通过衰老逃逸导致肿瘤“死而复生”[6];通过改变肿瘤干细胞特性促进肿瘤发展[7]。为了更全面了解化疗致肿瘤细胞衰老,本文旨在构建奥沙利铂处理后结肠癌细胞衰老模型,全面探索衰老结肠癌细胞的表型与特性,为进一步探索衰老结肠癌细胞在肿瘤微环境及肿瘤发生发展过程中的作用奠定基础。
1 材料与方法
1.1 细胞系和主要试剂
人结肠癌细胞系HCT-116、HT-29为本实验室保存,青霉素链霉素混合液、DMEM高糖培养基及胎牛血清购于美国Gibco公司。培养皿、孔板及共聚焦小皿购于美国CORNING公司。化疗药物奥沙利铂(Oxaliplatin, OXA)购于美国Selleck公司。β-半乳糖苷酶试剂盒购于中国Solarbia公司。抗体p21、β-gal、γ-H2AX、p53、CDK2、p38及p16购于美国Abcam公司,辣根过氧化物酶标记的二抗、荧光二抗及DAB显色液均购自西安壮志生物科技有限公司。EDU检测试剂盒购于上海锐博公司。Trizol试剂购自美国Thermo公司,RNA逆转录试剂盒及荧光定量PCR试剂盒购自日本Takara公司,qRT-PCR引物均由北京擎科生物科技有限公司设计合成。CCK-8试剂盒购自上海陶术生物科技有限公司。其他试剂均为国产分析纯。
1.2 实验方法
1.2.1 细胞给药及β-半乳糖苷酶染色 采用0,2.5,5,10 μmol/L的奥沙利铂(Oxaliplatin, OXA)处理结肠癌细胞,并进行β-半乳糖苷酶染色,并筛选β-半乳糖苷酶表达最高的处理浓度作为衰老模型造模最佳浓度。用含10%的胎牛血清、1%的青链霉素混合液的DMEM培养基(完全培养基)培养结肠癌细胞HCT-116、HT-29于37 ℃、5% CO2培养箱中。使细胞生长至对数期,将两种结肠癌细胞以5×105个/皿分别接种于直径为6 cm的培养皿中,24 h后更换含浓度分别为0,2.5,5,10 μmol/L的OXA完全培养基进行给药处理。药物作用每3 d,更换一次相应药物浓度的完全培养基。在OXA诱导7 d时,进行β-半乳糖苷酶(β-galactosidase, β-gal)染色及形态学观察,测量细胞直径。
β-gal染色:染色前去除培养基,用PBS缓冲液洗涤,每孔加入β-gal染色固定液1 ml,室温下静置固定15 min;去除细胞固定液,用PBS缓冲液洗涤细胞3 min,洗涤3遍;按照β-gal染色试剂盒说明书配置染色工作液,每孔加入1 ml染色工作液,37 ℃孵育过夜;第2天光学显微镜下观察。阳性细胞染色后呈蓝绿色,阴性细胞不被染色;显微镜下各组选取3个视野,计数细胞总数和β-gal染色阳性细胞数,计算阳性细胞数占总细胞数的百分比。
1.2.2 激光共聚焦检测衰老标志物p21、β-gal 将结肠癌细胞HCT-116、HT-29分别分为未处理组(OXA 0 μmol/L)及衰老模型组(OXA 2.5 μmol/L),采用激光共聚焦免疫荧光检测衰老标志物p21、β-gal的表达水平。将细胞以2×105个/孔提前24 h接种于共聚焦小皿中,PBS缓冲液洗涤后用4%多聚甲醛固定15 min,随后用含0.5% Triton的PBS缓冲液以1 ∶250的比例稀释一抗(p21、β-gal)4 ℃孵育过夜,次日PBS缓冲液洗涤3次后,以1 ∶400的稀释比的荧光二抗室温避光孵育1 h,PBS洗涤后加入100 μl即用型DAPI孵育2 min,PBS洗涤3次后用激光共聚焦显微镜观察。

1.2.4 蛋白免疫印迹检测γ-H2AX、p53、p21、CDK2、p38及p16蛋白表达情况 分组同1.2.2,采用Western blot检测未处理组及衰老模型组的DNA损伤相关标志物γ-H2AX、p53及p38、细胞周期相关标志物p21、p16及CDK2的蛋白表达水平。将对照细胞及衰老细胞分别接种于培养皿中,待细胞密度达80%左右时分别收集细胞,使用RIPA裂解液于冰上裂解30 min提取各组总蛋白并进行BCA定量。以β-actin为内参进行十二烷基硫酸钠聚烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE),转膜于甲醇活化后的PVDF膜上,再用5%脱脂牛奶室温封闭1 h,随后用一抗(β-actin稀释比为1 ∶3 000;γ-H2AX、p53、p21、CDK2、p38及p16稀释比均为1 ∶1 000)于4 ℃摇床孵育过夜,用洗膜缓冲液(Tris buffered saline tween, TBST)在室温下摇床上清洗3遍,每遍10 min,然后室温孵育与一抗对应的二抗1 h,TBST清洗3遍,每遍10 min,最后用ECL化学发光仪发光。
1.2.5 qRT-PCR检测衰老细胞相关分泌表型(senescence-associated secretory phenotype, SASP) 分组同1.2.2,通过qRT-PCR检测未处理组及衰老模型组的SASP因子IL-6、IL-8、IL-10、CXCL10、MMP-1及MMP-3。收集对照细胞及衰老细胞,用Trizol提取试剂分别提取总RNA并进行定量。将提取的总RNA用Takara反转录试剂盒反转录为cDNA,反应条件为37 ℃ 15 min,95 ℃ 10 s。按照qPCR试剂盒说明书配置反应体系,反应条件为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40次循环后记录数据,引物序列见表1。以β-actin为内参,使用2-ΔΔCt法分析各个SASP因子的相对表达量。

表1 实时定量PCR引物序列Table 1 Primer sequences for qPCR
1.2.6 CCK-8检测细胞活力 分组同1.2.2,采用CCK-8法检测未处理组及衰老模型组在同一药物浓度中的细胞活力。收集对照细胞及衰老细胞,用细胞计数仪计数后,按5×103个/孔接种至96孔板中,给予不同剂量(0,2.5,5,10,20,40,80 μmol/L)的OXA处理24 h后,按照与培养基10 ∶1配置CCK-8溶液,分别在每孔加入100 μl配置好的CCK-8溶液,于培养箱中孵育90 min后测定吸光度,以0 μmol/L浓度的吸光度作为归一化起点制作吸光度曲线。
1.3 统计学分析

2 结果
2.1 不同剂量奥沙利铂处理后结肠癌细胞形态变化及β-gal染色
β-gal染色结果显示经不同剂量奥沙利铂处理细胞后,细胞β-gal表达呈阳性。OXA 0,2.5,5,10 μmol/L处理后HCT-116细胞β-gal阳性率分别为21.21%±2.60%,83.33%±2.91%,60.33%±2.40%,51.33%±3.28%。OXA 0,2.5,5,10 μmol/L处理后HT-29细胞β-gal阳性率分别为20.67%±2.03%,76.67%±2.60%,61.67%±2.03%,49.00%±4.619%。其中经2.5 μmol/L奥沙利铂处理的HCT-116、HT-29细胞β-gal阳性率最高,与OXA 0 μmol/L组比较,差异有统计学意义(P<0.001,见图1)。
通过高倍镜下观察发现,与未处理细胞比较,2.5 μmol/L奥沙利铂诱导的细胞细胞核明显增大、墨绿色深染、直径增大,出现衰老细胞的表征,其直径差异有统计学意义(P<0.001,见图2)。以上结果表明2.5 μmol/L奥沙利铂导致结肠癌细胞高表达衰老相关β-gal并在形态学上出现衰老细胞表征。因此,我们将2.5μmol/L奥沙利铂处理细胞作为诱导衰老模型,进行后续实验。

墨绿色表示细胞β-gal阳性;与0 μmol/L OXA组相比,***P<0.001图1 不同浓度奥沙利铂处理的HCT-116、HT-29细胞β-gal染色Figure 1 β-gal staining of HCT-116 and HT-29 cells treated with different concentrations of OXA
2.2 奥沙利铂诱导衰老细胞标志物表达鉴定
免疫荧光结果显示,与未处理组(OXA 0 μmol/L)比较,衰老模型组(OXA 2.5 μmol/L)细胞衰老标志物p21、β-gal出现不同程度的高表达,HCT-116、HT-29双阳性细胞比率分别为63.67%±2.03%和78.33%±1.33%,与未处理组相比有显著差异(P<0.001,见图3)。以上结果说明,低剂量奥沙利铂处理的结肠癌细胞高表达衰老标志物p21,并与β-gal在衰老细胞上共定位,进一步说明低剂量奥沙利铂能导致结肠癌细胞衰老。

墨绿色表示细胞β-gal阳性;与0 μmol/L OXA组相比,***P<0.001图2 高倍镜下0 μmol/L与2.5 μmol/L OXA处理后HCT-116和HT-29细胞β-gal染色及其直径比较Figure 2 Comparison of β-Gal staining and diameter between 0 μmol/L OXA groupand 2.5 μmol/L OXA group at high magnification
2.3 奥沙利铂诱导细胞衰老对细胞增殖的影响
流式细胞术结果显示,衰老模型组HCT-116和HT-29细胞的Edu阳性率分别为13.82%±3.01%和78.33%±3.33%。与未处理组比较,衰老组的Edu阳性比例显著下降(P<0.001,见图4)。以上结果表明,衰老细胞增殖能力显著降低。

p21阳性为绿色,β-gal阳性为红色,DAPI蓝色;与0 μmol/L OXA组相比,***P<0.001图3 免疫荧光检测奥沙利铂诱导衰老细胞中p21、β-gal的表达情况Figure 3 Expression of senescent markers p21 and β-gal in OXA-induced senescent cells
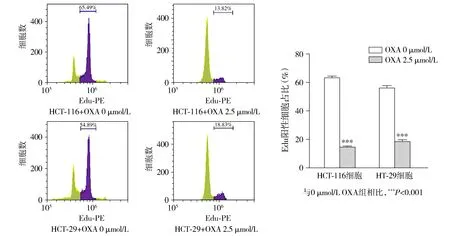
图4 流式细胞术检测奥沙利铂诱导衰老细胞中Edu阳性细胞比率Figure 4 Edu positive cells in OXA-induced senescent cells by flow cytometry
2.4 奥沙利铂诱导细胞衰老对DNA损伤相关蛋白表达的影响
蛋白免疫印迹实验显示,与未处理组相比,2.5 μmol/L OXA奥沙利铂诱导的衰老细胞表达DNA损伤标志物γ-H2AX、损伤修复标志物p53、衰老标志物p21及细胞周期依赖性激酶CDK2的水平显著升高,差异具有统计学意义(P<0.001,见图5),但p38、p16蛋白水平没有统计学差异。上述结果说明,奥沙利铂是通过DNA损伤导致p21上调,引起细胞周期阻滞,从而导致细胞衰老。
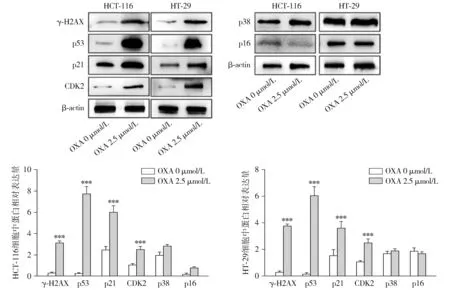
与0 μmol/L OXA组相比,***P<0.001图5 蛋白免疫印迹检测奥沙利铂诱导衰老细胞中相关蛋白表达情况Figure 5 Expression of related proteins in OXA-induced senescent cells by Western blot
2.5 奥沙利铂诱导衰老细胞相关分泌表型(SASP)的鉴定
通过qRT-PCR统计分析结果显示,与未处理细胞相比,在衰老的HCT-116细胞中IL-6、IL-8、IL-10、CXCL10及MMP-3显著升高;同时,与未处理细胞相比,在衰老的HT-29细胞中IL-6、IL-8、CXCL10、MMP-1及MMP-3也显著升高(P<0.001,见图6),而与未处理细胞相比,MMP-1在HCT-116细胞及IL-10在HT-29细胞中变化无统计学差异。以上结果说明,奥沙利铂诱导结肠癌细胞衰老后,衰老细胞形成不同的衰老细胞分泌表型。
2.6 奥沙利铂诱导衰老细胞对化疗耐药的影响
CCK-8结果显示,在逐渐加大药物剂量的情况下,与未处理结肠癌细胞相比,奥沙利铂诱导衰老细胞的细胞活力(吸光度450 nm)在40,60,80 μmol/LOXA处理时显著提高,差异有统计学意义(P<0.001,见图7),说明随着化疗药剂量的增加,衰老细胞对药物更加不敏感,并且产生奥沙利铂药物抵抗性。
3 讨论
结直肠癌是仅次于乳腺癌和肺癌的第三大常见癌症。根据最新统计,2020年全球约有190万结直肠癌新发和93.5万人死亡病例[8],并且初诊时有21%的病人已是晚期。对于结肠癌晚期患者,化疗是主要治疗手段之一,但部分患者化疗后仍出现肿瘤复发和转移导致治疗失败。引起肿瘤恶性进展的可能潜在机制包括DNA损伤修复、细胞抗凋亡和表观遗传学的改变等原因[9]。许多研究表明,化疗导致的细胞衰老是导致肿瘤复发转移的重要“元凶”[10]。

与0 μmol/L OXA组相比,***P<0.001图6 qRT-PCR检测奥沙利铂诱导衰老细胞中常见的SASP因子Figure 6 Levels of common SASP factors in OXA-induced senescent cells by qRT-PCR

与未处理结肠癌细胞相比,***P<0.001图7 CCK-8检测未处理及衰老细胞在不同药物浓度下的细胞活力Figure 7 Cell viability of CRC and senescent cells under different drug concentrations by CCK-8 assay
衰老是一种细胞状态,表现为稳定的细胞周期停滞[11],特点是β-半乳糖苷酶活性上升。传统治疗肿瘤的观点认为,衰老通过阻止肿瘤细胞复制来抑制肿瘤[12],被认为是对癌症治疗有利的因素。然而,这种治疗策略通常忽略了衰老肿瘤细胞在基因组和转录水平上的广泛异质性[13,14],不同治疗方法导致的衰老细胞会产生不同的表型及特性,导致不同的肿瘤微环境[15],此外,最新研究表明,来自衰老肿瘤群体的细胞通常比原始群体更具侵袭性[16,17]。因此,研究衰老肿瘤细胞特性,以及其在肿瘤发生发展中的重要作用是十分必要的。
奥沙利铂是结肠癌患者最主要的一线化疗药物。我们研究发现,低剂量的奥沙利铂处理结肠癌细胞系HCT-116和HT-29能导致细胞衰老,其β-gal的酶活性上升、细胞体积增大及肿胀,而且衰老细胞不具备增殖能力。同时鉴定了衰老细胞主要是由DNA损伤引起p21上调而后细胞周期阻滞导致细胞衰老。衰老细胞的长期存在可能会通过SASP分泌因子及其特性影响肿瘤微环境导致化疗的失败[5],本研究发现,虽然不同细胞系分泌的细胞因子、趋化因子及金属蛋白酶略有不同,但与对照细胞相比都呈高表达,形成不同的衰老相关分泌表型。我们还发现衰老细胞对药物敏感性显著低于普通肿瘤细胞,可能是由于衰老细胞代谢能力降低、对外界刺激不敏感,或是特殊的机制引起的化疗抵抗特性,这还有待进一步探究。
综上所述,我们发现低剂量奥沙利铂导致结肠癌细胞衰老并鉴定了其衰老特征和标志物,初步探索了衰老细胞分泌相关表型及耐药特性。本研究建立的奥沙利铂诱导衰老肿瘤细胞模型为研究衰老肿瘤细胞的微环境奠定了基础,针对衰老肿瘤细胞特性,探索治疗肿瘤的新策略提供了新的思路。
