苦参素对晚期糖基化产物诱导的人血管平滑肌细胞表型转化的抑制作用及其机制
2021-02-10岳向明王军奎王巧娥刘仲伟邢玉洁
岳向明,王军奎,王巧娥,刘仲伟,邢玉洁,晁 娜*
(1陕西中医药大学第二临床医学系内科教研室,西安 712046;2陕西省人民医院心血管内科;3延安大学医学院内科学系;*通讯作者,E-mail:tyyqga@sina.com)
糖尿病(diabetes mellitus, DM)大血管并发症的特征性病理改变是动脉粥样硬化(atherosclerosis, AS),同时DM作为一个独立危险因素,能够加速AS发生发展的进程,但分子机制尚不明确。晚期糖基化产物(advanced glycation end products, AGEs)具有典型的代表性,是DM患者体内特征性的病理性代谢产物,其水平与主要心血管事件(MACE)的发生密切相关[1]。
血管平滑肌细胞(vascular smooth muscle cells, VSMCs)表型转化在AS发生发展的各个阶段均扮演重要的角色,合成型的VSMCs分泌细胞外基质(extra cellular matrix, ECM)以及各种炎性细胞因子,参与AS斑块的形成及进展[2]。课题组前期研究表明VSMCs内Notch信号通路激活是AGEs诱导VSMCs发生表型转化的重要分子机制[3]。内质网应激(endoplasmic reticulum stress,ERS)下游的重要通路蛋白激酶RNA样内质网激酶(protein kinase RNA-like ER kinase, PERK)信号通路与诸如凋亡、自噬以及纤维化等多种病理生理学反应有关[4]。一项研究结果显示,PERK信号通路的激活导致细胞表面Dll4的表达增多[5]。此外,多项体内及体外研究也证实了AGEs可诱发ERS的激活[6,7]。因此,我们推测PERK信号通路是ERS与Notch信号通路之间交互作用的桥梁。
研究表明,苦参素(matrine)可有效阻遏AS的发生发展,但具体的分子机制上不完全清楚。根据课题组的前期研究结果,苦参素对糖尿病状态下细胞内ERS PERK信号通路具有显著的抑制作用[8]。据此,我们推测苦参素可能通过抑制AGEs诱导的VSMCs PERK信号通路激活降低细胞表面Dll4的表达水平,从而抑制VSMCs收缩型-合成型细胞表型转化,进而遏制AS。因此,本研究通过对苦参素抑制糖尿病相关AS相关分子机制进行探讨,旨在为苦参素在本病的临床治疗应用中提供重要的理论基础。
1 材料和方法
1.1 主要试剂
牛血清白蛋白(BSA)购自美国Hyclone公司;甘油醛购自美国Sigma-Aldrich公司;PD-10脱盐柱购自美国GE Healthcare公司;SignalSilence PERK siRNA试剂盒以及SignalSilence Scramble siRNA试剂盒均购自美国CST公司,Mirus TransIT-TKO试剂盒购自美国Mirus公司;滑肌肌球蛋白重链11(smooth muscle myosin heavy chain 11, MYH11)抗体、骨桥蛋白(osteopontin, OPN)抗体、葡萄糖调节蛋白78(glucose regulated protein 78, GRP78)抗体、磷酸化PERK(p-PERK)抗体、PERK抗体以及GAPDH抗体均购自美国Abcam公司;δ样蛋白-4(delta-like 4, Dll4)、Notch受体胞内结合域1(Notch intracellular domain 1, NICD1)以及Split多毛增强子1(enhancer of split protein 1, HES1)以及发状分裂相关增强子2(YRPW motif protein 2, HEY2)抗体均购自美国CST公司;Alexa-488荧光二抗购自美国Invitrogen公司;苦参素购自美国Sigma-Alderich公司。
1.2 AGEs制备
AGEs的制备方法及步骤参考本课题组及既往文献[3]中的描述进行。在无菌条件下,将BSA与0.1 mmol/L甘油醛在0.2 mmol/L的磷酸钠缓冲液(pH=7.4)中充分混合,37 ℃孵育7 d。使用PD-10脱盐柱层析法去除未形成基团的糖类。将未与甘油醛混合的BSA作为对照。
1.3 细胞培养、处理与分组
复苏本实验室留存的人血管平滑肌细胞(HVSMCs,ATCC来源)并接种于含10%胎牛血清(BSA)及抗生素的DMEM培养基中,在5%CO2、95%新鲜空气、饱和湿度及37 ℃条件下进行培养,当细胞融合程度>80%时进行后续实验。根据对细胞的处理方式不同,分为对照组(control)、低剂量AGEs组(L-AGEs)、高剂量AGEs组(H-AGEs)、低剂量苦参素组(AGEs+L-Mat)、中剂量苦参素组(AGEs+M-Mat)以及高剂量苦参素组(AGEs+H-Mat)。其中control组为空白对照;L-AGEs组以浓度为5 μmol/L的AGEs孵育细胞24 h;H-AGEs组以浓度为10 μmol/L的AGEs孵育细胞24 h;AGEs+L-Mat组以浓度为0.25 mmol/L的苦参素溶液预处理48 h后再以终浓度为10 μmol/L的AGEs孵育细胞24 h;AGEs+M-Mat组以浓度为0.5 mmol/L的苦参素溶液预处理48 h后再以终浓度为10 μmol/L的AGEs孵育细胞24 h;AGEs+H-Mat组以浓度为1.0 mmol/L的苦参素溶液预处理48 h后再以终浓度为10 μmol/L的AGEs孵育细胞24 h。下文中各检测均在此分组基础上进行。
1.4 免疫荧光染色检测HVSMCs收缩型表型标志物表达水平
将HVSMCs制成细胞爬片并用磷酸盐缓冲液(PBS)漂洗3次。4%多聚甲醛固定20 min,0.2% Triton X-100孵育10 min。PBS漂洗3次后,封闭缓冲液封闭30 min。分别与HVSMCs收缩型表型表面标记物MYH11抗体(1 ∶500)在4 ℃孵育10 h,PBS漂洗后,Alexa-488荧光二抗37 ℃孵育2 h。在倒置荧光显微镜下进行观察并使用image J软件(版本号1.38)进行分析。
1.5 酶联免疫吸附实验(ELISA)检测细胞培养液炎症因子浓度
无菌管收集各组细胞培养上清液,4 ℃以2 000 r/min离心15 min后弃去沉淀,收集上清液分装备用。以IL-1β及TNF-α ELISA试剂盒对上述标本中IL-1β及TNF-α浓度进行检测,检测流程参照试剂盒说明书进行。
1.6 蛋白免疫印迹检测蛋白表达及PERK磷酸化水平
以RIPA裂解液处理收集的HVSMCs细胞,低温离心后,使用总蛋白抽提试剂盒提取总蛋白。BCA法测定蛋白浓度,SDS-PAGE电泳分离蛋白后电转印至PVDF膜。封闭缓冲液孵育后,分别使用GRP78抗体(1 ∶500),磷酸化PERK(p-PERK,1 ∶1 000),PERK(1 ∶1 000),Dll4(1 ∶500),NICD1(1 ∶500),HES1(1 ∶500),HEY2(1 ∶500)以及GAPDH抗体(1 ∶1 000)在4 ℃下孵育10 h。TBST洗涤后,与相应二抗室温下孵育30 min,ECL显色法显色并捕捉图像,Image J Pro软件对条带灰度进行分析。
1.7 统计学分析
2 结果
2.1 苦参素显著抑制AGEs诱导的HVSMCs收缩型-合成型细胞表型转化
与control组相比,L-AGEs组及H-AGEs组HVSMCs收缩型表型标记物MYH11表达水平均显著降低(P<0.05),H-AGEs组MYH11表达水平较L-AGEs组显著降低(P<0.05)。与H-AGEs组相比,AGEs+L-Mat组、AGEs+M-Mat组及AGEs+H-Mat组HVSMCs细胞标记物MYH11表达水平显著升高(均P<0.05),且呈苦参素浓度依赖性(均P<0.05,见图1)。
2.2 苦参素显著抑制AGEs诱导的HVSMCs细胞炎性细胞因子分泌
本研究以ELISA法对HVSMCs细胞培养液中促炎因子IL-1β及TNF-α水平进行检测,结果见图2。与control组相比,L-AGEs组及H-AGEs组HVSMCs细胞培养上清液中IL-1β及TNF-α水平均显著升高(P<0.05),且H-AGEs组较L-AGEs组显著升高(P<0.05)。与H-AGEs组相比,AGEs+L-Mat组、AGEs+M-Mat组及AGEs+H-Mat组HVSMCs细胞培养上清液中L-1β及TNF-α水平显著降低,且呈苦参素浓度依赖性(均P<0.05)。
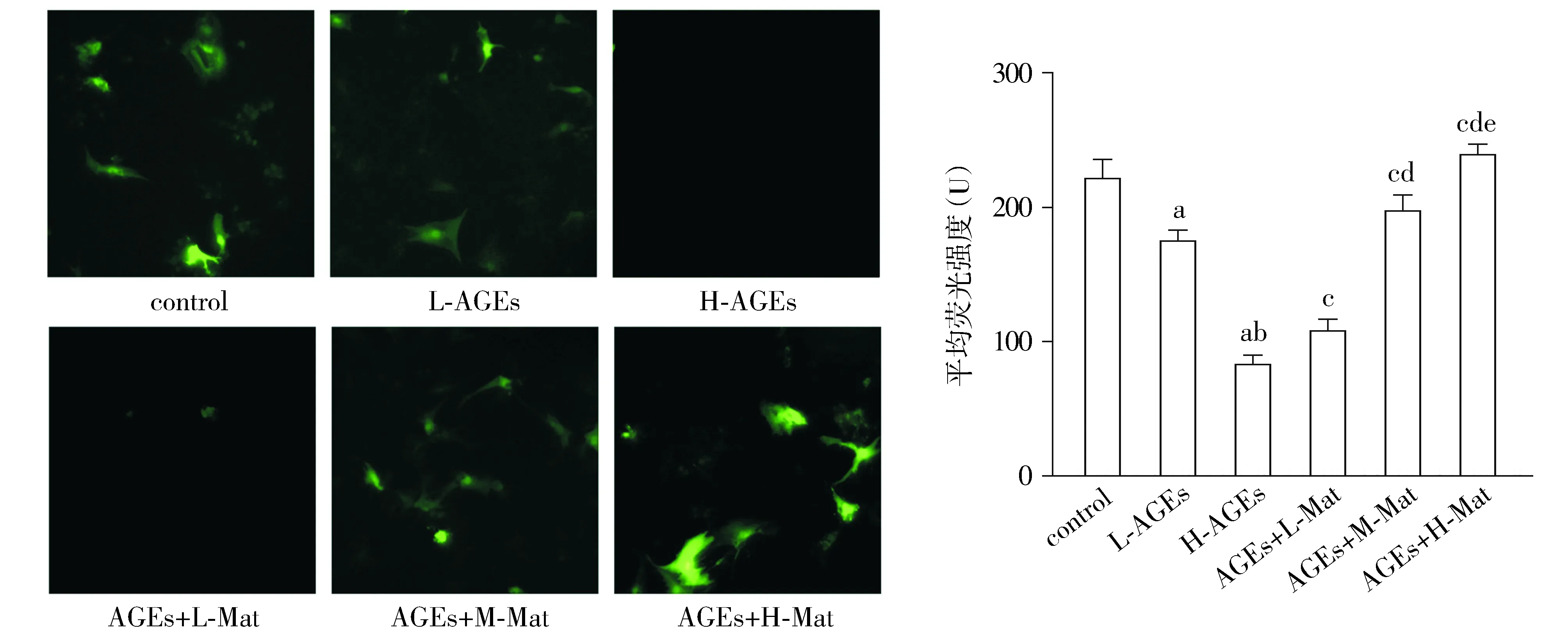
与control组相比,aP<0.05;与L-AGEs组相比,bP<0.05;与H-AGEs组相比,cP<0.05;与AGEs+L-Mat组相比,dP<0.05;与AGEs+M-Mat组相比,eP<0.05图1 免疫荧光检测HVSMCs收缩型表型标记物MYH11表达水平 (×400)Figure 1 Expression of HVSMCs contractile phenotype marker MYH11 by immunofluorescent staining (×400)
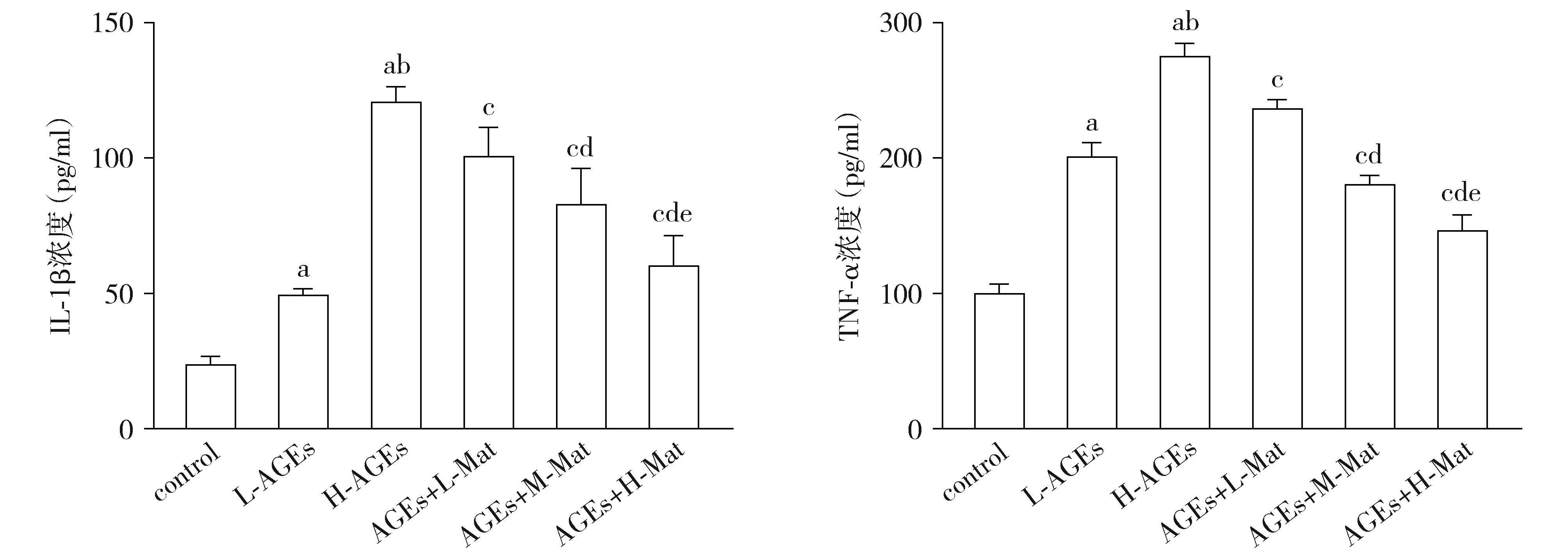
与control组相比,aP<0.05;与L-AGEs组相比,bP<0.05;与H-AGEs组相比,cP<0.05;与AGEs+L-Mat组相比,dP<0.05;与AGEs+M-Mat组相比,eP<0.05图2 ELISA法检测HVSMCs细胞培养上清液IL-1β及TNF-α浓度Figure 2 Concentrations of IL-1β and TNF-α in medium supernatant of HVSMCs by ELISA
2.3 苦参素显著抑制AGEs诱导的HVSMCs细胞ERS PERK/Dll4信号通路激活
Werstern blotting结果显示,与control组相比,L-AGEs组及H-AGEs组HVSMCs内GRP78、Dll4表达水平以及PERK磷酸化水平均显著升高,且H-AGEs组较L-AGEs组显著升高(均P<0.05)。与H-AGEs组相比,AGEs+L-Mat组、AGEs+M-Mat组及AGEs+H-Mat组HVSMCs内GRP78、Dll4表达水平以及PERK磷酸化水平均显著降低,且呈现苦参素浓度依赖性(均P<0.05,见图3)。
2.4 PERK敲减可显著抑制AGEs诱导的HVSMCs内Dll4/Notch信号通路激活
Western blotting结果显示,与control组相比,L-AGEs及H-AGEs组HVSMCs内NICD1、HEY2以及HES1表达水平均显著升高,且H-AGEs组较L-AGEs组显著升高(均P<0.05)。与H-AGEs组相比,AGEs+L-Mat组、AGEs+M-Mat组及AGEs+H-Mat组HVSMCs内NICD1、HEY2以及HES1表达水平显著降低,且呈苦参素浓度依赖性(均P<0.05,见图4)。
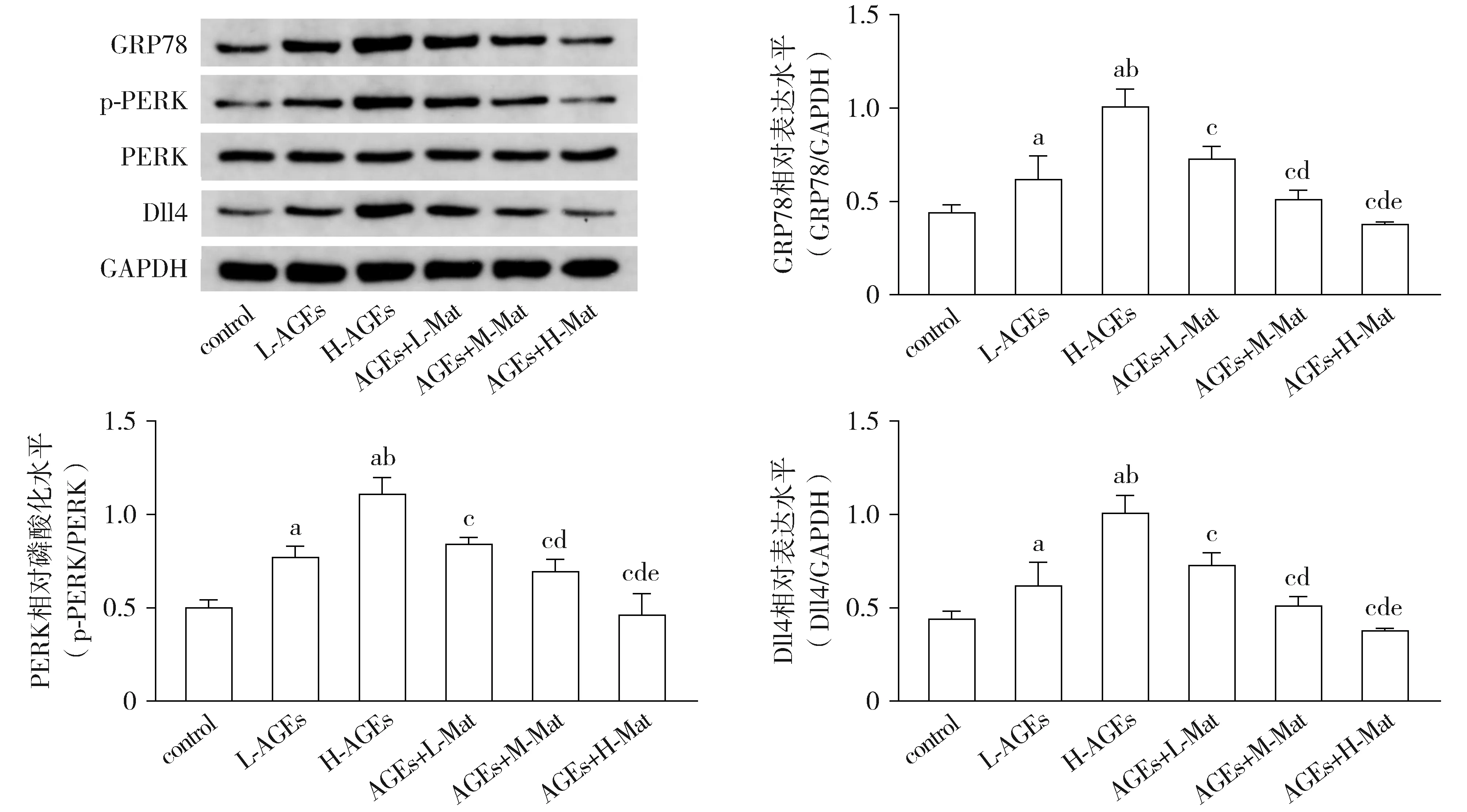
与control组相比,aP<0.05;与L-AGEs组相比,bP<0.05;与H-AGEs组相比,cP<0.05;与AGEs+L-Mat组相比,dP<0.05;与AGEs+M-Mat组相比,eP<0.05图3 Western blotting法检测HVSMCs GRP78、Dll4表达水平及PERK磷酸化水平Figure 3 Relative expression levels of GRP78, Dll4 and relative phosphorylation level of PERK in HVSMCs by Western blotting
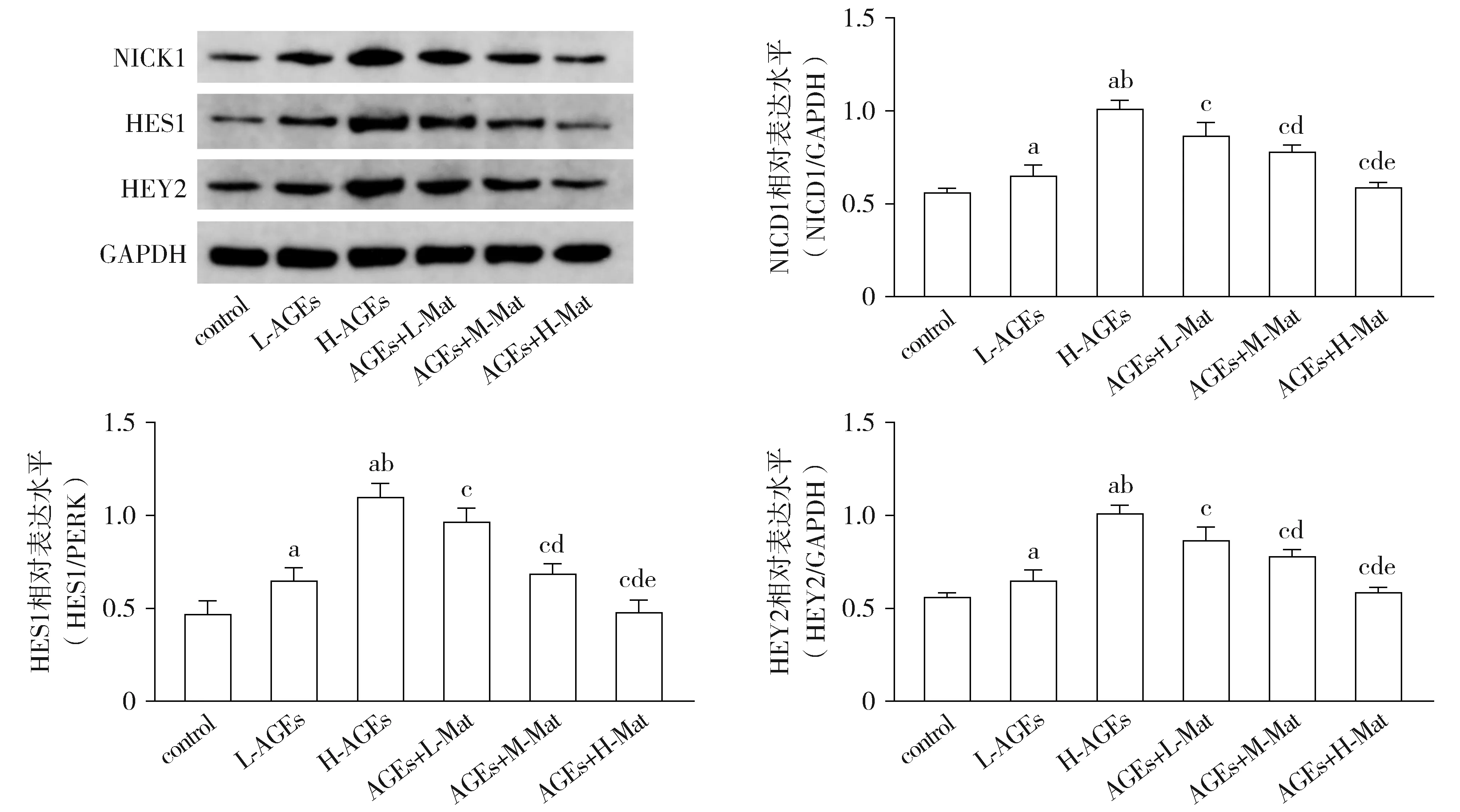
与control组相比,aP<0.05;与L-AGEs组相比,bP<0.05;与H-AGEs组相比,cP<0.05;与AGEs+L-Mat组相比,dP<0.05;与AGEs+M-Mat组相比,eP<0.05图4 Western blotting法检测HVSMCs内NICD1、HES1以及HEY2表达水平Figure 4 Relative expression levels of NICD1, HES1 and HEY2 in HVSMCs by Western blotting
3 讨论
AGEs是DM患者体内异常代谢产物的代表之一,在持续的控制不佳的高血糖状态下,蛋白质、核酸以及脂质发生Maillard反应,形成Schiff碱,后者经过Amadori反应生成一系列结构多样的具有高度生物学活性的产物[9]。既往研究表明,AGEs与DM患者主要心血管事件(MACE)的发生密切相关[1]。在本课题组的前期系列研究中,相继发现AGEs可作用于心肌细胞以及动脉内皮细胞,通过诱导细胞凋亡以及局部炎症等参与DM相关心血管并发症的发生发展[10-13]。
VSMCs是动脉血管壁的重要细胞成分,在不同病理生理条件下可表现出不同的细胞表型,即VSMCs的表型转化。在一些病理因素的刺激下,VSMCs出现收缩型表型向合成型表型的转化,表现为VSMCs内肌丝纤维减少以及炎性因子及细胞外基质蛋白合成分泌异常活跃[14]。丧失了收缩型表型特征的VSMCs可向合成型表型转化。合成型VSMCs具有产生和分泌细胞外基质以及炎症性细胞因子的特点,进而对AS斑块的形成、进展以及易损性表现出促进作用[14]。本研究结果表明,AGEs可使VSMCs细胞表面收缩型表面标记物MYH11表达水平下降,同时VSMCs分泌的炎性因子水平显著升高,表明AGEs可使VSMCs丧失收缩型表型特征,向合成型表型转化。
在有害病理因子的作用下,ER功能受损便可诱发ERS,并通过其下游的PERK等信号通路产生各种生物学效应[15]。本研究结果显示,AGEs处理可使VSMCs细胞内GRP78表达水平及PERK磷酸化水平显著升高。GRP78是ERS激活的分子标志物,PERK信号通路则通过其自身磷酸化激活。本研究结果表明,AGEs可使VSMCs内PERK磷酸化水平显著升高,说明AGEs可诱导VSMCs内ERS PERK信号通路激活。除了依赖帽结构的翻译,还有一种依赖5′非翻译区(5′-UTR)的内部核糖体进入位点(IRES)机制可在ERS状态下起到指导蛋白翻译的作用。一项研究表明,处于ERS状态的细胞可通过PERK信号通路的活化,经由5′-UTR IRES机制促进Dll4的表达[5]。作为配体,Dll4可通过与细胞表面的Notch受体结合而激活Notch信号通路。
目前认为,Notch通路是VSMCs发生收缩型-合成型表型转化的关键信号通路。Notch信号通激活后,furin对Notch进行切割,后者发生裂解,Notch胞内段(Notch intracellular domain, NICD)被释放进入胞浆,发生核转位后与转录因子CBF-1/RBP-Jκ及Mastermind结合形成三元络合物,激活下游的Hey以及Hes等靶基因的转录[16]。HEY2可以通过抑制多个转录调控元件(transcriptional regulatory elements)活性而降低例如MYH11等收缩蛋白的表达[17]。HES则被证明可促进胶原蛋白等靶基因启动子的活性,参与细胞外基质的分泌[18]。本研究发现,AGEs可诱发VSMCs内Notch信号通路的激活,通过NICD1、HEY2以及HES1等效应分子参与VSMCs收缩型-合成型表型转化。
近年来药理学研究显示苦参素具有多种药理学活性,本课题组前期研究结果也证实了苦参素具有心血管保护作用。前期研究结果还表明,苦参素对氧化应激依赖的内质网应激有显著的抑制作用[8]。本研究以不同剂量苦参素对AGEs暴露的VSMCs进行预处理,发现苦参素预处理能够显著抑制VSMCs内质网应激,降低下游PERK信号通路的活性,从而抑制VSMCs Dll4的表达水平,进而抑制细胞内Notch信号通路的激活,最终抑制VSMCs由收缩型向合成型的表型转化。综上所述,苦参素可抑制AGEs激活的内质网应激PERK/Dll4/Notch信号通路诱导的VSMCs收缩型-合成型细胞表型转化。该机制可能是苦参素抑制动脉粥样硬化的重要分子机制之一。
