免疫检查点阻断剂PD-1抗体在小鼠肝细胞癌治疗中的应用
2021-02-10买为丽旦衣明江塔来提吐尔干陈新华吐尔干艾力阿吉张瑞青
买为丽旦·衣明江,塔来提·吐尔干,陈新华,吐尔干艾力·阿吉,张瑞青,张 巍
(新疆医科大学第一附属医院病理科,乌鲁木齐 830054;*通讯作者,E-mail:zwyhr100@163.com)
肝细胞肝癌(hepatocellular carcinoma,HCC)是世界第五大常见肿瘤,每年新发病高达80万例,占原发性肝脏肿瘤的90%[1],是我国恶性肿瘤继肺癌之后的第2位,发病率呈逐年上升趋势。HCC起病隐匿,潜伏期长,患者早期通常没有特殊症状,而一旦发病,往往已是中、晚期,病情发展迅速,预后极差,死亡率高[2]。HCC的治疗以手术及放化疗为主,近年来正在发展中的局部消融治疗、免疫治疗等逐渐成为肝癌治疗的新策略[3,4]。免疫检查点(immune checkpoint)是人体免疫系统中起保护作用的分子,免疫检查点分子过表达会抑制肿瘤特异性T淋巴细胞的免疫活性,促进肿瘤的进展。基于这一机制,利用针对免疫检查点分子或配体的单克隆抗体阻断其信号传递,可以恢复细胞毒性T细胞活性,从而诱导针对肿瘤细胞的特异性免疫反应。免疫检查点是肿瘤免疫逃逸的主要机制之一,其中最重要的是程序性细胞死亡蛋白1(programmed death-1,PD-1)/程序性细胞死亡配体1(programmed cell death ligand 1,PD-L1)。PD-1为免疫阻断性受体,主要在周围组织和肿瘤微环境中与它的配体PD-L1和PD-L2相互作用,从而抑制T细胞增殖、活化和分泌细胞因子[5,6]。使用PD-1受体拮抗剂可改善机体免疫抑制状态,增强机体抗肿瘤免疫效应,已在一些实体肿瘤中取得了一定的疗效,但在肝癌患者中有效率低于30%[2,5],这可能与肝癌免疫微环境耐受及免疫细胞浸润不足有关[7],但PD-1抗体对肝癌免疫微环境中各个免疫细胞的具体影响需进一步研究。本实验通过小鼠原位肝癌模型观察PD-1阻断剂在HCC中的治疗效果和肿瘤微环境的变化,为PD-1阻断剂的临床应用提供实验基础。
1 材料与方法
1.1 实验动物
28只6-8周龄雌性SPF级C57BL/6J小鼠购自新疆医科大学动物实验中心,生产许可证号:SYXK(新)2018-0003,实验动物质量合格证:65000700001067。本实验经新疆医科大学实验动物福利伦理委员会审查批准,伦理审批号:IACUC20181203-01。
1.2 细胞株及主要试剂
鼠源性Hepa1-6肝癌细胞株由浙江大学陈新华教授惠赠。PD-1抗体(BioXcell,美国),胎牛血清(Gibco,美国),DMEM培养基(Gibco,美国),淋巴细胞分离液(北京达科为生物技术有限公司);免疫细胞检测使用CD45-PC7-A、CD3-PECY5、CD4-FITC、CD8-PE、CD3-PECY5、CD19 FITC-A和NK1.1-PECY7流式抗体,购自eBioscience(美国)。Th1类细胞因子检测使用LEGENDplexTMMouse Th Cytokine Panel(13-plex),购自Biolegend(美国)。
1.3 细胞培养和小鼠原位肝癌模型的建立
常规复苏Hepa1-6肝癌细胞株,用含10%胎牛血清和1%双抗的DMEM培养基,在37 ℃、5% CO2孵育箱中培养并传代。将对数生长期的细胞浓度调至1×106/ml。通过腹腔注射1%戊巴比妥(60 mg/kg)麻醉小鼠,麻醉见效后剖开小鼠腹腔,暴露小鼠肝脏,取50 μl细胞悬液与matrigel基质胶混合,接种在肝左叶包膜下[8]。建模全过程无菌操作。
1.4 PD-1抗体阻断实验
建模完成后第8天,将小鼠随机分为治疗组和模型组,每组14只,8只取标本,6只观察生存状态。治疗组将PD-1抗体溶于500 μl的PBS中,每只小鼠腹腔注射200 μg PD-1抗体,每3 d一次,共注射3次[9],模型组注射相同剂量的生理盐水。治疗后每天观察两组小鼠生存状态。
1.5 肿瘤组织HE染色及病理学评估
治疗结束后第2天,每组随机选择8只小鼠,通过摘眼球法取外周血后,处死小鼠取肿瘤组织,测量肿瘤组织标本最大直径,对比两组小鼠肿瘤组织大小,并通过HE染色观察两组标本病理特点。肿瘤组织标本用3%中性多聚甲醛固定,常规石蜡包埋,制成3 μm厚的连续切片,二甲苯脱蜡、梯度酒精水化后,将切片置于苏木素染色2-4 min,盐酸乙醇中分化以及自来水中返蓝;切片置于伊红染色液中1-2 min,脱水、透明、中性树脂封片,光镜观察病理形态学改变。
1.6 流式细胞术检测肿瘤组织T、B、NK细胞及外周血Th1类细胞因子
外周血分离血清,用LEGENDplexTMMouse Th Cytokine Panel (13-plex)试剂盒检测IL-2、IFN-γ、TNF-α浓度。取肿瘤组织制备单细胞悬液,以CD45-PC7-A为对照抗体,分别用抗T淋巴细胞(CD3-PECY5、CD4-FITC、CD8-PE)、B淋巴细胞(CD3-PECY5、CD19 FITC-A)、NK细胞(NK1.1-PECY7)抗体,使用DxFLEX(Beckman)流式细胞仪检测CD3+T、CD4+T、CD8+T、B和NK细胞比例。实验步骤按照抗体试剂盒说明书进行,所有数据采用Kaluza软件进行分析。
1.7 统计学分析
实验数据采用SPSS 23和GraphPad Prism7(Version 7.00, GraphPad Software, Inc., La Jolla, CA, USA)软件分析,应用独立样本t检验比较两组小鼠肿瘤大小,应用双因素方差分析比较两组间T、B、NK细胞比例和细胞因子浓度的差异;用KaplanMeierr生存曲线法及Log-rank检验比较两组间生存期的差异,P<0.05为差异具有统计学意义。
2 结果
2.1 PD-1抗体治疗对肿瘤大小及病理特征的影响
治疗组和模型组小鼠肿瘤直径分别是(9.011±0.38)mm和(11.93±0.68)mm,治疗组小鼠肿瘤直径明显小于模型组(t=3.74,P=0.002)。HE染色显示,模型组肿瘤细胞实性片状分布、核异型性明显、可见核分裂,符合肝细胞肝癌的病理形态学特征,并肿瘤内可见少量炎性细胞(见图1)。治疗组肿瘤间质纤维化、病灶出现不同程度的肿瘤细胞坏死融合,有弥散炎性细胞浸润(见图1)。
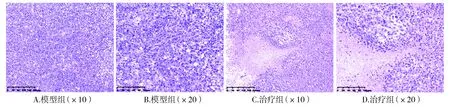
图1 小鼠肿瘤组织HE染色Figure 1 HE staining of mouse tumor tissue
2.2 PD-1抗体治疗对肿瘤局部免疫的影响
流式细胞术检测结果显示,治疗组小鼠肿瘤组织总T细胞比例明显高于模型组(P<0.001);CD4+T和CD8+T细胞比例均明显高于模型组,差异具有统计学意义(分别P<0.001和P=0.001,见图2)。

与对照组比较,**P<0.01,***P<0.01图2 流式细胞术检测PD-1抗体对小鼠肿瘤组织T细胞比例的影响Figure 2 Effect of PD-1 antibody on T cell proportion in mouse tumor tissue by flow cytometry
为了了解PD-1抗体对体液免疫和固有免疫的的影响,检测肿瘤组织B淋巴细胞和NK细胞比例,结果显示,PD-1抗体治疗组B淋巴细胞和NK细胞比例均明显高于模型组,差异具有统计学意义(均P<0.001,见图3)。

图3 流式细胞术检测PD-1抗体对小鼠肿瘤组织B和NK细胞比例的影响Figure 3 Effect of PD-1 antibody on the proportions of B,NK cells in mouse tumor tissue by flow cytometry
2.3 PD-1抗体治疗对外周血细胞因子的影响
PD-1抗体治疗组小鼠外周血IL-2浓度明显高于模型组(P<0.001);两组间IFN-γ和TNF-α浓度的差异无统计学意义(P>0.05,见图4)。
2.4 PD-1抗体治疗对小鼠生存期的影响
为了进一步确定PD-1抗体在小鼠原位肝癌中的治疗作用,进行Kaplan-Meier生存分析,采用Log-rank检验观察两组小鼠生存期并分别计算中位生存时间。结果显示,PD-1抗体治疗组小鼠中位生存时间为34 d,模型组小鼠为15 d,PD-1抗体治疗组小鼠中位生存时间显著延长(P=0.04,见图5)。

与对照组比较,***P<0.001图4 PD-1抗体对小鼠外周血Th1类细胞因子浓度的影响Figure 4 Effect of PD-1 antibody on the blood concentration of Th1 cytokines

图5 PD-1抗体对小鼠生存期的影响Figure 5 Effect of PD-1 antibody on survival time of mice
3 讨论
肿瘤免疫治疗作为一种崭新的治疗手段,具备多方面的独特优势,既可以治疗原发肿瘤,又可以抑制肿瘤复发、减少远处转移[10,11]。尽管生物免疫治疗有可能彻底治愈恶性肿瘤,并在某些实体恶性肿瘤的治疗上取得极为显著的疗效,然而,在肝癌的免疫治疗方面,至今仍未见革命性突破效果。肝癌免疫治疗药物的种类及其疗效仍然非常有限,针对肝癌免疫治疗的临床试验数量仍不多。究其原因,主要是由于肝脏所特有的免疫抑制状态和未能找到理想的相关抗原靶点[12]。近年来,PD-1受体阻断剂在多种恶性肿瘤(如黑色素瘤、非小细胞肺癌及肾细胞癌等)的临床应用中已取得很好的成果[6,13-21]。应用PD-1阻断剂可恢复T细胞的活性及功能,减轻患者免疫抑制状态,从而达到抗肿瘤的目的[22]。更重要的是,PD-1抑制剂的制备选用的大都是IgG4或者经过改造的IgG1亚型抗体,其天然的抗体依赖的细胞毒性效应(ADCC)很弱,补体依赖的细胞毒性效应(CDC)也几乎没有,从而避免了对T淋巴细胞的杀伤作用[23]。目前多个抗PD-1/PD-L1治疗肝癌的临床研究正在进行中。
PD-1抗体可以通过促进T淋巴细胞增殖、活化发挥其抗肿瘤效应[24],本实验通过小鼠原位肝癌模型观察肿瘤组织T淋巴细胞比例的改变,结果显示,肿瘤组织总T、CD4+T和CD8+T淋巴细胞比例均升高,且PD-1抗体治疗组小鼠生存期明显延长。研究证明[25],肿瘤组织中浸润性T细胞的数量和患者的预后呈正相关,CD8+T细胞数量的增加能够控制肿瘤的生长及延长生存期。CD4+T细胞通过多种机制促进抗肿瘤免疫,不仅辅助激活CD8+T淋巴细胞,还参与B淋巴细胞和巨噬细胞活化,并能吸引NK细胞到肿瘤局部,以发挥抗肿瘤作用。除此之外,CD4+T淋巴细胞通过与肿瘤细胞直接接触介导其凋亡[26]。本研究结果显示,PD-1抗体治疗后小鼠肿瘤组织B和NK细胞比例显著升高,这提示,PD-1抗体治疗在肝癌微环境中,对B细胞和NK细胞介导的免疫反应亦有一定的增强作用。B淋巴细胞是通过产生特异性抗体和呈递抗原从而促进免疫效应,并通过抗体依赖的、细胞介导的细胞毒作用,补体结合作用等机制发挥抗肿瘤作用,在机体体液免疫应答中占主导地位。而肿瘤浸润性NK细胞比例通常与癌症患者的预后密切相关,高比例患者预后比较好[27]。
肿瘤发生后,机体可以通过多种机制发挥抗肿瘤作用,其中辅助性T细胞(helper T lymphocyte,Th)无论在体液免疫还是细胞免疫中都发挥不可或缺的重要作用,根据其功能不同,Th细胞分为Thl和Th2两个亚群。研究表明,以IL-2和IFN-γ介导的Thl为主的细胞免疫在清除肿瘤及获得记忆性细胞免疫中起关键作用[28-29],当机体Thl细胞和及其分泌的细胞因子如IL-2、IFN-γ、TNF-α占优势,则提示机体对肿瘤具有较强的免疫力,在决定抗肿瘤免疫治疗是否成功方面起到了重要作用[30]。其中IL-2是机体免疫应答中起重要调节作用的细胞因子,能促进T淋巴细胞和NK细胞增殖、活化、促进B淋巴细胞增殖、分化和分泌抗体。本研究结果显示,PD-1抗体治疗组外周血IL-2和IFN-γ浓度均高于模型组,其中IL-2浓度在两组间的差异有显著的统计学意义。这说明,PD-1抗体治疗可以上调外周血IL-2浓度,从而增强机体抗肿瘤免疫应答。综上所述,PD-1抗体治疗可以明显改善原位肝癌模型小鼠免疫微环境,并增强系统性抗肿瘤免疫应答,从而显著延长小鼠生存时间,这结果为肝癌免疫检查点阻断治疗提供了实验和理论依据。
