诺如病毒病毒样颗粒疫苗免疫小鼠诱导的体液和黏膜免疫应答
2021-02-10刘悦越赵荣荣赵一荣张韵祺杜加亮
刘悦越,赵荣荣,赵一荣,张韵祺,杜加亮
(1中国食品药品检定研究院呼吸道病毒疫苗室,北京 102629;2云南大学数学与统计学院;3中国食品药品检定研究院单克隆抗体产品室;*通讯作者,E-mail:dujialiang@nifdc.org.cn)
诺如病毒(Norovirus,NoV)是全球非细菌性胃肠炎暴发的最重要病因[1],可引起低龄儿童、老年人和慢性病患者严重脱水,导致住院甚至死亡[2],造成沉重的社会经济负担。世界卫生组织(World Health Organization,WHO)强调NoV是疫苗开发的优先事项。然而,用于诺如病毒培养的动物或细胞模型的缺乏阻碍了疫苗的发展。NoV主要衣壳蛋白VP1具有自组装能力,可形成无遗传物质的病毒样颗粒(virus like particle,VLP),其在形态和抗原上类似于天然病毒[3]。已有研究表明,人乳头瘤病毒(human papilloma virus,HPV)[4]、流感病毒[5]、肠道病毒71[6]等的VLP候选疫苗具有安全性、免疫原性和有效性,HPV VLP疫苗的上市许可证明了VLP作为疫苗抗原的可行性。因此,VLP成为目前诺如病毒疫苗研发领域中理想的疫苗抗原。
根据病毒VP1基因序列差异,NoV可被分为10个基因组(GⅠ-GⅩ),其中GⅠ和GⅡ基因组是引起胃肠炎暴发的主要原因[7],而GⅡ.4毒株是全球流行的主要基因型,造成50%-70%的暴发[8]。我国的GⅠ.1/GⅡ.4型二价NoV疫苗正在临床开发中。有研究表明,汉逊酵母表达的重组NoV GⅠ.1和GⅡ.4型VLP可产生较强的免疫反应[9]。了解疫苗接种后抗体水平的变化规律,对合理评价疫苗的免疫效果至关重要。本研究旨在通过血清型特异性IgG、IgM、IgA、组织血型抗原(histoblood group antigen,HBGA)阻断抗体和粪便IgA等指标探索NoV GⅠ.1/GⅡ.4 VLP候选疫苗在BALB/c小鼠体内的抗体应答。
1 材料和方法
1.1 疫苗
重组二价诺如病毒疫苗由国药中生生物技术研究院有限公司提供,为GⅠ.1和GⅡ.4两种基因型的NoV VP1组成的类病毒颗粒,每剂0.5 ml,含GⅠ.1和GⅡ.4型VP1蛋白各50 μg。
1.2 实验动物
无特定病原体(specific pathogen free,SPF)级雌性BALB/c小鼠,7周龄,18-22 g,购自中国食品药品检定研究院实验动物中心,动物许可证号SCXK(京)2017-0005。
1.3 主要试剂
中性亲和素包被微孔板购自Thermo Scientific公司,酶标板购自美国costar公司,H(3型)-PAA-生物素和Leb-PAA-生物素购自Glycotech公司,GⅠ.1型和GⅡ.4型NoV VLP由国药中生生物技术研究院有限公司提供,GⅠ.1型、GⅡ.4型特异性抗体购自英国Abcam公司,HRP标记的羊抗小鼠IgG、IgG1、IgG2a、IgM、IgA购自美国Invitrogen公司,TMB购自北京索莱宝科技有限公司。
1.4 实验分组及免疫
将20只BALB/c小鼠随机分为2组,每组10只。疫苗组每只小鼠接种0.1 ml二价诺如病毒疫苗,含GⅠ.1和GⅡ.4型VP1蛋白各10 μg及0.08 mg氢氧化铝佐剂,对照组接种0.1 ml氢氧化铝佐剂(0.08 mg),免疫程序为第0,21天免疫。首次免疫后第7,14,21,28,35天,小鼠内眦采血,分离血清-20 ℃保存,首次免疫第7,14,21,28天采集每组小鼠粪便,-20 ℃保存,实验时用PBS以10%(W/V)比例制备粪便混悬液,2 300g离心10 min,取上清。
1.5 NoV型特异性血清IgG、IgG1、IgG2a、IgM、IgA分析
采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)测定血清中NoV型特异性IgG、IgG1、IgG2a、IgM、IgA[10]。分别用1 μg/ml GⅠ.1型和GⅡ.4型VLP包被96孔酶标板,4 ℃过夜。洗板后每孔加入200 μl含2% BSA的PBS封闭液,4 ℃过夜。将200倍稀释的血清加入酶标板中,37 ℃孵育1 h。洗板后分别加入HRP标记的羊抗鼠IgG、IgG1、IgG2a、IgM、IgA,其中IgG、IgG1、IgG2a、IgA均为1 ∶6 000稀释,IgM为1 ∶3 000稀释,37 ℃孵育1 h。洗板后加入TMB底物20-25 ℃避光显色15 min,终止液终止反应后酶标仪450/630 nm读板。以阴性对照小鼠血清孔的光密度值(optical density,OD)均值+3×标准差(standard deviation,SD)为临界值,如低于0.1,则以0.1为临界值,血清样品的OD值≥临界值即为阳性。
1.6 NoV型特异性血清和粪便IgA水平定量测定
采用ELISA测定血清和粪便中NoV型特异性IgA水平。实验方法同1.5。其中血清以200倍稀释起,粪便以10倍稀释起,2倍系列稀释后进行测定。抗体效价定义为OD值高于临界值的血清或粪便的最高稀释度,阴性样品的抗体效价计为起始稀释度的50%,即阴性血清样品IgA效价计为100,阴性粪便样品IgA计为5。
1.7 HBGA阻断试验
通过HBGA阻断试验测定血清中的GⅠ.1和GⅡ.4型抗体的HBGA阻断效价[11]。分别用2.5 μg/ml的Leb-PAA-生物素和H(3型)-PAA-生物素包被中性亲和素包被微孔板。将首次免疫第28天的小鼠血清100倍起2倍系列稀释,疫苗组稀释至12 800倍,对照组稀释至800倍,分别与GⅠ.1型和GⅡ.4型VLP混合,设立稀释液与VLP混合的对照,37 ℃孵育1 h。将混合物加至HBGA包被的微孔板中,4 ℃孵育2 h。洗板后,加入GⅠ.1型、GⅡ.4型特异性抗体,37 ℃孵育1 h。洗板后加入HRP标记的羊抗鼠IgG,37 ℃孵育1 h。洗板后加入TMB底物20-25 ℃避光显色15 min,终止液终止反应后酶标仪450/630 nm读板。抗体的阻断指数(%)=100%-(血清孔OD值/对照孔OD值)×100%。阻断效价50(blocking titer 50,BT50)表示为阻断50% VLP结合的血清最高稀释度的倒数,即为血清抗体阻断病毒与HBGA受体或附着因子结合的能力。
1.8 统计学分析
采用SPSS 23.0软件对血清各型抗体进行统计分析。通过重复测量资料的方差分析统计疫苗组与对照组间各型抗体及疫苗组各型抗体不同时间点间的差异,如数据不满足球形假设,则用Greenhous-Geisser方法进行校正。将血清IgA抗体浓度进行对数转换后,通过重复测量资料的方差分析统计疫苗组与对照组间血清IgA水平的差异,并采用配对t检验进行疫苗组内不同时间点的抗体水平差异分析,如差值不符合正态分布,采用两相关样本的非参数检验,显著性水平为0.05。
2 结果
2.1 血清NoV型特异性抗体
疫苗组小鼠第1剂免疫后第7天即产生NoV型特异性IgG、IgG1和IgG2a,至第35天一直维持在较高水平。IgM在第1剂免疫后第7天升至高水平,之后逐渐降低,IgA在第2剂免疫后第7天明显升高(见图1,2)。
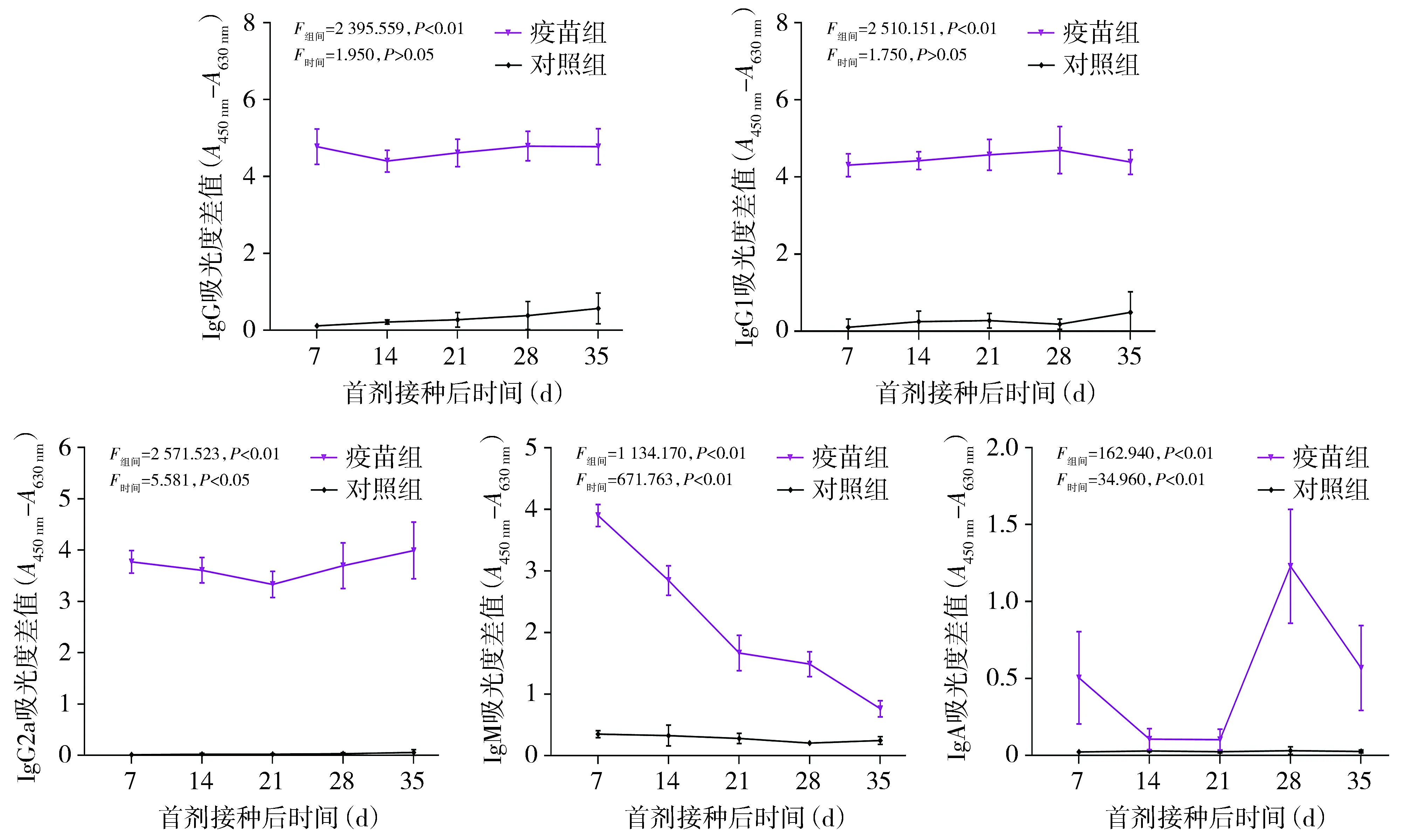
图1 疫苗组和对照组小鼠血清NoV GⅠ.1型特异性抗体反应Figure 1 Serum NoV GⅠ.1-specific antibody response in vaccine group and control group
通过重复测量资料的方差分析,疫苗组与对照组间各型抗体差异均有统计学意义(P<0.01)。疫苗组不同时间点的抗体,除GⅠ.1型IgG和IgG1差异无统计学意义外,其他均有统计学意义(GⅠ.1型IgG2a:P<0.05;GⅠ.1型IgM、IgA和GⅡ.4型各抗体:P<0.01)。
2.2 免疫后血清NoV IgA水平
疫苗组在第1剂接种后第28天即第2剂接种后第7天血清特异性IgA达到较高水平,对照组均为阴性,疫苗组首剂接种后第28天和第35天的各型血清IgA抗体水平差异均无统计学意义(见表1)。疫苗组与对照组间血清IgA水平差异有统计学意义(P<0.01)。
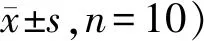
表1 疫苗组免疫后血清IgA水平差异分析 (log2效价,Table 1 The difference analysis results of serum IgA levels after immunization in vaccine
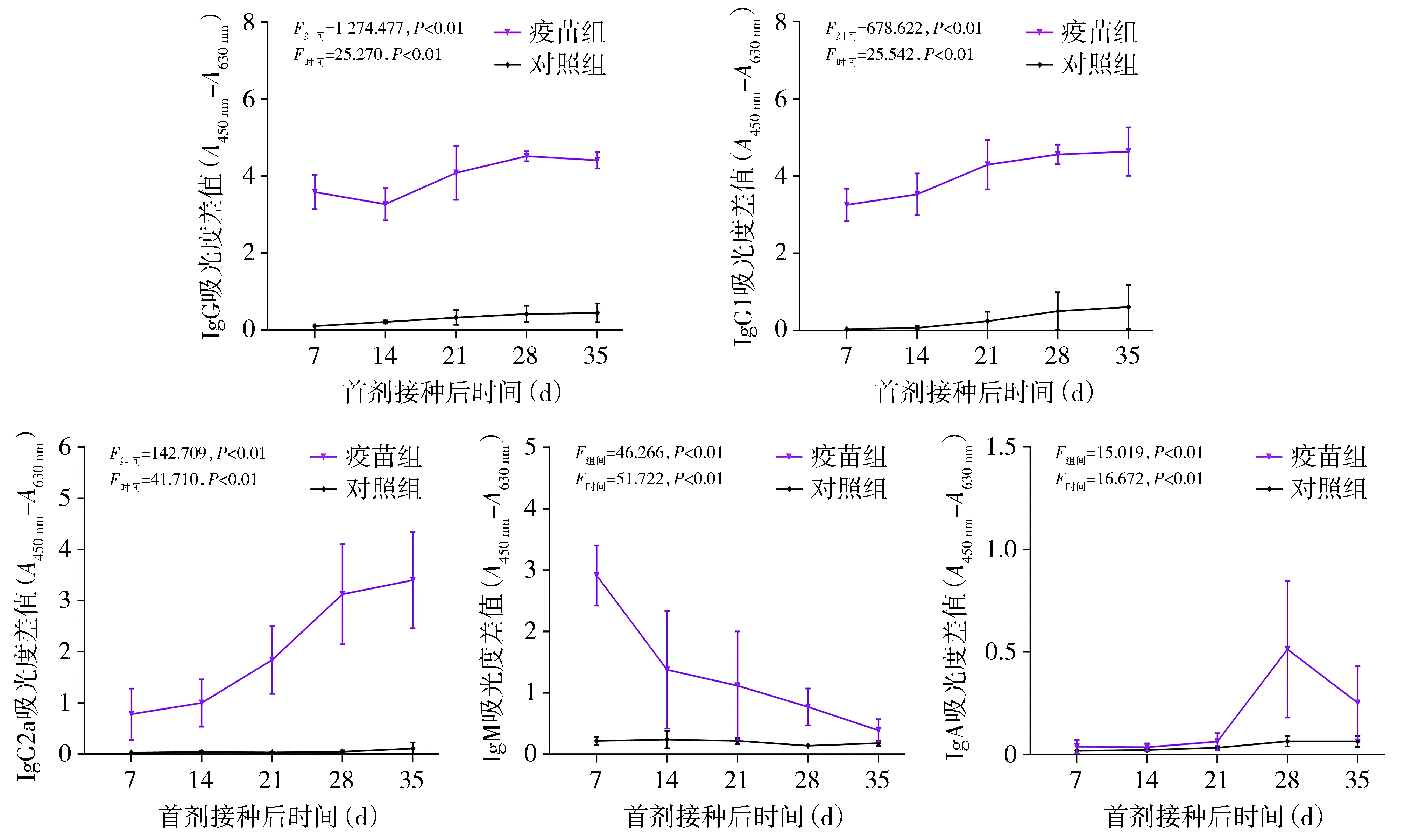
图2 疫苗组和对照组小鼠血清NoV GⅡ.4型特异性抗体反应Figure 2 Serum NoV GⅡ.4-specific antibody response in vaccine group and control group
2.3 免疫后粪便NoV IgA水平
疫苗组在第1剂免疫后第7天粪便IgA转阳,第21天粪便IgA水平略有下降,第28天再次升高,疫苗组粪便GⅠ.1型IgA达到160,GⅡ.4型IgA达到80(见图3)。
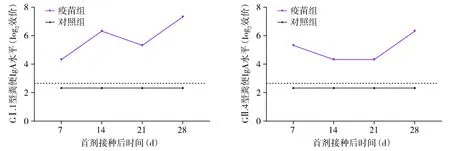
图3 疫苗组和对照组粪便NoV GⅠ.1和GⅡ.4型特异性IgA抗体水平Figure 3 Fecal titers of NoV GⅠ.1- and GⅡ.4-specific IgA antibodies in vaccine group and control group
2.4 免疫后血清HBGA阻断抗体水平
通过HBGA阻断试验进一步分析第28天,即第2剂免疫后第7天的小鼠血清抗体阻断活性。结果显示,疫苗组各型血清均有阻断活性(见图4),血清GⅠ.1型BT50达到400,GⅡ.4型BT50达到800。
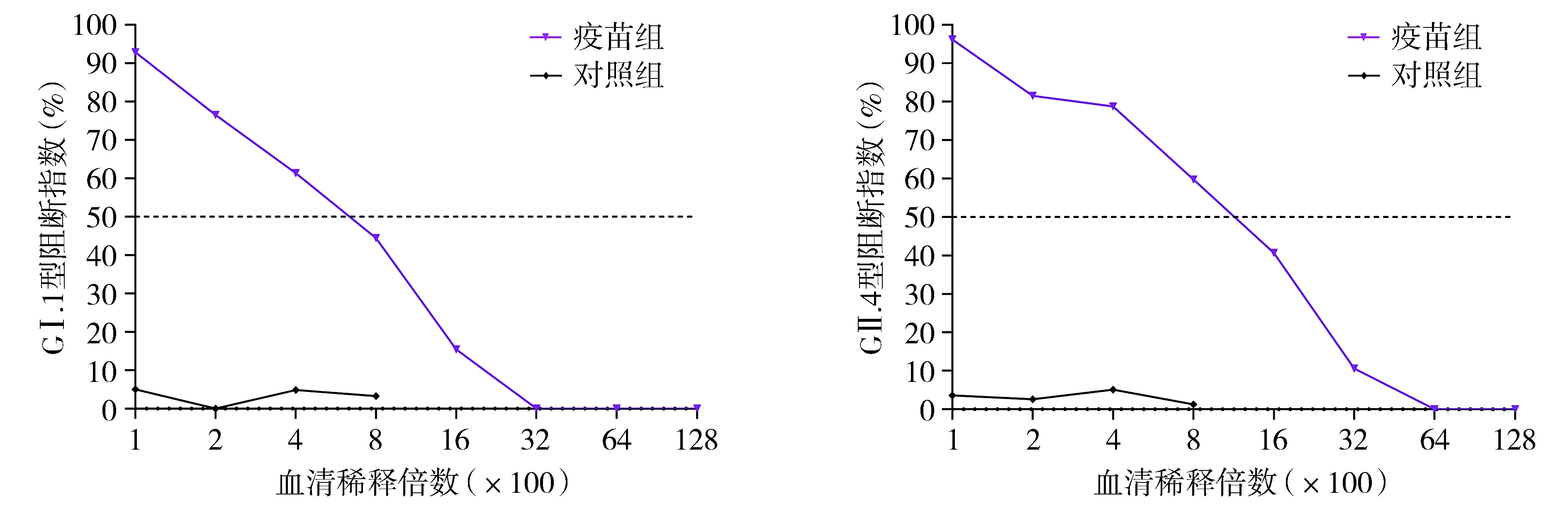
图4 疫苗组和对照组免疫后第28天血清HBGA阻断抗体水平Figure 4 Levels of serum HBGA blocking antibodies at day 28 after the first immunization in vaccine group and control group
3 讨论
NoV是全球流行性非细菌性胃肠炎的主要原因,多种候选NoV疫苗正在研发或临床阶段。由于NoV GⅠ和GⅡ基因组间无交叉保护性免疫应答[12],我国研究者以NoV GⅠ.1型和GⅡ.4型病毒株VLP组成二价疫苗,旨在提供广泛的保护作用。为了初步评价该疫苗的免疫原性,本研究观察了GⅠ.1和GⅡ.4诺如病毒VLP抗原在小鼠体内的体液、黏膜和中和抗体应答。
与Tamminen等[13]的VLP研究结果一致,本研究中小鼠接种1剂重组诺如病毒疫苗后,即产生较高的抗体反应,尤其是GⅠ.1型IgG,GⅡ.4型的IgG也呈现逐渐升高的趋势,表明VLP蛋白具有较强的免疫原性,能够诱导机体产生免疫反应。此外,作为细胞反应标志物的IgG亚类分析表明,各型抗原都会产生IgG1和IgG2a反应,提示诱导抗原特异性Th2/Th1型反应,前者参与调节抗病毒细胞免疫,后者增强体液免疫反应。据报道EV71 VLP也可刺激免疫小鼠产生混合Th1和Th2型反应[14],本研究结果显示,第2次免疫后血清IgA抗体滴度增加至较高水平,表明重复疫苗接种有效地增强NoV衣壳特异性血清抗体反应。在粪便样品中也观察到IgA反应,提示抗原激活机体黏膜免疫系统。黏膜免疫产生的IgA抗体能够抑制病毒黏附于肠道黏膜表面,对某些抗原物质具有封闭作用。与诺如病毒相似,轮状病毒也是感染肠道表面,有证据表明,针对轮状病毒的局部黏膜免疫反应对于抵抗病毒感染至关重要,血清和粪便IgA抗体与防止轮状病毒再感染有关[15]。由于两种病毒的感染途径相似,推测NoV特异性IgA可能也与机体抵御病毒感染的保护作用有关。较高的GⅡ.4特异性血清IgA抗体水平与受试者中NoV感染和患病率的降低有关[16]。然而,在一项GⅠ.1型NoV的攻击研究中,病毒特异性血清IgA水平与相应型别疾病的保护无关,但较高的病毒特异性唾液IgA抗体水平可降低诺如病毒胃肠炎的风险[17],提示肠黏膜免疫可能对诺如病毒胃肠炎起保护作用。
由于NoV体外培养系统和动物模型尚不成熟,因此无法采用常规的病毒中和试验测定抗体中和效价。HBGA在人体分泌物中和黏膜表面表达,诺如病毒可通过VP1突出的P2结构域与HBGA的糖基相结合,进入胃肠道上皮细胞。NoV特异性抗体可阻断NoV VLP与其HBGA受体或附着因子的结合,研究表明阻断NoV VLP与HBGA结合的抗体可能与保护作用有关,因此学者们公认将血清HBGA阻断抗体作为中和抗体的替代指标[18],其成为诺如病毒的免疫保护性标志物。为了探索二价NoV疫苗诱导免疫的功能,确认其抗体在中和方面的保护潜力,本研究测定抗原免疫后第28天的血清HBGA阻断抗体水平,疫苗组血清GⅠ.1型和GⅡ.4型BT50分别不低于400和800。有学者在人群中研究HBGA阻断抗体水平与保护作用之间的关系,结果GⅠ.1型血清HBGA阻断效价≥200与对诺如病毒引起的疾病的有效保护有关[19],GⅡ.4型血清HBGA阻断效价≥500与对诺如病毒导致的中至重度呕吐或腹泻的预防相关[16],提示该疫苗可诱导机体产生阻断抗体,为机体提供有效的保护作用。
本研究基于小鼠免疫接种试验,结果提示重组NoV VLP疫苗通过诱导针对GⅠ.1和GⅡ.4型的保护性免疫反应在小鼠中具有较好的免疫原性,可能为人体诺如疫苗免疫后的反应评价研究提供参考。
