胃尔康改善肿瘤坏死因子α诱导人胃上皮GES-1细胞炎症和肠化的研究
2021-02-06怀佳萍陈燕萍丁进叶晓华陈跃华
怀佳萍 陈燕萍 丁进 叶晓华 陈跃华*
胃黏膜肠上皮化生(IM)是从慢性胃炎、萎缩到异型增生、腺癌的胃癌级联反应过程的中间阶段,是胃的癌前病变[1]。目前已有研究表明IM与胃癌的发病呈正相关[2]。MUC2是一种分泌型黏蛋白,在正常胃黏膜中不表达,但在肠化的胃黏膜中表达。SOX2是胃特异性转录因子,对胚胎干细胞的分化、形态改变具有重要意义,在消化道肿瘤如食管癌、胃癌、结直肠癌等中均有异常表达。在IM过程中,MUC2表达量呈逐渐增多趋势,而SOX2表达则逐渐减少[3]。已有学者证实胃尔康能降低实验性大鼠胃癌前病变的发生率。本实验通过体外炎症细胞模型的建立,观察胃尔康对MUC2和SOX2表达的影响。
1 材料与方法
1.1 实验材料 (1)细胞来源:由源培生物细胞库提供人胃黏膜上皮细胞系GES-1,用含10%血清白蛋白1640培养基为常规培养基,并置于37℃、5% CO2培养箱中培养。(2)药物:胃尔康成分为党参、天花粉、乌梅、五味子、山楂、木香、马钱子粉等,由浙江家和制药有限公司提供(国药准字Z10970120),以PBS溶解成浓度为16 mg/ml的母液待用。人肿瘤坏死因子-α(TNF-α)购于Peprotech公司,配置母液浓度为1 mg/ml备用。
1.2 方法 (1)分组:本实验分为四组:空白组(GES-1)、对照组(GES-1+PBS溶液)、模型组(GES-1+TNF-α)、治疗组(GES-1+ TNF-α+胃尔康)。其中模型组在TNF-α溶液刺激下培养24 h,治疗组则在TNF-α溶液刺激8 h后再加入胃尔康溶液培养16 h。(2)细胞增殖抑制试验(MTT还原法):在96孔细胞培养板(5000个细胞/孔)中接种GES-1细胞,经过24 h常规培养后,分别加入浓度为0、1、5、10 ng/μl的TNF-α溶液继续培养24 h。培养结束时每孔加入10 μl CCK-8,在培养箱中继续孵育2 h,酶标仪测量各组在450 nm处吸光值。根据平均光密度(OD)计算细胞活力的百分比:细胞活力百分比=OD处理组/OD对照组100%。用同样方法在GES-1细胞中分别加入浓度为0、10、20、40、80、160 μg/ml的胃尔康溶液,并计算细胞活力。实验至少各重复3次。(3)IL-22含量测定:在6孔培养板中(5万个/孔)接种GES-1细胞,根据MTT还原法确定TNF-α和胃尔康浓度对细胞进行相应处理,细胞上清液中IL-22含量则由ELISA法测定。(4)MUC2和SOX2蛋白表达测定:在6孔培养板中(5万个/孔)接种GES-1细胞,同理根据MTT还原法确定的TNF-α和胃尔康浓度对细胞进行相应处理,用western blot法测定MUC2和SOX2蛋白表达。
1.3 统计学方法 采用 SPSS 17.0统计软件。计量资料(x±s)表示,多组间比较用单因素方差分析,组间两两比较则采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 MTT还原法结果 GES-1细胞分别加入不同浓度的TNF-α刺激后,细胞活性无明显变化,即不同浓度TNF-α对细胞无明显损害,亦无促细胞增长作用,故后续实验选择5 ng/ml浓度进行。不同浓度胃尔康刺激后与对照组比较,差异无统计学意义,故选择对细胞既无明显抑制也无促进作用的浓度40 μg/ml作为后续实验浓度。
2.2 胃尔康治疗后GES-1细胞形态学变化 空白组和对照组GES-1细胞生长良好,多数呈圆梭形,大小一致,核圆,呈小岛状生长,逐渐扩大成片,均贴壁生长,多为不规则的多角形(见图1A、B)。模型组加入TNF-α培养后表现为细胞变圆,边界不清,肿胀,间隙增宽,呈分枝状、核质融合状态,圆形漂浮细胞和细胞碎片增多(见图1C)。治疗组加入胃尔康后GES-1表现为贴壁细胞逐渐增多,细胞形态逐渐复原(见图1D)。
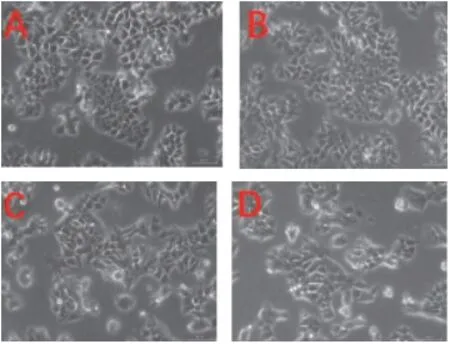
图1 各组GES-1细胞生长状态和形态显微镜下改变(×200)
2.3 各组IL-22含量比较 见表1。
表1 各组IL-22含量比较(±s)

表1 各组IL-22含量比较(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
组别 n IL-22(pg/ml)空白组 12 55.9±16.4对照组 12 58.1±9.8模型组 12 86.5±13.9*治疗组 12 67.8±11.0#
2.4 MUC2和SOX2蛋白表达 本实验中空白组灰度值默认为1,以此得出相应对照组、模型组和治疗组的灰度值。结果显示对照组中MUC2和SOX2蛋白表达与空白组比较无明显变化,差异无统计学意义。与对照组比较,模型组中MUC2蛋白含量明显升高,通过胃尔康治疗后MUC2蛋白表达有所下降,差异均有统计学意义。而模型组中SOX2蛋白表达明显少于对照组,治疗组中则有所升高,差异均有统计学意义。见表2、图2。
表2 各组MUC2和SOX2蛋白比较(±s)
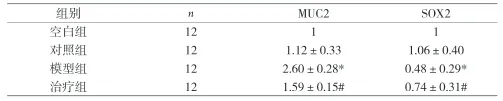
表2 各组MUC2和SOX2蛋白比较(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
组别 n MUC2 SOX2空白组 12 1 1对照组 12 1.12±0.33 1.06±0.40模型组 12 2.60±0.28* 0.48±0.29*治疗组 12 1.59±0.15# 0.74±0.31#
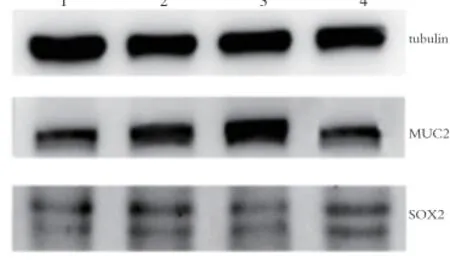
图2 各组中MUC2和SOX2蛋白表达
3 讨论
每年全球有近80万患者因胃癌死亡,其中约50%患者来自中国[4]。IM与胃癌发生率密切相关这一观点已被大量研究证实,而慢性萎缩性胃炎合并IM已被WHO定义为胃癌前期状态。但已有学者证实IM具有潜在的可逆性,在特定的情况下是可以被清除或逆转的[5],因IM是机体对环境变化做出的一种适应性改变,其能随环境改变而变化。
目前采用中医药治疗慢性萎缩性胃炎取得一定成绩,不仅能改善症状,且能减轻病理炎症反应[6]。IM属于中医学理论中“胃脘痛”“胃痞”等范畴,有学者研究发现加味香砂六君子汤对慢性萎缩性胃炎有较好疗效,能减轻胃黏膜萎缩,部分逆转肠化生情况[7]。胃尔康有益气健脾、滋肝补肾、清热解毒作用,能有效治疗慢性萎缩性胃炎脾胃阴虚证者[8],治疗总有效率>95%,并能部分逆转IM及不典型增生。IL-22在人体内主要是由Th1、Th17、Th22等活化CD4+T细胞所分泌,能有效缓解炎性疾病中相关炎症反应,但IL-22又能促进增殖和抗凋亡为主的疾病的发生发展[9]。徐芳媛等[10]发现在胃癌恶性转化过程中,存在IL-22自分泌现象,且在慢性胃炎经胃癌前病变至胃癌的恶性转化过程中IL-22表达量逐渐升高。本资料结果显示,模型组与对照组比较IL-22水平显著增高,胃尔康干预后IL-22水平显著降低,提示胃尔康通过抑制炎症因子IL-22的释放,从而减轻机体组织炎症反应。
IM是指正常胃黏膜被上皮样肠黏膜所取代的形态学改变。慢性萎缩性胃炎合并IM已被归纳为胃癌癌前病变,在IM中估计每年有0.13%~0.25%患者存在胃癌风险[11]。MUC2是一种高分子量糖蛋白,广泛存在于人体管腔器官上皮细胞中,其表达量的变化与细胞分化和肿瘤发生发展有密切关系。研究指出,MUC2大量表达于肠上皮胃黏膜的杯状细胞中,而在正常胃黏膜细胞中不表达,其在胃癌组织中阳性表达率51.4%,因此,MUC2黏蛋白与胃癌发生发展有密切关系。SOX2与胃黏膜分化发育和表型有一定相关性,已有研究表明,SOX2表达情况与胃癌侵袭深度、淋巴结转移或淋巴管浸润存在相关性。亦有多项研究报道,SOX2异常表达于结直肠癌组织中[12]。本实验中检测GES-1细胞中MUC2和SOX2蛋白的表达,发现TNF-α刺激后GES-1细胞MUC2表达明显升高,而SOX2表达下降。通过胃尔康治疗后,MUC2表达下降,同时SOX2的表达上升,表明胃尔康可能在一定程度上能逆转IM的发展。莫耘松等[13]发现胃尔康能改善慢性萎缩性胃炎患者免疫功能。陈芝芸等[14]动物实验亦发现胃尔康对实验性大鼠胃黏膜萎缩有显著改善作用。这些研究均与本资料结果相一致。综上所述,胃尔康可能是通过下调MUC2表达和上调SOX2表达来改善甚至逆转IM进程,这也可能是胃尔康在治疗慢性胃炎方面的分子生物学机制之一。
