人参总皂苷对大鼠骨关节炎的作用
2021-02-06包黎莎王华芳杨锦荧王春雷单乐天
包黎莎 王华芳 杨锦荧 王春雷 单乐天*
骨关节炎(OA)是一类软骨丢失、破坏、关节四周骨质增生为特征的与年龄相关的慢性疾病,可同时累及滑膜、软骨下骨和关节周围软组织,常见临床表现为膝骨关节肿胀感,僵硬不适,进展性膝关节疼痛,最终关节活动受限,甚至失用[1]。膝骨关节炎总患病率15%,随年龄的增长呈明显递增趋势[2-3]。中医将OA归属“骨痹”“痛痹”等范畴,中医病机为肝肾亏虚加之外邪侵袭,造成风寒湿热和瘀血痹阻。《本草纲目》记载人参具有治疗痹症的作用,因其疗效广泛副作用低[4-5],是经典强壮滋补药物。人参总皂苷(TSPG)是人参中最重要的药理成分,现代医学研究表明,其具有抗炎、抗氧化、抗凋亡等多种生物活性[6]。本文探讨人参总皂苷对骨关节炎大鼠关节疼痛和软骨修复的作用。
1 材料与方法
1.1 实验动物 雌性SPF级SD大鼠50只,体质量(200±20)g,购自上海斯莱克实验动物有限公司,实验动物合格证号:SCXK(沪)2013-0016。在浙江中医药大学动物实验中心进行,实验方案通过医学动物实验伦理委员会批准。
1.2 仪器及试剂 人参总皂苷;碘乙酸(MIA,Sigma公司,批号:BCBL3682V);戊巴比妥钠,EDTA脱钙液(Solarbio);YLS-3E电子压痛仪(安合盟天津科技发展有限公司);37370足底热辐射测痛(UGOBASILE)。
1.3 方法 (1)人参总皂苷溶液的配制:取人参总皂苷(TSPG)成品试剂(上海源叶生物有限公司),溶于超纯水,分别配置成125 μg/ml、250 μg/ml、500 μg/ml的溶液。(2)大鼠分组、造模及药物干预:取SPF级雌性SD大鼠50只,随机分为人参总皂苷高浓度组(TSPG-H 500 μg/ml)、人参总皂苷中浓度组(TSPG-M 250 μg/ml)、人参总皂苷低浓度组(TSPG-L 125 μg/ml)、模型组(Model组)和空白对照组(NC组),每组各10只。空白组大鼠通过微量注射器向其双侧膝关节内各注射50 μl生理盐水,其余四组大鼠各注射25 μg/ml碘乙酸50 μl进行造模处理。造模后第7天测定大鼠压痛阈值和热痛阈值,与初始压痛阈值、热痛阈值比较,差异有统计学意义后,开始药物干预。TSPG-H组、TSPG-M组、TSPG-L组分别关节腔注射500 μg/ml、250 μg/ml、125 μg/ml人参总皂苷水溶液,模型组和空白对照组双侧膝关节注射等量生理盐水,1次/周,共4周。(3)大鼠压痛阈值测定:于造模后每周用YLS-3E电子压痛仪测定各组大鼠的压痛阈值。测定时,将大鼠前肢和上半身以适宜力道固定,使其处于舒适且被固定的状态,将压痛仪的扁形头在大鼠双侧后足足背拇趾根平齐处施压,压力逐渐增大,当大鼠出现明显挣扎或鸣叫时,显示的压力值即为其压痛阈值。(4)大鼠热痛阈值测定:造模后每周采用足底热辐射测痛仪测定各组大鼠双侧后足趾热痛阈值。测定时将大鼠置于透明且大小合适的箱内(恰好容纳大鼠且其不可大范围活动)。测定前等待大鼠停止梳理毛发和探索性活动,保持安静(期间要注意保持大鼠足底干燥)。将测试仪置于玻璃板下,将仪器上的“十”字形标对准大鼠后足底中央(避开足垫)。开启仪器,从开始加热至大鼠出现抬腿回避的时间即为大鼠热痛阈值。每只大鼠测定3次,间隔5~6 min/次,取平均值作为测量值。(5)大鼠膝关节软骨组织病理学观察:药物干预完成后,处死所有大鼠,取其双侧膝关节,置于4%多聚甲醛中固定72 h,流水彻底冲洗。随后加入EDTA脱钙液对大鼠膝关节进行脱钙,每天更换脱钙液体并观察脱钙程度。脱钙完成后,常规操作脱水、包埋、切片,进行HE染色,封片。光镜下观察软骨组织病理学改变。并参照OARSI关节软骨病理评分标准进行积分统计(见表1)。OARSI评分越高,提示骨关节病变越严重。(6)软骨细胞实验:①软骨细胞分离和培养:采用胶原酶消化法提取。取新生大鼠5只,脱颈处死后,剃去毛发,于75%酒精中浸泡5 min彻底消毒大鼠体表。无菌操作取大鼠双侧膝关节,剃除膝关节表面肌肉组织(操作时应避免暴露关节腔),取出的膝关节在75%酒精中浸泡5 min后用手术刀打开关节腔,取出软骨组织,以PBS缓冲液漂洗以充分洗去软骨组织中残留的结缔组织。随后将软骨剪成小碎片,大小约为1 mm3,再次置于PBS缓冲液中漂洗3次后,弃去PBS,加入0.2% Ⅱ型胶原酶3 ml。振荡摇匀使组织块与Ⅱ型胶原酶充分接触,放入37℃恒温震荡箱中消化40 min,取上层消化液进行离心,转速800 r/min,离心5 min,弃上清液,取沉淀物(即细胞),加入4 ml含10%胎牛血清的DMEM培养液,吹打、混匀,得到软骨细胞悬液。所得悬液用滤网过滤并计数,调整悬液密度为2×105/ml接种于25 cm2规格的培养瓶中,置于CO2培养箱中,37℃,5%CO2,培养24 h后用倒置显微镜观察细胞贴壁情况。②软骨细胞CCK实验:取原代软骨细胞,以每孔100 μl细胞悬液接种至96孔板中,即每孔5×103个细胞。将培养板放在培养箱中,在37℃,5% CO2环境中预培养24 h;移除96孔板中IMDM培养液,随机分为正常组、模型组和实验组,每组设5个复孔,正常组加入IMDM培养液,模型组每孔加入MIA(0.75 ng/ml)100 μl,实验组每孔加入MIA后,再分别加入低、中、高不同浓度人参总皂苷水溶液100 μl(125,250,500 μg/ml),置培养箱中孵育;48 h后,每孔加入10 μl CCK溶液,置培养板于培养箱内孵育2 h后,用酶标仪测定孔内悬液在450 nm处的吸光度(A450),根据公式得出细胞活力,以检测不同浓度的人参总皂苷水溶液对软骨细胞增殖的影响,重复测量3次。细胞增殖率计算公式为:细胞增值率(%)=(实验组平均A450值-正常组平均A450值)/(模型组平均A450值-正常组平均A450值)×100%。

表 1 OARSI评分标准
1.4 统计学方法 采用Prism7软件。多组间比较采用单因素方差分析,组间两两比较均采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 人参总皂苷对大鼠足部压痛阈值的影响 造模4周后模型组与正常组比较压痛阈值下降,差异有统计学意义(P<0.01),表明碘乙酸造模成功;TSPG-L组、TSPG-M组、TSPG-H组与模型组比较,压痛阈值均升高,差异有统计学意义(P<0.01),且改善情况与TSPG浓度呈正相关,但仍低于正常组,见图1。
2.2 人参总皂苷对大鼠足部热痛阈值的影响 造模4周后模型组与正常组相比较热痛阈值显著下降,差异有统计学意义(P<0.01);TSPG-L、TSPG-M、TSPG-H三组与模型组相比较,痛阈值均显著升高,且差异有统计学意义(P<0.01),见图2。
2.3 大鼠膝关节组织学病理切片结果 模型组大鼠膝关节软骨表面明显缺损,软骨基质降解、软骨细胞丢失,为典型OA退变表现。TSPG组软骨相较于模型组均有恢复,软骨表面相对较完整,完整度为TSPG-H>TSPGM>TSPG-L,软骨细胞和软骨基质接近正常水平,有肥大软骨细胞少量,见图3。与正常组比较,模型组OARSI评分明显增高(P<0.01),TSPG治疗组OARSI评分与模型组比较明显降低(P<0.01),见图4。

图1 人参总皂苷水溶液对大鼠足部压痛的影响
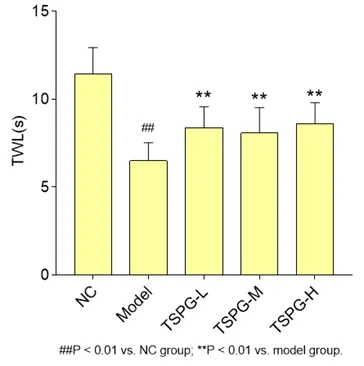
图2 人参总皂苷水溶液对大鼠足部热痛影响

图3 各组大鼠软骨组织病理切片(HE染色×100)
2.4 软骨细胞CCK实验结果 软骨细胞培养48 h后,与对照组比较,TSPG组软骨细胞活力均增高(P<0.05),浓度为200 μg/ml组的软骨细胞活力最高。见图5。
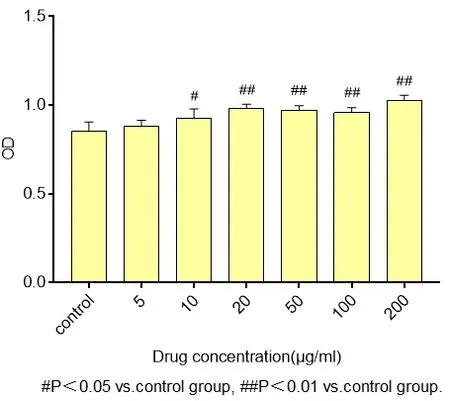
图5 人参总皂苷水溶液对大鼠软骨细胞活力的影响
3 讨论
OA是指以软骨丢失及伴有关节周围骨反应为特点的一种滑膜关节病,其中以膝骨关节炎最常见。由多因素共同作用产生,如创伤、病原感染、肥胖、遗传、年龄、饮食和炎症等[7]。
多种炎症因子与OA的发生有密切关系,影响软骨损失的进展并引起关节疼痛、肿胀、僵硬等临床表现[8]。在这些炎症介质中,白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)和趋化因子对OA较为重要。IL-1β可通过诱导软骨细胞凋亡[9-11]、降低Ⅱ型胶原和软骨细胞中聚集蛋白聚糖的表达[12]等方式损伤软骨。此外,IL-1β和TNF-α还可通过刺激其他多种炎症因子的产生,诱导一氧化氮(NO)和活性氧(ROS)的生成,促进OA进展。
人参皂苷已被证实对神经系统、肝脏、肾脏、气道、肠道等多种器官组织具有抗炎作用[13-17]。多项研究显示,人参皂苷可抑制IL-1β和TNF-α,减缓关节炎的进展或严重程度[18-19]。TSPG可通过抑制促炎因子,上调保护性细胞因子,从而抑制骨关节破坏,缓解疼痛症状。TSPG还具有抑制细胞凋亡,改善骨质破坏和促进细胞增殖的作用。体外实验表明,人参总皂苷可抑制滑膜成纤维细胞分泌基质金属蛋白酶(MMP)[20]。此外,研究显示人参皂甙Rg1,Rb2,Rg5等均可抑制OA大鼠关节软骨细胞凋亡和基质损伤,从而预防关节软骨的破坏[21-23]。
本实验结果显示,模型组与正常组比较,压痛值和热痛值降低(P<0.01),关节面破损严重,软骨基质降解、软骨细胞丢失,提示碘乙酸造模效果良好。TSPG-L组、TSPG-M组、TSPG-H组以关节腔内注射连续治疗4周后,各治疗组压痛值均高于模型组,且与剂量呈正相关,提示TSPG能缓解OA大鼠炎性疼痛,提高足部痛阈值。各治疗组热痛阈值相较模型组上升,与各治疗组剂量无明显相关性。软骨细胞CCK实验显示,人参皂苷组细胞增值率提高,且与浓度有关。组织学病理切片显示,治疗组ORASI评分均降低,提示TSPG可以明显修复受损的软骨面、软骨细胞及软骨细胞外基质。
综上所述,TSPG对改善关节疼痛、修复受损软骨疗效显著,其机制可能与抑制炎症因子,减少软骨细胞凋亡和基质损伤,促进软骨细胞修复有关。
