基于雄激素受体构建三阴性乳腺癌预后模型
2021-02-06陆翔陈彩萍邬万新郭志琴韩超薛丽
陆翔 陈彩萍 邬万新 郭志琴 韩超 薛丽
三阴性乳腺癌(triple-negative breast cancer,TNBC)是指雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)均为阴性的乳腺癌[1],其发病率占乳腺癌的15%~20%,通常好发于年轻女性,具有侵袭性强、容易转移、预后较差等特点[2-3]。TNBC属于异质性疾病,根据基因表达谱可分为多种不同的亚型。TNM分期系统依据肿瘤大小、区域淋巴结受累状态和有无远处转移来预测肿瘤的预后,但由于异质性的存在使TNM分期系统难以预测TNBC的预后。因此,有必要寻找新的生物标志物来辅助TNM分期系统进行更精准的预测。雄激素受体(androgen receptor,AR)广泛分布于多种器官和组织,不仅参与生殖过程,而且参与恶性肿瘤的发病过程。既往文献报道AR在TNBC中存在表达,并抑制TNBC的增殖[4]。作者的研究也发现AR在TNBC中的过表达会引起miRNA let-7的升高,使细胞受阻于G1期,抑制细胞增殖,AR和let-7的高表达可能与较好的预后有关[5]。通过检测分析TNBC患者肿瘤标本的AR表达情况,利用AR和TNM分期构建一个关于TNBC患者术后无病生存率(disease-free survival,DFS)的预测模型。
1 材料和方法
1.1 研究对象 连续性纳入2009年1月至2018年7月在本院住院治疗的TNBC患者。纳入标准:(1)女性;(2)原发性浸润性乳腺癌;(3)AJCC第8版TNM解剖学分期1~3期;(4)免疫组化检测ER和PR<1%,免疫组化检测HER-2为阴性或1+、或FISH检测HER-2为未扩增[6];(5)患者依据当时的诊疗指南接受了规范的治疗(包括根治性手术、放疗、化疗等);(6)组织库中有足够的肿瘤组织供本次检测。排除标准:(1)<18岁;(2)合并其他恶性肿瘤史;(3)术前接受新辅助化疗;(4)未接受规范化治疗;(5)术后随访≤1次且术后随访期<6个月。本研究经医院伦理委员会的批准,并获得了患者和家属的知情同意。
1.2 随访方式 随访方式包括电话联系和门诊检查,每年随访≥1次。随访截止时间为2019年12月31日。主要观察项目为DFS,次要观察项目为总生存率(overall survival,OS)。DFS的定义是指从手术日到发生第一次肿瘤事件、死亡、无事件患者的最后一次随访日,第一次肿瘤事件是指出现局部/区域性乳腺癌复发、乳腺癌远处转移、对侧乳腺浸润性癌或原位癌、其他原发性浸润性癌。OS被定义为从手术日到任何原因引起的死亡或存活患者的最后一次随访日。
1.3 AR检测及判定方法 采用免疫组化EnVision两步法检测福尔马林固定石蜡包埋的乳腺癌标本的AR表达。石蜡切片,脱蜡、水化。切片入Tris-EDTA缓冲液(pH 9.0)中进行抗原修复20 min(水浴,96℃~98℃)。冷却至室温,流水冲洗。切片滴加兔抗人AR单克隆抗体(克隆号:EP120;公司:北京中杉金桥生物技术有限公司;稀释度:1∶200),室温孵育2 h。采用二抗检测试剂盒(Dako REAL EnVisionTM Detection System)和DAB显色。苏木素复染,蓝化,梯度酒精脱水,二甲苯透明和封片。以PBS代替一抗作为阴性对照。AR定位于细胞核,当细胞核中出现棕黄色颗粒时判定为AR阳性细胞。随机选取高倍镜下5个不重叠的视野,对阳性细胞的染色强弱和阳性细胞占比打分。染色强度评分标准:不染色0分,轻度染色1分,中度染色2分,强染色3分。阳性细胞占比评分标准:无细胞染色0分,≤25%细胞染色1分,26%~49%细胞染色2分,≥50%细胞染色3分。上述检测由两位经验丰富的病理科医生独立完成,对于不同结果由两位医生共同再次阅片并讨论后给出一致结果。以染色强度、阳性细胞占比两者得分的乘积(简称:AR乘积)作为AR的最终结果,即AR乘积=AR染色强度评分×AR阳性细胞占比评分。
1.4 统计学方法 采用SPSS (22.0版)和R(3.5.1版)软件处理数据。计数资料采用Pearson卡方检验。相关性分析采用Spearman检验法。生存分析采用Kaplan-Meier方法,Log-rank检验组间生存曲线差异。多因素生存分析采用COX回归分析,选择方法为“向后:LR”。根据COX回归分析结果构建预后指数(PI),公式为PI=风险系数1×变量1+风险系数2×变量2+……+风险系数n×变量n。公式中的变量是指DFS的独立预后因素,风险系数是该独立预后因素的风险系数。基于COX回归分析结果建立列线图,并用C指数和验证曲线验证列线图的可靠性。所有统计检验均为双侧检验,P<0.05表示差异有统计学意义。
2 结果
2.1 患者的一般资料和随访情况 共纳入176例患者,年龄28~88岁,中位年龄53.0岁。绝经前患者90例,绝经后患者86例。病理学类型:浸润性乳腺癌非特殊类型160例,浸润性小叶癌1例,伴大汗腺分化的浸润性癌8例,伴髓样特征的浸润性癌4例,伴鳞状细胞癌化生的浸润性癌2例,腺样囊性癌1例。肿瘤最大径0.2~8.5 cm,中位2.2 cm。腋窝淋巴结阴性112例,腋窝淋巴结阳性64例。腋窝淋巴结阳性患者的阳性淋巴结数为1~35枚,中位3枚。组织学分级:1级0例,2级47例,3级129例。Ki-67≤30%为58例,Ki-67>30%为118例。根据AJCC第八版TNM分期,解剖学分期1~3期分别为62例、86例和28例。随访期260~3754 d,中位1285.5 d。随访期内有21例患者出现乳腺癌复发转移(包括肺骨同时转移3例、肺转移6例、肝转移5例、骨转移、脑转移和区域淋巴结转移各2例、局部复发1例),有2例患者出现对侧原发性浸润性乳腺癌,有8例患者出现其他原发性恶性肿瘤(包括肺癌3例、卵巢癌2例、结肠癌1例、甲状腺癌1例、肾癌1例)。死亡13例,其中死于乳腺癌11例,死于卵巢癌2例。
2.2 AR免疫组化检测结果 AR染色强度:0分103例、1分25例、2分27例、3分21例(见图1)。AR阳性细胞比例:0分103例、1分23例、2分18例、3分32例。两者正相关(相关系数=0.978,P<0.001)。AR乘积:0分103例、1分15例、2分17例、3分1例、4分9例、6分10例、9分21例。以2分为阈值将患者分为AR阳性组(AR乘积≥2)和AR阴性组(AR乘积<2),AR阳性率为33.0%(58/176)。两组间比较:AR阳性组>50岁者占比较大、浸润性乳腺癌非特殊类型的占比较小、组织学分级为2级的占比较大、Ki-67≤30%的占比较大、TNM解剖学分期相对较早(见表1)。

图1 AR不同染色强度评分病理图(×200)。A.不染色0分;B.轻度染色1分;C.中度染色2分;D.强染色3分
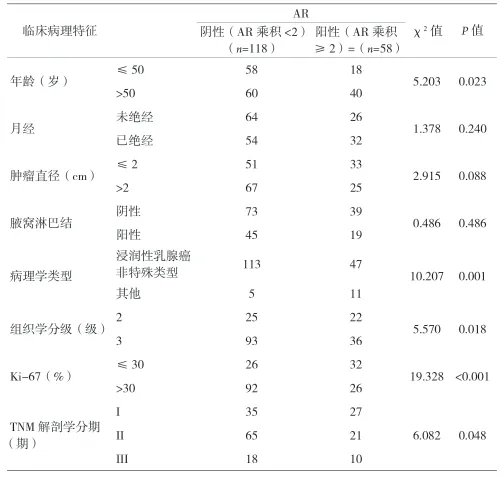
表1 AR与临床病理特征间的关系
2.3 生存分析结果 单因素生存分析提示AR乘积、腋窝淋巴结和TNM解剖学分期是DFS的影响因素(见图2)。多因素生存分析提示AR乘积和TNM解剖学分期是DFS的独立影响因素。
2.4 构 建PI预 后 模 型 建 立PI公 式:PI=-0.535×AR乘积 + BTNM。其中当TNM为1期时,BTNM=-1.937,当TNM为2期时,BTNM=-1.562,当TNM为3期时,BTNM=0。计算每个患者的PI指数。通过测算按以下标准将患者分成三组:PI<-3为低风险组,共45例;-3≤PI<0为中风险组,共114例;PI≥0为高风险组,共17例。三组间DFS、OS差异均有统计学意义,低风险组的复发、死亡风险最低,高风险组的复发、死亡风险最高(见图2D、E),提示该分组方法能够准确预测患者的复发、死亡风险。根据PI公式绘制列线图用于预测TNBC患者术后3年、5年的DFS风险,内部验证法提示该列线图的C指数为0.719,校准曲线提示预测值和实际结果之间基本重合,提示该列线图有较好的预测能力(见图3)。

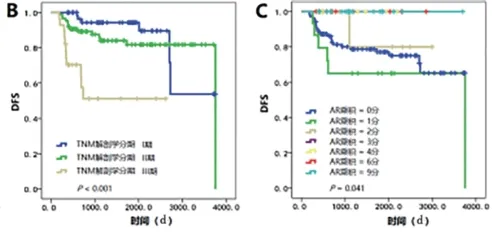
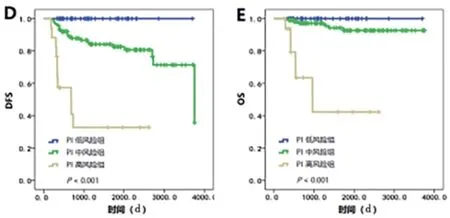
图2 176例TNBC患者生存曲线图。A. 腋窝淋巴结(P=0.007);B. TNM解剖学分期(P<0.001);C. AR乘积(P=0.041);D. PI风险模型(P<0.001);E. PI 风险模型(P<0.001)
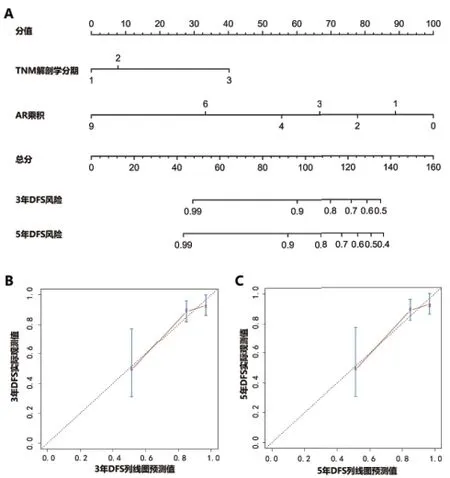
图3 列线图及校准曲线。A. 列线图(根据患者的TNM解剖学分期和AR乘积分别在第二、三横轴找到相应位置,向上作垂线与第一横轴相交,获得相应的分值,将两分值相加的总分标记于第4横轴相应位置,并向下画垂线与第5、6横轴相交,获得3年、5年DFS风险);B. 3年DFS风险的校准曲线(横坐标代表由列线图预测的3年DFS风险,纵坐标代表实际观测到的3年DFS风险,红线与对角线几乎重合,说明该列线图对3年DFS风险具有很好的预测能力);C. 5年DFS风险的校准曲线(横坐标代表由列线图预测的5年DFS风险,纵坐标代表实际观测到的5年DFS风险,红线与对角线几乎重合,说明该列线图对5年DFS风险具有较好的预测能力)
3 讨论
TNBC属于异质性疾病,其预后与患者年龄、肿瘤直径、组织学分级、血管有无侵犯、P53状态和Ki-67水平无关[4],在本研究中也观察到类似的结果。文献报道某些基因的表达状态有助于预测TNBC的预后[7],但基因检测无论是技术还是费用对于当前我国临床实际而言均难以推广。因此,有必要寻找新的、廉价的、易检测的生物标志物来帮助判断TNBC的预后。根据图2B,TNM 1期和2期患者的DFS曲线有交叉,而基于AR构建的PI预后模型三组之间DFS曲线无交叉(见图2D),提示AR可能是合适的生物标志物。
AR与TNBC预后之间的关系存在争议,有研究认为AR阳性提示TNBC的预后较好[8],也有研究持相反观点[9]。存在争议的原因除种族差异外[10],也与不同研究对AR阈值定义的不同有关,如有的研究将AR阳性定义为AR阳性细胞比例≥10%,有些研究将其定义为1%,也有研究将免疫组化检测存在核染色定义为AR阳性,也有通过计算AR阳性细胞占比和AR染色强度积分来定义AR水平。不同的定义可能导致不同的研究结果。本研究采用最后一种方法,其优点是同时考虑了阳性细胞的染色强弱和阳性细胞的占比,两者相乘后可得到7个不同的评分,可以更精细地区分患者,避免不合理的阈值定义造成结果偏差。根据列线图可知AR乘积与DFS负相关,AR乘积越大,AR蛋白表达水平越高,DFS风险越低。在表1中,为了便于描述AR表达水平与临床病理特征间的关系,本研究将AR乘积≥2定义为阳性,AR阳性率为33.0%(58/176)。
通过对AR的检测分析构建了一个新的预测TNBC患者术后DFS风险的模型,目的是在不显著增加患者医疗费用的情况下,更准确地评估DFS风险。其作用包括两方面:对于高危患者,鼓励患者按指南进行规范化、足疗程的辅助治疗十分重要,不要轻易放弃治疗,以达到更好的治疗效果;对于低危患者,告知患者低危复发风险有助于减轻患者的心理压力,可以更好地面对病情,增强战胜疾病的信心,提高生活质量。由于缺少循证医学证据,不建议根据该预测结果增减辅助治疗。
AR与TNBC预后相关性的机制尚未完全阐明,可能与AR上调let-7a,进一步下调CMYC和KRAS,使细胞增殖抑制有关。今后通过对其机制的进一步研究,将有可能找到一些新的生物标志物,有助于构建更完善的预后模型。
本研究作为一个单中心回顾性研究,存在样本量偏小等缺陷,可能导致结果偏差。今后可通过多中心合作、增加患者数量,使该模型的预测结果更加准确。
