超高压对蓝蛤酶解液风味及其蛋白质结构的影响
2021-02-02胡显杰朱文慧李学鹏季广仁
步 营,何 玮,胡显杰,2,朱文慧,*,李学鹏,*,刘 贺,毕 蕾,季广仁
(1.渤海大学 食品科学与工程学院/生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034;3.抚顺独凤轩骨神生物技术股份有限公司,辽宁 抚顺 113122;4.锦州笔架山食品有限公司,辽宁 锦州 121007)
我国是世界上最大的贝类养殖国,贝类养殖已经成为沿海海水养殖业的支柱之一。据统计,2018年我国海水养殖贝类总产量1 463.51万t,占贝类总产量的91.93%,其中,蛤类占海水养殖贝类总产量的27.88%[1]。蓝蛤(Aloididaealoidi)是盛产于我国沿海的一种低值海洋贝类,隶属于软体动物门瓣鳃纲(Lamellibranchia)、海螂目(Myoida)、蓝蛤科(Aloidiidae),在我国南北方均有分布[2]。蓝蛤个体较小,食用价值不大,常被作为一种很好的对虾活饵料。蓝蛤肉营养丰富,粗蛋白含量较高,是制备海鲜调味料的优质原料[3]。
生物酶解技术反应温和、过程可控,通过该技术获得蛋白水解物,已经成为开发海鲜调味料的关键技术。普通酶解法存在着酶解时间较长、效率低、酶解液苦腥味重且鲜味不足等问题,Cheret等[4]研究发现,超高压处理对海鲈鱼中的钙蛋白酶活性存在双重作用。Giannoglou等[5]研究发现,超高压处理(100~450 MPa,20~40 ℃)能够改变酶活性,影响蛋白酶的二、三级结构。这些研究说明:高压处理对蛋白质水解的影响与处理压力和酶二者都存在着关联,高压处理后的酶解产物在产物的种类与数量上都和常压酶解条件下的不同[6]。所以利用超高压技术处理改良酶解产物,可以实现有目标的定性改良产品风味的目的。但目前关于超高压酶解如何影响酶解液风味、蛋白质结构和外源蛋白酶酶活的相关研究鲜有报道。
鉴于此,通过研究超高压处理对蓝蛤酶解液风味和蛋白质结构的影响,分析超高压处理与蓝蛤酶解液风味物质、蛋白质结构之间的内在关联,研究结果希望能为高品质海鲜调味料的生产提供理论基础。
1 材料与方法
1.1 材料与试剂
蓝蛤(鲜活),锦州市林西水产市场;风味蛋白酶(500MG)、复合风味蛋白酶(11039),均为食品级,北京市诺维信投资有限公司;0.05 mol/L氢氧化钠、标准滴定溶液,天津市光复精细化工研究所;柠檬酸(分析纯),福晨(天津)化学试剂有限公司;乳酸(分析纯)、L-苹果酸(分析纯),阿拉丁试剂(上海)有限公司;丁二酸(分析纯)、十二烷基磺酸钠(SDS)(分析纯),北京索莱宝科技有限公司。
1.2 仪器与设备
HPP.L 2-600/0.6型超高压设备,天津华泰森淼公司;HH-4型数显恒温水浴锅,常州国华电器有限公司;Biofuge stratos型台式冷冻高速离心机,美国Thermo Fisher公司;Kjeltec 8400型全自动定氮仪,瑞典Foss公司;SA 402B型电子舌,日本Insent公司;7890N-5975C型气相色谱-质谱联用仪、1100型高效液相色谱仪,美国Agilent公司;固相微萃取装置、固相微萃取手柄、20 mL顶空样品瓶,美国Supelco公司;970CRT型荧光分光光度计,上海精密科学仪器有限公司;S-4800型场发射扫描电镜,日本日立公司;UV-2550型紫外可见光分光光度计,岛津仪器(苏州)有限公司;IRTRACE-100型傅里叶变换红外光谱仪,日本岛津公司。
1.3 实验方法
1.3.1样品制备
1.3.1.1 酶解液的制备
不同压力处理酶解液的制备:取一定量的蓝蛤肉,按质量比1∶1加水,用0.2 mol/L NaOH溶液调pH值至7.0,按蓝蛤肉质量的0.2%添加复合蛋白酶和风味蛋白酶(质量比1∶1),分别在150、200、250、300 MPa的压力下给压60 min(分别以UP150、UP200、UP250、UP300表示),然后50 ℃水浴加热,酶解4 h后100 ℃灭酶10 min,冷却过滤,离心(8 178 r/min,20 min)取上清液,-40 ℃冷冻,备用。
常压处理酶解液的制备:原料不经过超高压处理,其他同上。
1.3.1.2 蓝蛤蛋白的提取
将蓝蛤肉(常压处理、超高压处理)搅碎,加入2倍体积的20 mmol/L的Tris-HCl(pH值7.2),高速均质1次(5 500 r/min,90 s),在5 000 r/min条件下离心15 min。取上清液按高速均质离心过程反复2次,在最后一次沉淀中加入2倍体积20 mmol/L Tris-HCl-NaCl缓冲液(含0.6 mol/L NaCl,pH值7.2),高速(5 500 r/min)均质30 s之后,5 000 r/min离心15 min,取上清液置于-80 ℃冰箱冷冻备用(整个提取过程在0~4 ℃条件下进行)[7]。
1.3.2酶处理及酶活的测定
1)酶液的配置:参照曹辉[8]和Hernández-Ledesma等[9]的方法并改进,准确称取复合蛋白酶和风味蛋白酶各0.50 g,用磷酸缓冲溶液(pH值7.0)溶解,然后定容至100 mL(0~4 ℃下进行),装入高压蒸煮袋中,密封,冷藏备用。
2)超高压处理:压力分别为150、200、250、300 MPa,给压时间为60 min;水相保压,内腔温度保持在0~4 ℃(冰水混合物)。
3)酶液的制备:将处理好的酶液,在50~55 ℃的温度下加热30 min,过滤,冷藏待测,以不经超高压处理的样品为对照组。
4)酶活测定:参考肖丽[10]方法进行。
1.3.3游离氨基酸的测定
参考GB 5009.124—2016《食品中氨基酸的测定》[11]。对游离氨基酸的味道强度值(TAV)[12]进行计算,见式(1)。
TAV=C/T。
(1)
式(1)中,C,滋味物质的绝对质量分数值,mg/100g;T,滋味物质的味道阈值,mg/100g。
1.3.4核苷酸的测定
色谱条件[13]:C18柱(5 μm,4.6 mm×250 mm);流动相0.05 mol/L磷酸二氢钾-甲醇溶液(pH值4.5),临用前超声脱气;流速0.8 mL/min;进样量20 μL;紫外检测器波长254 nm;时间20 min。洗脱程序:0~7 min,体积分数100%甲醇;7~10 min,体积分数100%甲醇;10~17 min,体积分数85%甲醇-体积分数25%磷酸二氢钾;17~20 min,体积分数100%甲醇。
标准曲线的绘制:取腺嘌呤核糖核苷酸(AMP)、5′-肌苷酸(IMP)各0.01 g,用超纯水溶解,定容到100 mL,得到质量浓度为100 μg/mL的标准使用液。取标准使用液1.00、2.00、4.00、6.00、8.00、10.00 mL,加入超纯水定容至10 mL,混匀,配制质量浓度梯度分别为10、20、40、60、80、100 μg/mL的标准液。进样20 μL,于254 nm处测量峰高和峰面积,每个质量浓度重复进样3次,取平均值。以质量浓度为横坐标,色谱峰面积为纵坐标,绘制标准曲线。
样品处理:称取5 g蓝蛤酶解液加入15 mL质量分数为5%的高氯酸,匀浆后于4 ℃、8 674 r/min离心10 min,取上清液。沉淀中加入10 mL质量分数为5%的高氯酸,相同条件匀浆离心。合并2次上清液,用5 mol/L KOH调pH值至6.75,超纯水定容至50 mL,吸取1 mL样品稀释液,0.22 μm滤膜过滤。
1.3.5鲜味评价方法
味精当量(EUC)[14]的计算见式(2)。
w(EUC)=∑w(ai)bi+
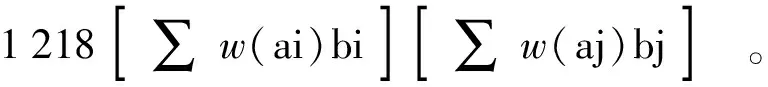
(2)
式(2)中,w(EUC),味精当量,g/100g;w(ai),鲜味氨基酸(Asp、Glu)的质量分数,g/100g;bi,鲜味氨基酸相对于味精的相对鲜度系数(Glu为1.000,Asp为0.077);w(aj),呈味核苷酸(IMP、AMP)的质量分数,g/100g;bj呈味核苷酸相对于IMP的相对鲜度系数(IMP为1.00,AMP为0.18);1 218,协同作用系数。
1.3.6有机酸的测定
色谱条件[15]:C18柱(5 μm,4.6 mm×250 mm);流动相为0.01 mol/L磷酸二氢钾水溶液(pH值2.8)、甲醇(体积比95∶5),临用前超声波脱气;流速0.5 mL/min;进样量10 μL;紫外检测器波长205 nm;时间15 min。
标准曲线的绘制:取琥珀酸、苹果酸、柠檬酸、乳酸各0.01 g,溶于超纯水,定容到100 mL。取标准使用液0.50、1.00、2.00、5.00、10.00 mL,加入超纯水定容至10 mL,混匀。进样10 μL,于205 nm处测量峰高和峰面积,每个质量浓度重复进样3次,取平均值。以有机酸质量浓度为横坐标,色谱峰面积为纵坐标,绘制标准曲线。
样品处理:取5 g样品加入0.25 mL质量分数5%高氯酸,混匀静置20 min,9 143 r/min冷冻离心10 min,吸取1 mL上清液,用0.45 μm滤膜过滤。
1.3.7电子舌测定
参照吴浩等[16]方法并改进。将蓝蛤酶解液按体积比稀释10倍,0.45、0.22 μm的滤膜过滤,取80 mL样液置于电子舌测试杯中,对苦、鲜及其回味进行测定。以参比液(30 mmol/L KCl和0.3 mmol/L酒石酸)为空白对照。
1.3.8GC-MS测定
样品萃取[17]:取5 mL样液,装入固相微萃取小瓶,加入转子,密封,50 ℃水浴平衡10 min,插入固相微萃取针头,推动手柄,纤维头为顶空状态,吸附30 min,进样。
色谱条件:Agilent 7890N型气相色谱仪,HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度为250 ℃;载气为氦气,流速1.5 mL/min;不分流模式进样;升温程序为起始温度40 ℃,保持4 min,以5 ℃/min的速率上升至90 ℃,保持5 min,再以升温速率5 ℃/min上升至230 ℃,保持3 min。
质谱条件:电离方式为电子轰击(EI源),电子能量70 eV;色谱-质谱接口温度280 ℃,离子源温度230 ℃,四极杆温度150 ℃;质量扫描范围m/z30~550 u。
1.3.9蓝蛤蛋白SDS-PAGE测定
参考秦军委等[18]的方法改进后进行SDS-PAGE分析。
1.3.10蓝蛤蛋白内源荧光测定
用20 mmol/L Tris-HCl缓冲溶液(含0.6 mol/L NaCl,pH值7.2)将样品质量浓度调整到0.25 mg/mL,采用荧光分光光度计测定荧光强度。测定条件:激发波长295 nm,狭缝均为5 nm,扫描速度1 000 nm/min,扫描范围250~350 nm,灵敏度为2,以缓冲溶液为空白对照。
1.3.11蓝蛤蛋白紫外光谱测定
用20 mmol/L Tris-HCl缓冲溶液(含0.6 mol/L NaCl,pH值7.2)将样品质量浓度调整到0.1 mg/mL,采用紫外可见光分光光度计测定光谱。测定条件:扫描范围200~340 nm,以缓冲溶液为空白对照[19]。
1.3.12蓝蛤蛋白傅里叶变换红外光谱测定
取适量样品(冻干粉末)与100 mg KBr(质量比1∶100)混合,研磨,压片。使用傅里叶变换红外光谱仪在4 000~400 cm-1进行检测,分辨率4 cm-1,室温20 ℃,累计扫描10次,记录数据[19]。
1.3.13蓝蛤蛋白扫描电镜观察
取适量蓝蛤蛋白粉粘贴在样品铜台(铜台事先贴好5 mm×3 mm×1 mm电镀胶),离子溅射仪镀膜喷金,电镜观察。测试条件为加速电压10 kV,能量分辨率Mn Kα 132 eV[20]。
1.4 数据处理
每个处理进行3次重复,采用软件SPSS 19.0进行ANOVA分析和正交试验数据分析,P<0.05为差异显著,采用Origin 9.1软件绘图。
2 结果与分析
2.1 不同超高压处理对酶活的影响
图1表示不同压力处理后风味蛋白酶和复合蛋白酶酶活的变化。风味蛋白酶在压力250 MPa(60 min)的条件下酶活最高,其酶活力为1 843.95 U/g,比常压增大了728.66 U/g,是常压的1.65倍,结果差异显著;复合蛋白酶在压力250 MPa(60 min)条件下酶活虽然与常压相比差异不显著,但其酶活力却为最高(19 615.59 U/g),是常压的1.07倍,说明超高压处理能改变风味蛋白酶和复合蛋白酶酶活。
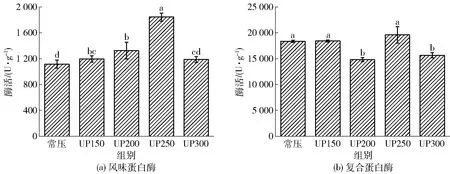
不同小写字母表示差异显著(P<0.05)。
由图1可知,随着压力的增大,风味蛋白酶酶活呈先上升后下降的趋势,尤其在300 MPa时,其活性迅速下降,低于常压酶活。进一步证明:在一定的压力范围内可以激活酶的活性,但是高于一定的压力又会抑制酶的活性。施加压力,风味蛋白酶三级结构可能被改变,酶活性中心暴露,其物化特性和化学反应速度被激活或抑制[21]。
综合来看,在250 MPa、60 min的条件下可提高复合蛋白酶和风味蛋白酶的酶活。较之复合蛋白酶,超高压对风味蛋白酶的酶活激活作用更强(差异显著),这也可能会改善酶解液的风味。
2.2 不同超高压处理对游离氨基酸的影响
表1是不同压力处理条件下酶解液的游离氨基酸组成及质量分数。由表1可知,超高压处理后的酶解液中游离氨基酸质量分数都要高于常压处理组,且绝大多数游离氨基酸质量分数在200 MPa(60 min)时有最大值。对比常压酶解液和不同超高压处理的酶解液可知,不同压力处理组总游离氨基酸(TAA)质量分数和必需氨基酸(EAA)质量分数均大于常压酶解液,而EAA/TAA几乎无变化。这说明超高压处理可以提高酶解液中氨基酸质量分数,而不改变其比例。
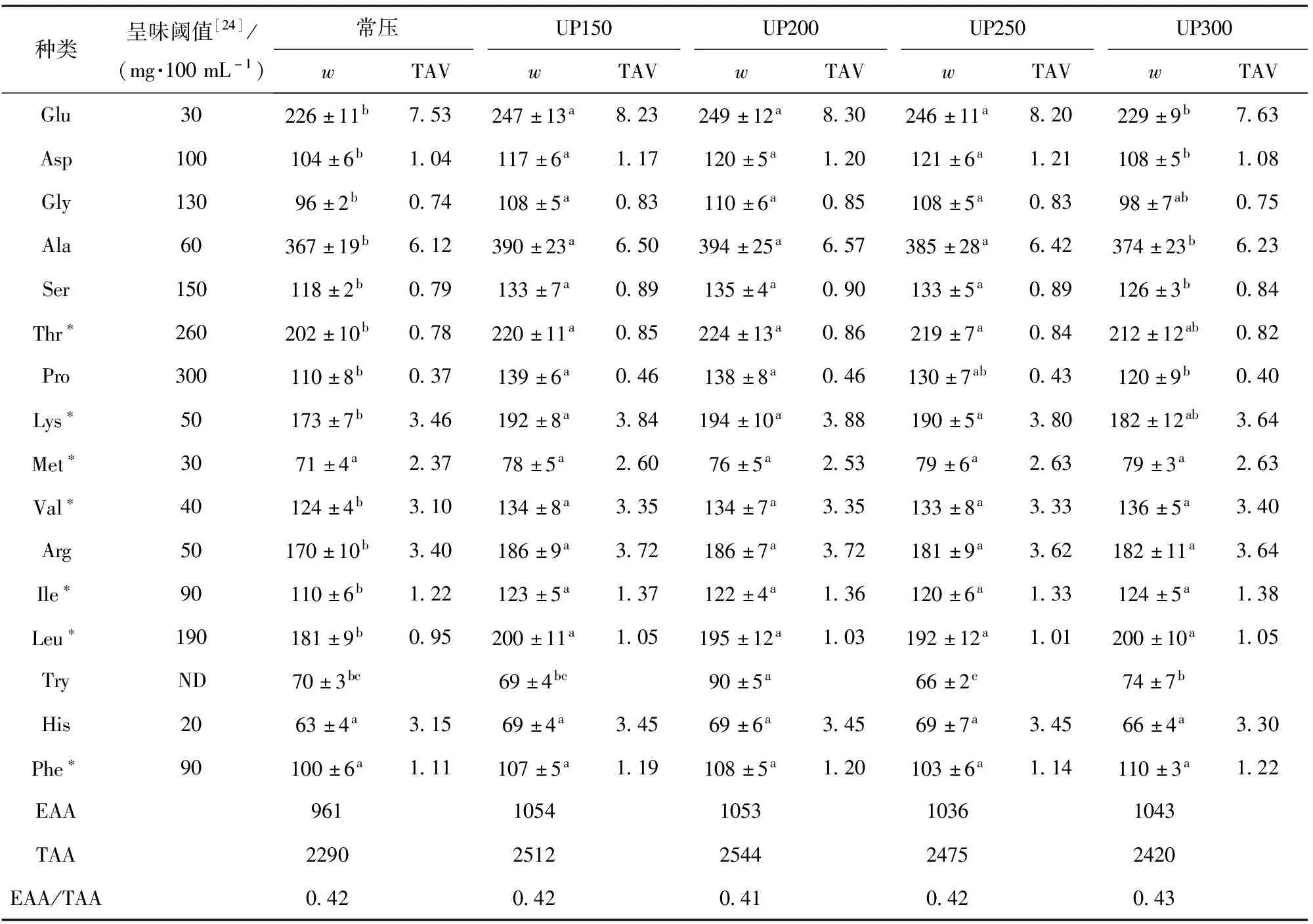
表1 不同压力处理对蓝蛤酶解液游离氨基酸质量分数的影响
结合TAV值可知,当TAV>1时,表示该物质对样品的呈味起主要贡献,且数值越大,影响越显著[22]。各处理组除Gly、Ser、Thr、Pro和Leu外,其他游离氨基酸TAV均大于1,其中鲜味氨基酸(Glu、Ala)TAV均大于6;因此,Glu和Ala对酶解液的呈味有重要影响,且影响显著[23]。苦味氨基酸(Lys、Met、Val、Ile、Leu、His、Phe)TAV均小于4。Ala的TAV大于6,是甜味氨基酸中TAV值最大的,Ala作为提鲜的协同游离氨基酸,也有重要贡献。根据测定结果,可以推测超高压处理可能使酶切位点暴露,增加水解度,从而提高酶解液中的游离氨基酸质量分数,改善酶解液的风味。
氨基酸通常呈现鲜味、甜味、苦味和硫味等不同滋味。图2表示不同压力处理对蓝蛤酶解液中5类呈味氨基酸质量分数的影响。从图2可以看出,鲜味、甜味、苦味、咸味、酸味氨基酸质量分数均呈先上升后下降的趋势,在200 MPa(60 min)出现峰值,分别为873、1 187、988、369、438 mg/100 g,占总游离氨基酸质量分数的34.32%、46.66%、38.84%、14.50%、17.22%。其中鲜味、甜味、苦味氨基酸质量分数较高,咸味、酸味氨基酸质量分数较低,且超高压处理组的5类呈味氨基酸质量分数均高于常压处理组。由此推断,相较于常压酶解,超高压处理对酶解液滋味成分的贡献较大,可改善酶解液滋味。
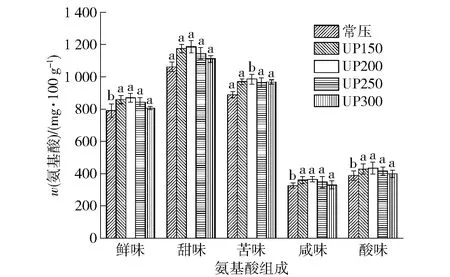
鲜味氨基酸:Glu、Asp、Gly、Ala;甜味氨基酸:Gly、Ala、Ser、Thr、Pro、Arg;苦味氨基酸:Lys、Met、Val、Ile、Leu、Try、His、Phe;咸味氨基酸:Glu、Asp;酸味氨基酸:Glu、Asp、His。不同小写字母表示差异显著(P<0.05)。
2.3 不同超高压处理对核苷酸质量分数的影响
表2是不同压力处理下酶解液中IMP和AMP的质量分数。IMP一般与其他物质起协同增鲜、增香的作用[25]。由表2可知,5种酶解液中IMP质量分数在250 MPa最高,为176.30 μg/100 g,说明超高压处理可以改善酶解液风味。对比超高压处理组和常压处理组,随着压力的增加,IMP质量分数呈先下降后上升的趋势;UP250和UP300组IMP质量分数远高于常压处理组,差异显著(P<0.05)。

表2 不同压力处理对蓝蛤酶解液核苷酸质量分数的影响
酶解液中AMP质量分数高于IMP,各处理组差异显著(P<0.05)。其中250 MPa时质量分数最高,为4.03 mg/100 g。在300 MPa时AMP质量分数最小,且小于常压,为2.48 mg/100 g。这可能是高压抑制酶活,蛋白质结构被严重破坏导致。
2.4 不同超高压处理对EUC的影响
呈味氨基酸与呈味核苷酸可产生协同效应,显著提高食品的鲜味,为了更加全面地评价蓝蛤酶解液的鲜味,可采用EUC评价鲜味强度[26]。常压、UP150、UP200、UP250、UP300组的EUC值大小分别为0.41、0.43、0.47、0.53、0.44 g/100 g。味精呈味阈值为0.03 g/100 g,各组酶解液EUC值均高于味精呈味阈值,且超高压处理组大于常压组。因此,可利用超高压酶解工艺提取蓝蛤中的呈味物质,为后期生产味精替代品提供了一定的理论支撑。
2.5 不同超高压处理对有机酸质量浓度的影响
表3表示不同压力处理对蓝蛤酶解液中有机酸质量浓度的影响,差异显著(P<0.05)。从表3可以看出,与常压组相比,乳酸质量浓度随着压力的增大而减少,在150 MPa出现最大值(3.75 mg/mL);琥珀酸质量浓度随着压力的增大而增加,在300 MPa出现最大值(8.77 mg/mL),即施加不同压力,乳酸质量浓度减少,琥珀酸质量浓度增加。结合TAV值可得,乳酸和琥珀酸TAV值均大于1,说明有机酸单独存在时,在酶解液中呈味贡献大,尤其是琥珀酸。琥珀酸及其钠盐(如琥珀酸二钠,又称干贝素),是海产品中重要的呈鲜物质。琥珀酸二钠是被批准的唯一的有机酸类增味剂,已被广泛使用[27]。结合游离氨基酸和核苷酸结果可得,蓝蛤酶解呈味物质为有机酸和游离氨基酸,其中琥珀酸TAV值远大于游离氨基酸和核苷酸,说明在贝类酶解液中琥珀酸为主要呈味物质。有研究表明:低质量浓度的琥珀酸对谷氨酸钠有相乘作用,并且可以提高产品喜好度[28],本研究酶解液中谷氨酸和琥珀酸相互作用,可以提高酸解液的鲜味值并提高产品喜好度。超高压酶解可能是通过增加酶解液中的琥珀酸含量来提高酶解液的鲜味值。
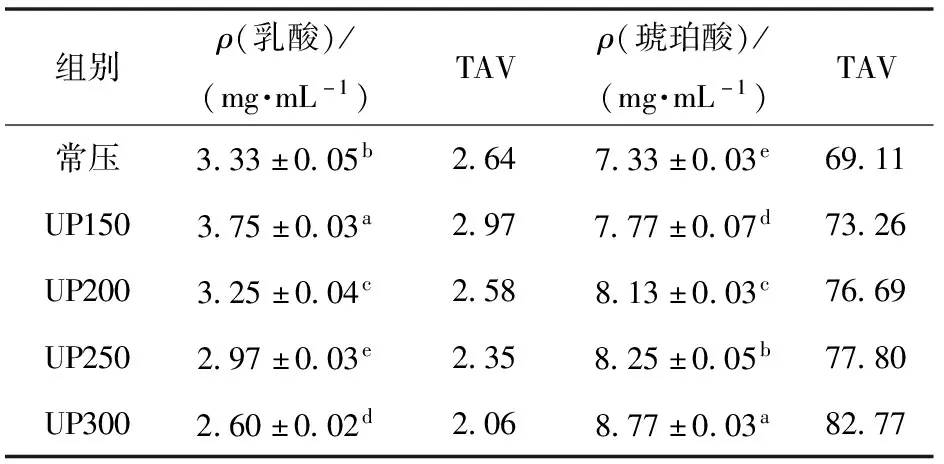
表3 不同压力处理对蓝蛤酶解液有机酸质量浓度的影响
2.6 电子舌结果分析
电子舌通过模拟人的味觉识别系统,可以在量化感官数据的基础上评价体系的一致性,更能具体地反映蓝蛤酶解液的滋味轮廓。图3表示不同压力对蓝蛤酶解液电子舌鲜味值影响的雷达图。从图3可以看出,超高压处理组的鲜味值要大于常压组,且随着压力的增大,电子舌鲜味值呈先上升后下降的趋势,且在250 MPa(60 min)时出现最大值,为13.64,进一步证明超高压对改善水产品酶解液风味有显著效果。
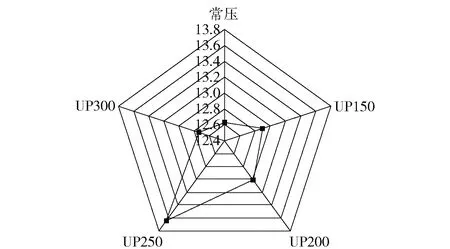
图3 不同压力处理蓝蛤酶解液的鲜味雷达图
表4表示UP250超高压处理组与常压处理组的蓝蛤酶解液苦味、鲜味及其回味值差异。从表4可以看出,经过超高压处理后,酶解液苦味及其回味降低,鲜味及其回味增加,进一步证明超高压对改善水产品酶解液风味有显著效果。

表4 苦味、鲜味及其回味结果
2.7 GC- MS结果分析
不同压力处理组和常压组的挥发性成分及相对含量如表5。由表5可知,鉴定出48种挥发性物质,分别是醇类、醛类、酮类、酯类、酚类、芳烃类、烷烃类和其他类。其中常压处理组检测出35种挥发性化合物,UP150组有35种,UP200组有28种,UP250组有30种,UP300组有31种。
由表5可以看出,超高压处理后,芳烃类化合物的种类和相对含量明显增加,其中在超高压处理组检测到具有芳香气味的苯乙烯。醛类阈值较低,具有清香、果香和坚果香等特征风味,是食品中重要的挥发性成分[29]。醛类物质在超高压处理前后数量减少,其中有恶臭的3-甲硫基丙醛变成了癸醛,苯甲醛含量减少,说明超高压处理使得酶解液风味得到改善。醛是脂肪热降解的产物,醛类物质种类与含量的减少可能是由于醛属于不稳定的中间体化合物,在施加不同压力时,蓝蛤肉和酶的结构被破坏及分子内部化学环境改变导致的。酮类作为另一种重要的呈味物质,具有水果、草、油和花的香味,在水解产物也起着重要作用,主要是脂肪酸的自动氧化或由Strecker反应产生的氨基酸降解形成的[30],适量的酮类贡献甜的花香和果香风味,而过量的酮类则会产生不良气味。
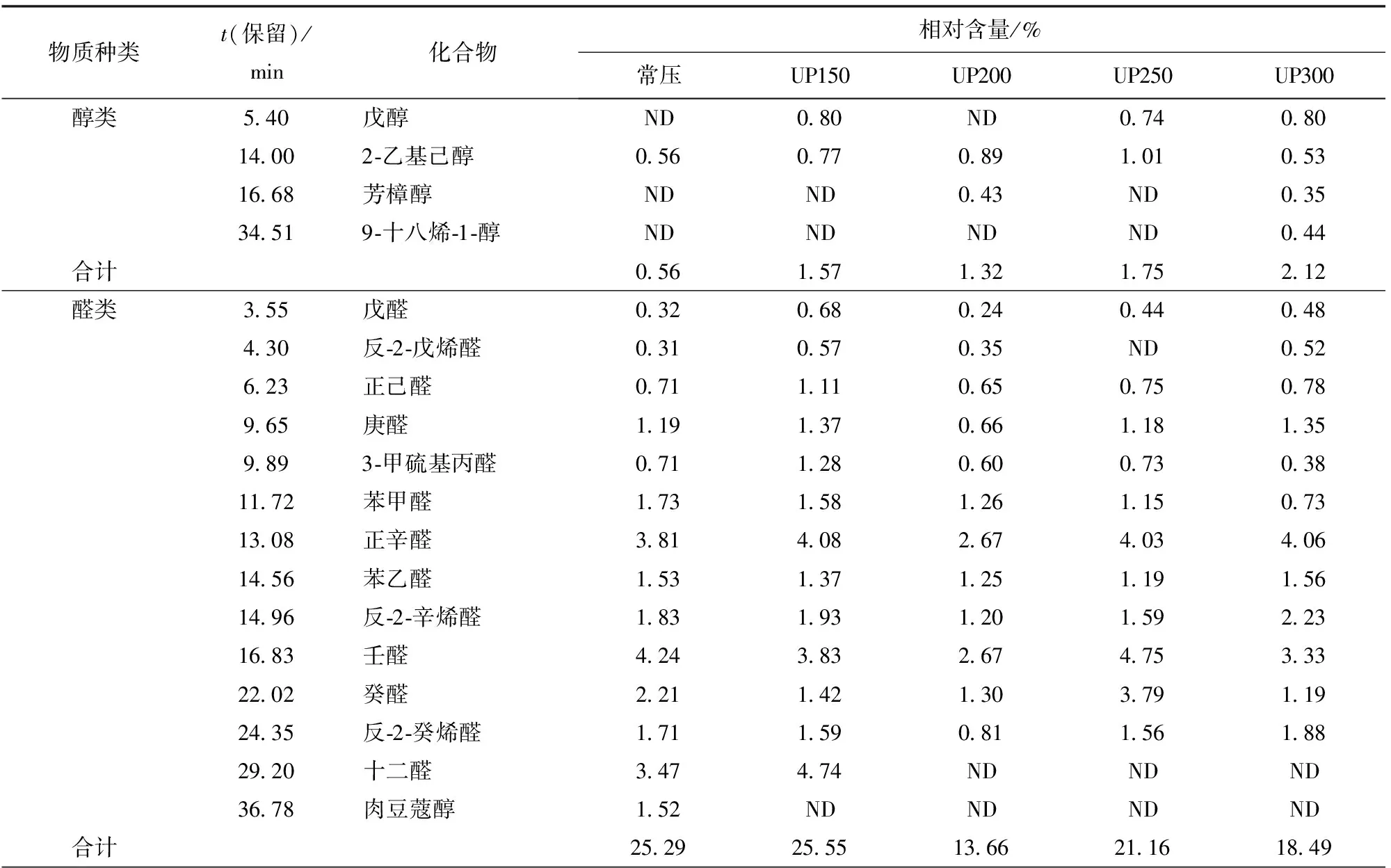
表5 不同压力处理蓝蛤酶解液GC-MS结果分析
2.8 超高压处理蓝蛤蛋白SDS- PAGE分析
图4为不同压力处理蓝蛤肌原纤维蛋白SDS-PAGE分析。200、100、50、43、35~38、32、18 kDa分别为重链肌球蛋白、副肌球蛋白、肌间线蛋白、肌动蛋白、原肌球蛋白、肌钙蛋白和轻链肌球蛋白[31]。蓝蛤蛋白主要由重链肌球蛋白、副肌球蛋白和肌钙蛋白组成。随着压力的增大,重链肌球蛋白、副肌球蛋白条带在300 MPa时变粗;肌钙蛋白条带变浅,并消失。这是因为大分子蛋白质不能进入分离胶,经高压长时间处理,内源酶被激活,蓝蛤蛋白三、四级结构逐渐被破坏,加速蛋白质降解,出现大分子的肽键断裂及小分子化合物的降解,使大分子变小,小分子进一步解离,进而重链肌球蛋白、副肌球蛋白等蛋白质的含量增大,条带逐渐变粗,肌钙蛋白含量减小,条带变浅、消失[20]。结果表明:超高压处理可以改变蓝蛤蛋白三、四级结构,使蛋白质氢键、二硫键、疏水作用和静电作用发生变化,二聚酪氨酸聚集,从而蛋白质发生聚集、交联或解离。
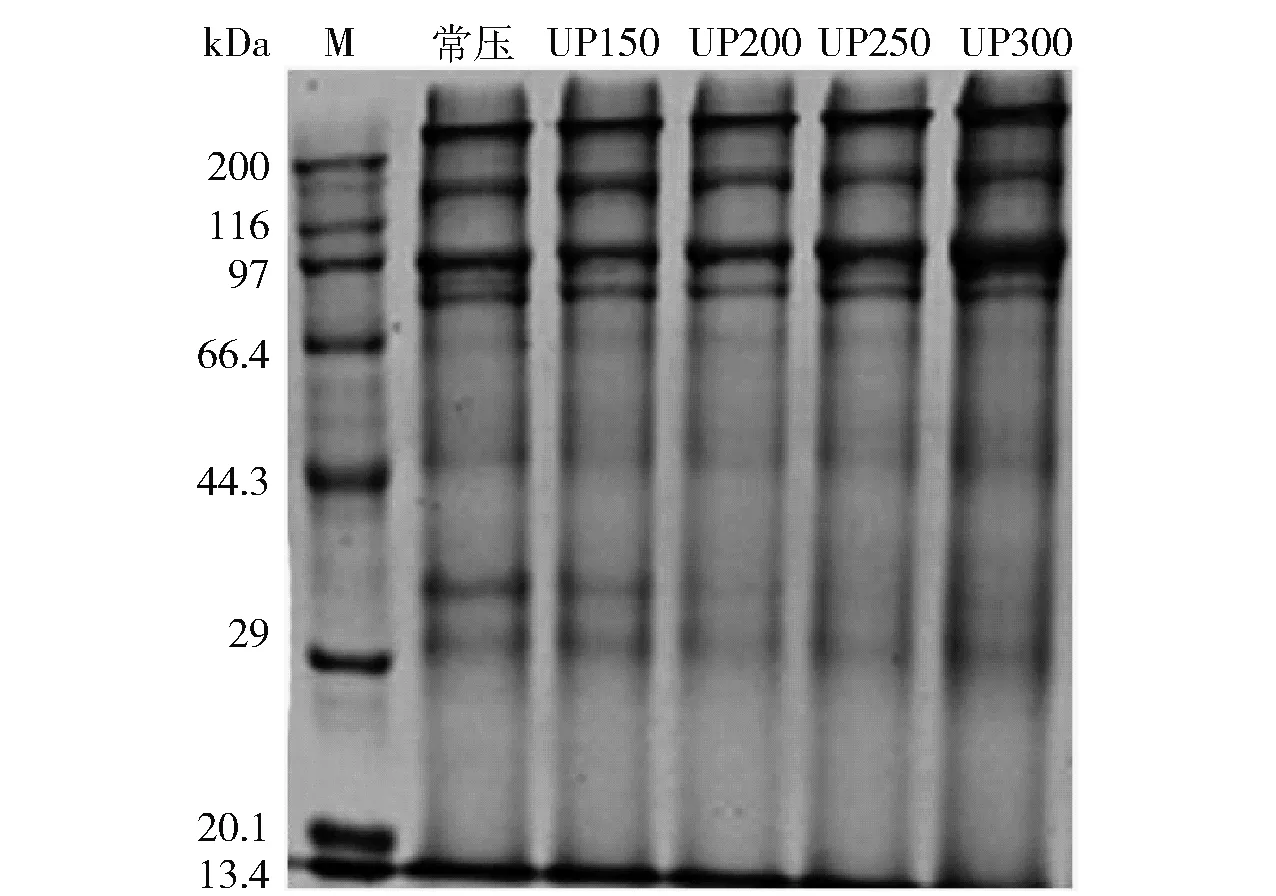
M:标准蛋白。
2.9 不同超高压处理对蓝蛤蛋白紫外光谱的影响
为了解不同压力处理后蓝蛤蛋白相关基团的空间位置变化和推测分子的构象变化,本研究进行了紫外光谱测定,如图5。结果表明:不同压力处理后,蓝蛤蛋白在200~340 nm,经过150~250 MPa处理后的蛋白质吸收峰减小;在300 MPa处理后,吸收峰增加。该现象发生的原因可能是当压力超过250 MPa时,蛋白质结构被破坏,暴露在分子内的基团和区域增加,发色基团暴露,所以紫外吸收峰增强[32-34]。此外,蛋白质的最大吸收峰出现蓝移。这些变化表明:超高压处理后,蛋白质的微环境和结构发生了变化,可能导致蛋白质向负向移动或变性,使蛋白质的吸收低于对照组。其次,与对照组相比,在超高压处理期间,由于色氨酸、酪氨酸和苯丙氨酸被破坏,导致蛋白质空间结构变化,使其在250~280 nm处几乎没有出峰。
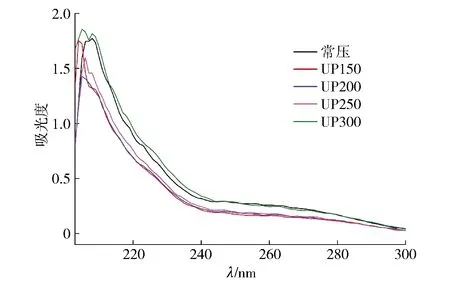
图5 不同压力处理对蓝蛤蛋白紫外吸收光谱的影响
2.10 不同超高压处理对蓝蛤内源荧光的影响
芳香族氨基酸链在特定的激发光下发出荧光,是一种内部荧光物质,对过渡过程中的微环境极敏感,如图6。图6中色氨酸的特征吸收峰位于298 nm左右。结果表明:随着压力的增加,色氨酸的吸收波长呈上升的趋势,荧光强度明显增强,在150~200 MPa时上升缓慢,250~300 MPa时上升迅速。内源荧光结果证明:超高压处理后,色氨酸残基被疏水环境包围,引起色氨酸暴露,使蓝蛤蛋白表面色氨酸的数量增加。研究表明:超高压导致蛋白质结构发生了不同的构象变化,增加了疏水微环境中色氨酸的残留量。同时,超高压可以改变蛋白质分子空间排列,破坏疏水蛋白分子间的相互作用,导致疏水基团暴露[34],进而促进了蛋白质的水解。
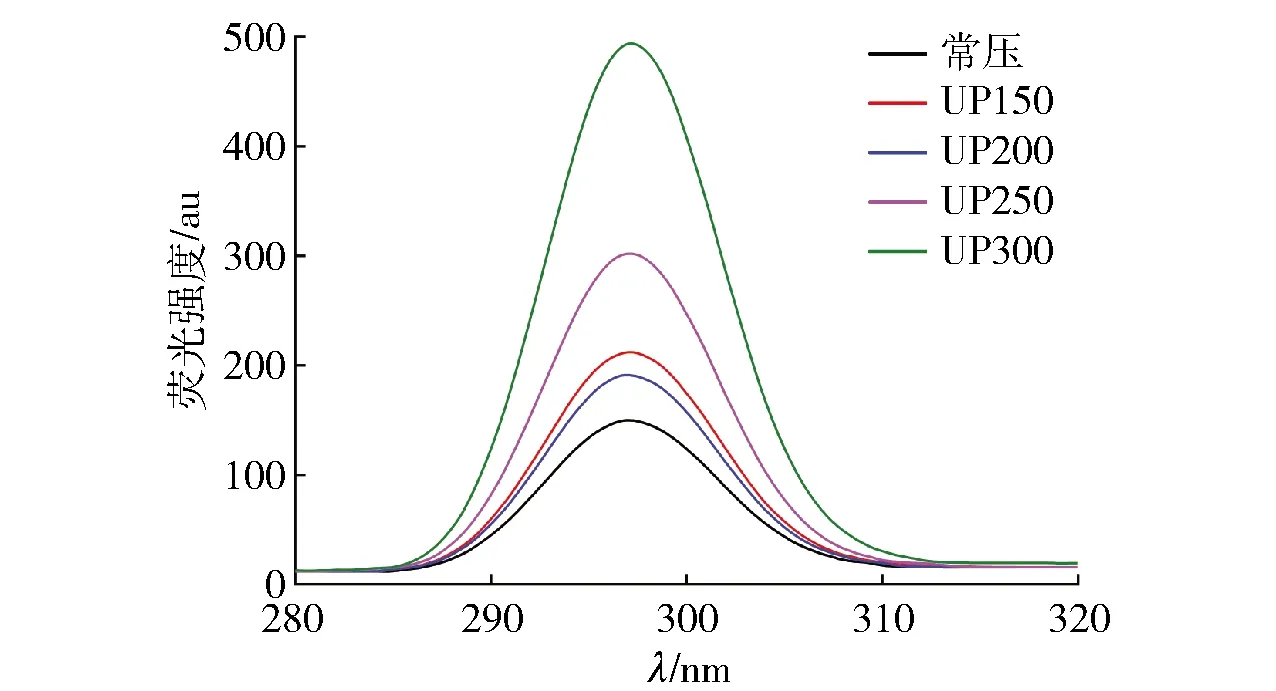
图6 不同压力处理对蓝蛤蛋白内源荧光强度的影响
2.11 不同超高压处理对蓝蛤蛋白红外光谱的影响

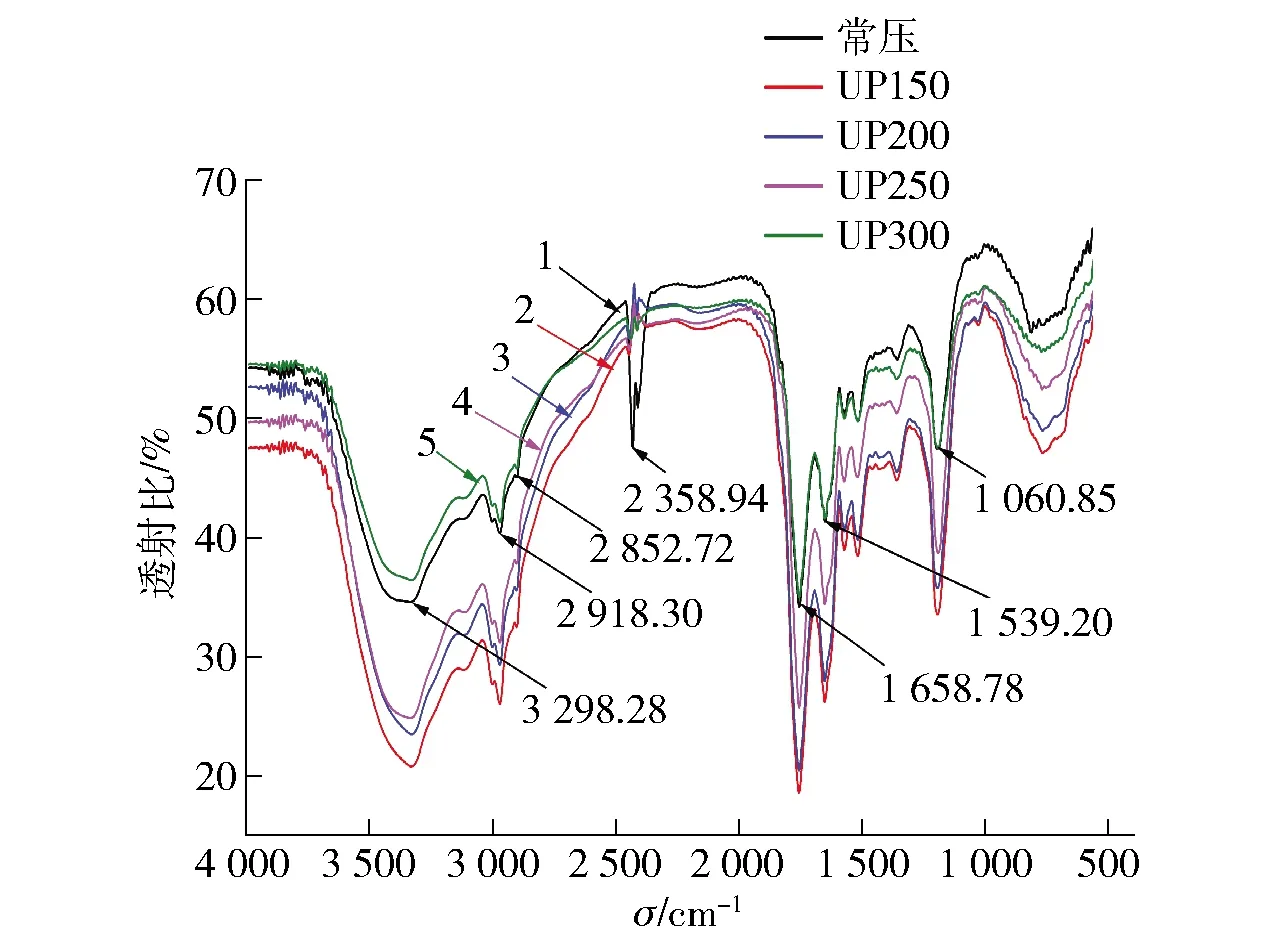
1.常压;2.150 MPa;3.200 MPa;4.250 MPa;5.300 MPa。
2.12 扫描电镜结果分析
图8表示不同压力处理后蓝蛤蛋白的扫描电镜结果。由图8可知,经过不同压力处理后蛋白质的微观结构存在显著差异。不经超高压处理的蛋白质表面结构致密,颗粒按大小分布,紧密连接,且大颗粒数量少,粒径偏小。施加一定压力后,蛋白质表面小颗粒结构消失,大颗粒结构出现,蛋白质颗粒出现粘连,孔洞消失,裂纹出现,说明超高压处理改变了蛋白质结构,蛋白质发生聚集、交联、解离,这与SDS-PAGE和红外光谱结果一致。

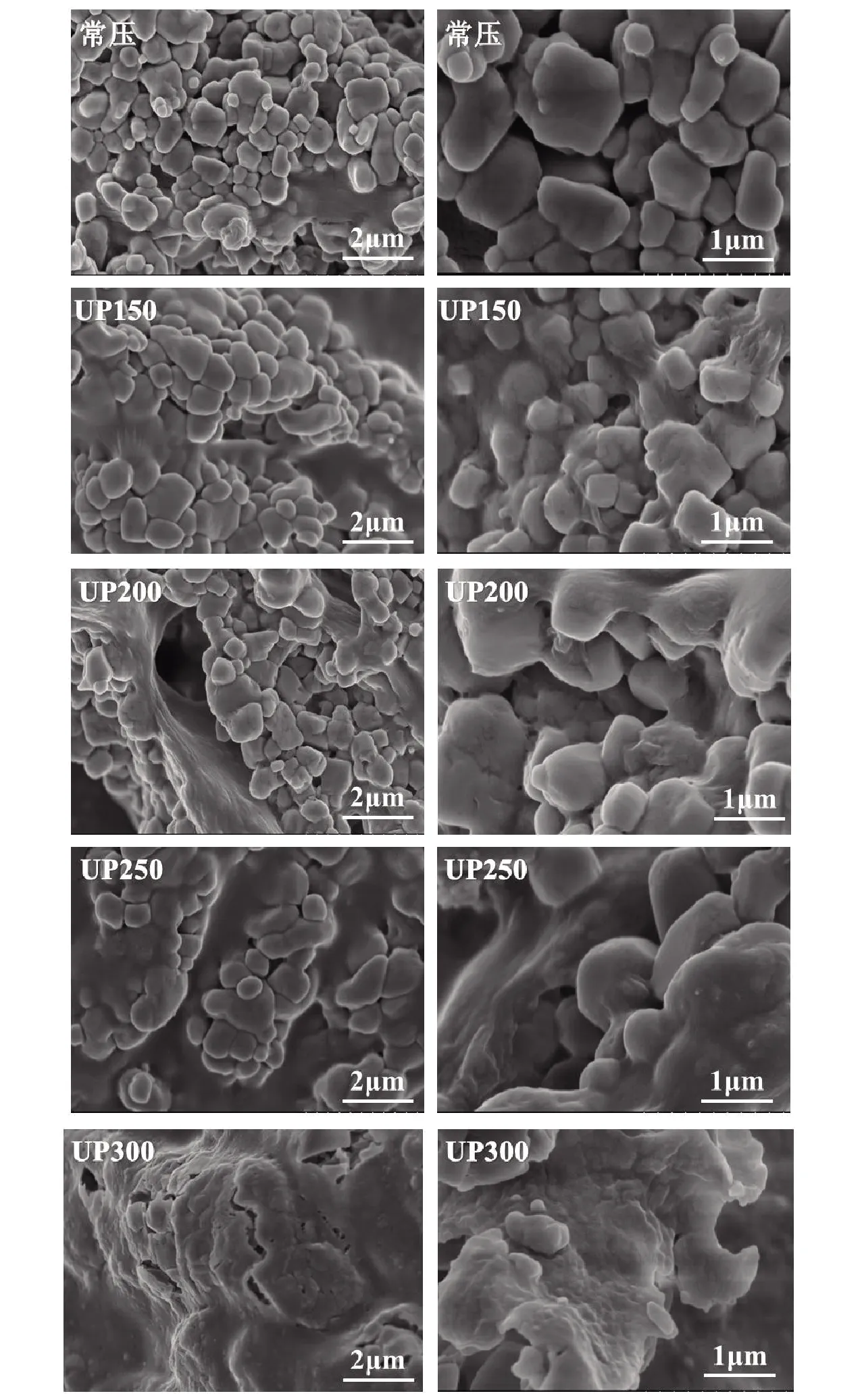
图8 不同压力处理蓝蛤蛋白扫描电镜照片
3 结 论
酶活研究发现:压力150~250 MPa对风味蛋白酶和复合风味蛋白酶有激活作用,而300 MPa时则表现为抑制作用。通过对蓝蛤酶解液滋味、气味成分分析发现:超高压酶解可提高蓝蛤酶解液的鲜味,降低苦腥味,改变挥发性物质的组成,从而达到增香的作用。蛋白质结构分析发现:超高压能破坏蓝蛤蛋白质三、四级结构,导致蛋白质空间结构变化。因此推测,超高压处理可能是通过提高蛋白酶活性,破坏蛋白质结构,增加了蛋白质水解度,促进了呈味氨基酸、核苷酸、有机酸等的释放,改善了酶解液的风味。
