北工商海洋杆菌诱导戊糖片球菌产生细菌素及降黄酒生物胺功效研究
2021-02-02郝淑月
郝淑月, 任 清
(北京工商大学 轻工科学技术学院,北京 100048)
生物胺(biogenic amines,BA)是一类低分子质量的含氮碱性有机化合物的总称,普遍存在于发酵食品中[1-2],主要由发酵过程中产生的氨基酸经脱羧酶催化生成,包括以腐胺、尸胺、精胺和亚精胺为主的脂肪族生物胺,以酪胺和苯乙胺为主的芳香族生物胺,以组胺和色胺为主的杂环类生物胺等。少量生物胺为生物体内的正常活性成分,但若人体过量摄入外源生物胺,会发生中毒反应,严重时还会危及生命[3-6]。据报道,摄入8~40 mg组胺会导致轻微中毒,摄入40 mg以上组胺引发中度中毒症状,酪胺在人体内含量超过100 mg时,会引发偏头痛[7-8]。
黄酒是我国特有的具有悠久历史的发酵酒,其独特的发酵工艺极易产生生物胺[9-10],一方面,黄酒酿造常用的原料为小麦、糯米、黍米和小米等谷物,蛋白质含量高,发酵过程中产生大量的游离氨基酸;另一方面,传统黄酒生产采用开放式的半固态发酵,极易污染杂菌,这些杂菌往往是产生物胺菌,能够分泌氨基酸脱羧酶,将游离氨基酸脱羧转化为生物胺。黄酒的生物胺平均质量浓度高达115 mg/L[11],远高于啤酒和葡萄酒中的生物胺平均质量浓度(啤酒中平均质量浓度为19.3 mg/L,葡萄酒中平均质量浓度为8.92 mg/L)[12]。因此,降低生物胺含量已经成为黄酒生产中质量控制的重要目标。
针对黄酒生物胺合成途径,生产上通常采用改进生产工艺来控制生物胺,例如采用乳酸菌的生物酸化浸米技术、调整贮藏温度和控制游离氨基酸含量等技术[13-15],虽然一定程度上降低了生物胺含量,但是,仍然不能满足黄酒质量安全的需求。随着黄酒发酵微生态系统研究的深入,发现发酵过程中的杂菌是生物胺主要产生菌,因此,筛选能够产生细菌素抑制杂菌的功能菌株,是黄酒生产中控制生物胺含量的有效途径。
本团队从黄酒酒曲中发现一株新菌种,命名为北工商海洋杆菌(Pontibacterbeigongshangensis)[16],对其生物学特性研究发现,该菌与戊糖片球菌共培养,可以诱导产生抑菌物质,本研究拟对此分析鉴定并对其降生物胺功效进行研究,以期为降低黄酒中生物胺含量提供理论依据和有价值的微生物菌种。
1 材料与方法
1.1 实验材料
黄酒麦曲2种,一种北宗黄酒有限公司提供,另一种由实验室自制;小麦和黍米,由张家口市农业科学院提供;糖化酶(100 000 U/g),江苏瑞阳生物科技有限公司;北工商海洋杆菌(CGMCC 1.17104)和戊糖片球菌M25,均从北宗黄酒麦曲中分离,保存于本研究团队实验室;腐生葡萄球菌、阪崎肠杆菌、乳酪短杆菌、芽孢杆菌和阴沟肠杆菌,均为本研究团队从黄酒发酵过程中分离出来的杂菌;芽孢杆菌、大肠杆菌、植物乳杆菌和酵母由本研究团队实验室收藏;LB培养基和MRS培养基均按照参考文献[17]的配方和方法配制。
生物胺检测显色培养基(g/L):胰蛋白胨5、酵母膏5、牛肉膏5、NaCl 2.5、葡萄糖0.5、Tween 80 1 mL、MgSO40.2、MnSO40.05、FeSO40.04、柠檬酸铵2、K2HPO42、CaCO30.1、磷酸吡多醛0.05、溴甲酚紫0.06、放线菌酮0.05,分别添加赖氨酸5.0(检测尸胺)、鸟氨酸盐酸盐5.0(检测腐胺)、L-组氨酸盐酸盐2.0(检测组胺)、色氨酸2.0(检测色胺)、酪氨酸1.0(检测酪胺)、苯丙氨酸2.0(检测苯乙胺),调pH值至5.3,121 ℃高压蒸汽灭菌15 min。
固体脱羧酶培养基(g/L):琼脂粉18.0,其他成分同生物胺检测显色培养基,pH=5.3,121 ℃高压蒸汽灭菌15 min。
1.2 实验方法
1.2.1牛津杯抑菌实验
采用牛津杯法分析菌株抑菌效果,指示菌株为腐生葡萄球菌、阪崎肠杆菌、乳酪短杆菌、芽孢杆菌和阴沟肠杆菌,芽孢杆菌、大肠杆菌、植物乳杆菌和酵母为待测菌株。
(1)分别将北工商海洋杆菌和戊糖片球菌M25单独接种于10 mL MRS液体培养基中,37 ℃下培养24 h,制备单培养菌液。
(2)分别将芽孢杆菌、大肠杆菌、植物乳杆菌和酵母与戊糖片球菌共同接种于10 mL MRS液体培养基中,37 ℃下培养24 h,制备共培养菌液。
(3)在灭菌的培养皿中注入约25 mL LB培养基,均匀铺满培养皿底部,待LB培养基凝固后,分别加入5种100 μL指示菌悬液,均匀涂布于培养皿上,在表面等间距放置灭菌的牛津杯。接着将100 μL菌株共培养或单培养发酵液注入牛津杯内,4 ℃下扩散3~5 h,然后将培养皿置于37 ℃培养24~36 h,观测抑菌效果。
1.2.2北工商海洋杆菌诱导戊糖片球菌生成细菌素的验证方法
1.2.2.1 排除有机酸的干扰
发酵上清液对指示菌的抑制作用可能是细菌素引起的,也可能是有机酸作用的结果,为排除酸的干扰,将北工商海洋杆菌与戊糖片球菌M25在MRS培养基中37 ℃下共培养24 h,10 000 r/min离心15 min,取上清液用2.5 mol/L的NaOH溶液中和至pH值达6.5~7.0,通过牛津杯双层平板法进行抑菌试验,向牛津杯中分别加入北工商海洋杆菌和戊糖片球菌共培养发酵上清液中和前以及中和后的液体100 μL,并在水平条件下将平板放于4 ℃冰箱中扩散4 h,置于37 ℃下培养24 h,分别检测两者的抑菌活性,比较中和酸前后抑菌效果,每次处理3次重复。
1.2.2.2 过氧化氢作用的检测与排除
将过氧化氢酶溶解于50 mmol/L的磷酸缓冲液(pH=7.0)中配成母液,加入经酸排除的北工商海洋杆菌和戊糖片球菌共培养上清液中,使过氧化氢酶的最终浓度达到5 mg/mL,37 ℃水浴2 h后取出,检测过氧化氢酶处理后上清液的抑菌效果,每次处理3次重复。
1.2.2.3 蛋白酶敏感实验
将蛋白酶K、胰蛋白酶胃、蛋白酶、酸性蛋白酶、中性蛋白酶分别溶解在50 mmol/L的磷酸缓冲液(pH=7.6)中配成母液,加入共培养菌株发酵上清液中,使其终浓度为1 mg/mL,调节pH值至各酶的最适作用范围,37 ℃水浴2 h后取出。再将pH值调回至6.5~7.0,并用缓冲液稀释相同倍数的发酵上清液作为对照,检测各种蛋白酶对发酵上清液抑菌活性的影响。
1.2.3北工商海洋杆菌液浓度对戊糖片球菌抑菌效果的评价
将北工商海洋杆菌接种于MRS培养基中分别培养4、8、12、24 h和36 h,10 000 r/min离心15 min,得不同浓度的上清液,加入戊糖片球菌M25培养液中培养,利用牛津杯抑菌实验进行抑菌效果评价。
1.2.4脱羧酶培养基显色反应
分别取活化后的北工商海洋杆菌和戊糖片球菌0.2 mL于固体脱羧酶培养基上进行涂布,37 ℃恒温培养箱中培养4 d, 观察颜色变化,黄色为阴性,红色或紫色为阳性。
1.2.5黄酒麦曲的制备
1.2.5.1 普通黄酒麦曲的制备
将小麦粉碎(单粒碎为4~6瓣),加入质量分数20%~30%的水,搅拌均匀,踏曲、堆曲,控制温度在45~50 ℃,自然发酵30 d即可。
1.2.5.2 原生强化功能曲的制备
北工商海洋杆菌扩培:称取1 kg黍米,浸泡24 h,按照1 kg黍米加3 kg水的比例煮熟原料,加黍米质量分数0.15%的糖化酶在60 ℃条件下糖化30 min,接种北工商海洋杆菌,37 ℃培养48 h,并进行多次搅拌。
戊糖片球菌M25扩培:称取1 kg黍米,浸泡24 h,按照1 kg黍米加3 kg水的比例煮熟原料,加黍米质量分数为0.15%的糖化酶在60 ℃条件下糖化30 min,接种戊糖片球菌M25,37 ℃培养48 h,并进行多次搅拌。
原生强化功能曲的制备:将小麦粉碎(单粒碎为4~6瓣),加入小麦质量分数20%~30%水,同时,加入北工商海洋杆菌和戊糖片球菌M25两种体积分数为1%的菌株扩培液,搅拌均匀,踏曲,堆曲,控制温度在45~50 ℃,自然发酵30 d即可。
1.2.6黄酒的酿造
1)浸米蒸煮:将1 kg黍米洗净并浸泡24 h,按照1 kg黍米加3 kg水的比例煮熟黍米(约1 h),使黍米变软无生芯。
2)糖化:将黍米质量分数为0.15%的糖化酶在60 ℃条件下活化5 min,当蒸煮后的黍米饭温度下降至60 ℃时加入活化的糖化酶,糖化30 min。
3)发酵:加入黍米质量分数16%的酒曲和0.15%的酵母拌匀,装入黄酒发酵罐中30 ℃下前发酵5~8 d,然后在13~17 ℃条件下后发酵(22~25 d)至1个月。
4)榨酒澄清:采用真空抽滤的方法过滤灭菌,静置2~3 d,弃底层混浊,得成品黄酒。
5)灭菌:85 ℃下高温灭菌30 min。
1.2.7生物胺含量的测定
按照1.2.5节酿造黄酒,采用HPLC的方法依据国家标准(GB 5009.208—2016《食品中生物胺含量的测定》)检测生物胺含量[18],比较普通麦曲酿造黄酒和原生强化功能曲酿造黄酒的生物胺含量差异,重复3次,进行差异显著性分析。
1.2.8黄酒挥发性风味物质的检测
黄酒挥发性风味物质的检测方法、色谱条件与参考文献[17]相同,比较普通麦曲酿造黄酒和原生强化功能曲酿造黄酒的挥发性风味物质的差异,重复3次,进行差异显著性分析。
1.2.9黄酒氨基酸态氮、非糖固形物、总糖、酒精度和酸度的检测
采用国家标准(GB/T 13662—2018《黄酒》)分析检测黄酒氨基酸态氮、非糖固形物、总糖、酒精度和酸度[19],比较普通麦曲酿造黄酒和原生强化功能曲酿造黄酒的氨基酸态氮、非糖固形物、总糖、酒精度和酸度,重复3次,进行差异显著性分析。
2 结果与分析
2.1 北工商海洋杆菌和戊糖片球菌共培养的抑菌功效
采用牛津杯法分析北工商海洋杆菌和戊糖片球菌共培养的抑菌效果,见图1、图2和表1。北工商海洋杆菌和戊糖片球菌共培养及其无菌发酵液均有抑菌活性,而这两种菌分别培养,其菌液和无菌发酵液均没有抑菌活性。戊糖片球菌分别与芽孢杆菌、大肠杆菌、植物乳杆菌、和酵母共培养,同样没有抑菌活性,说明只有北工商海洋杆菌和戊糖片球菌共培养才具有抑菌活性,产生的抑菌物质对腐生葡萄球菌、阪崎肠杆菌、乳酪短杆菌、芽孢杆菌和阴沟肠杆菌均具有抑制效果。
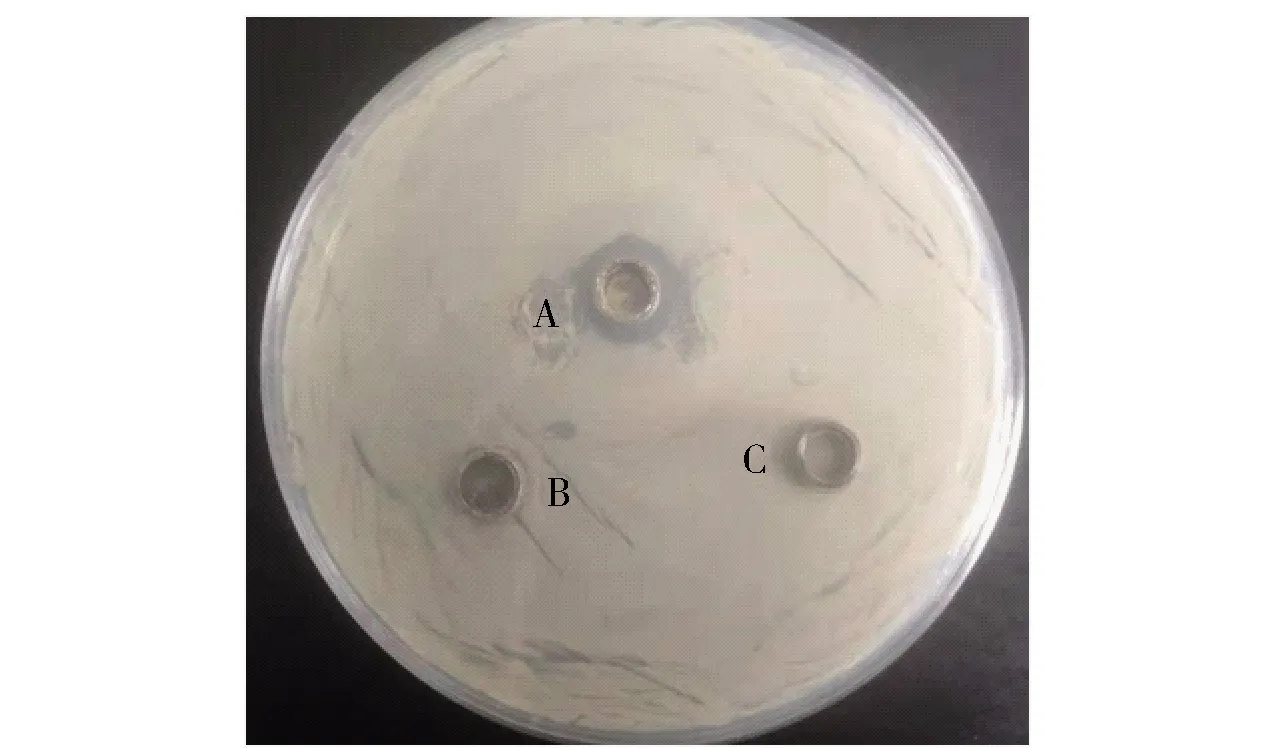
A为北工商海洋杆菌和戊糖片球菌共培养菌株;B为北工商海洋杆菌菌株;C为戊糖片球菌菌株。
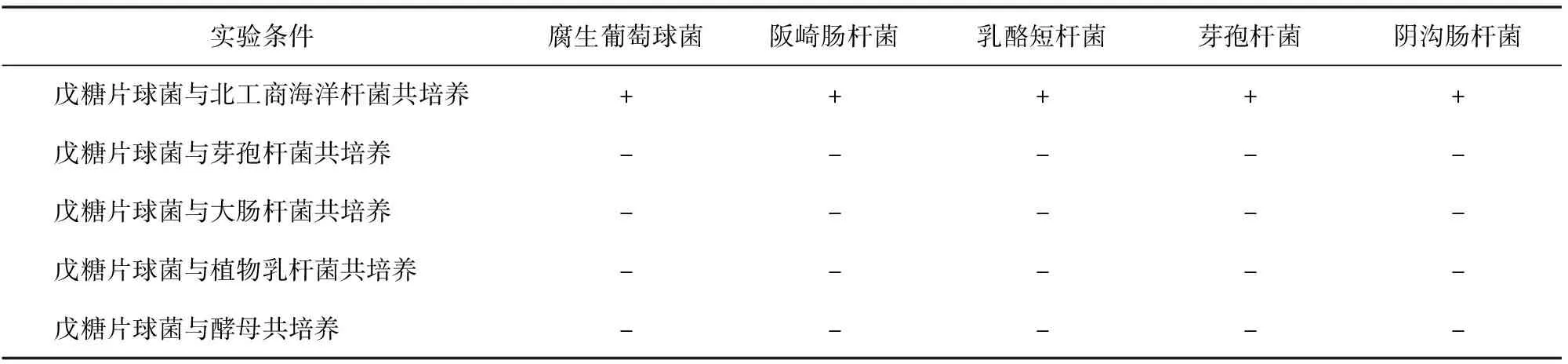
表1 戊糖片球菌共培养发酵抑菌实验
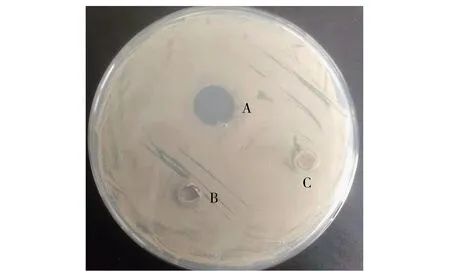
A为北工商海洋杆菌和戊糖片球菌共培养上清液;B为北工商海洋杆菌上清液;C为戊糖片球菌上清液。
2.2 北工商海洋杆菌诱导戊糖片球菌生成细菌素的验证分析
北工商海洋杆菌和戊糖片球菌分别单菌发酵,北工商海洋杆无菌发酵液添加到戊糖片球菌发酵液中培养,发酵产物具有抑菌活性;反之,戊糖片球菌无菌发酵液添加到北工商海洋杆菌发酵液中培养,发酵产物没有抑菌活性(见表2)。由此可知,抑菌物质是在北工商海洋杆菌的诱导下由戊糖片球菌发酵产生的。
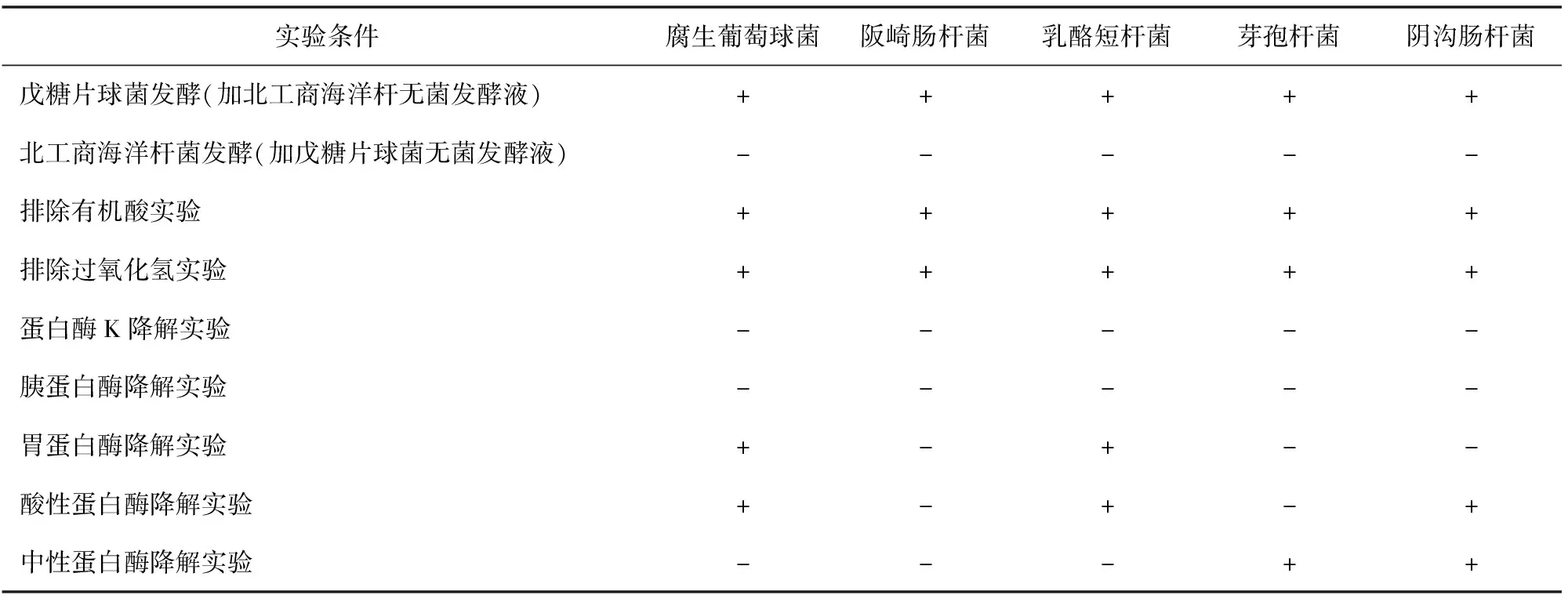
表2 细菌素的验证分析实验
排除有机酸和过氧化氢实验结果表明,抑菌特性不是因为发酵过程中产生的有机酸和过氧化氢引起的,而是因为北工商海洋杆菌的诱导下由戊糖片球菌产生了抑菌物质,经蛋白酶K和胰蛋白酶降解后,失去了抑菌活性,说明该物质为蛋白质或多肽,为细菌素类物质,该细菌素具有比较广谱的抑菌活性,而且对蛋白酶K和胰蛋白酶敏感,但是,对胃蛋白酶、酸性蛋白酶和中性蛋白酶的酶敏感性较弱。
2.3 北工商海洋杆菌培养液浓度对戊糖片球菌抑菌效果的影响
北工商海洋杆菌培养液浓度对戊糖片球菌抑菌效果的影响见表3,北工商海洋杆菌发酵培养前期,培养液浓度低,加入戊糖片球菌培养中,戊糖片球菌没有抑菌活性,随着北工商海洋杆菌培养时间的延长,直到24 h或36 h后,培养液浓度提高,可以刺激或诱导戊糖片球菌具有了抑菌活性。这说明北工商海洋杆菌培养液高浓度产生了某些物质,这些物质是诱导剂,诱导戊糖片球菌合成了细菌素。
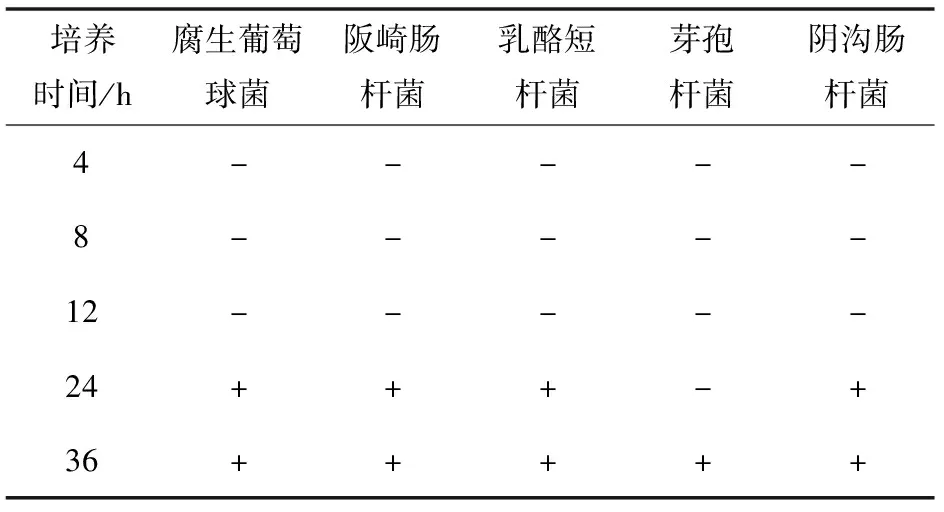
表3 北工商海洋杆菌培养液浓度对抑菌效果的影响
2.4 北工商海洋杆菌和戊糖片球菌产生物胺特性分析
脱羧酶培养基显色反应实验中,培养初期,细菌繁殖,利用葡萄糖产酸使培养液pH值下降,溴甲酚紫指示剂变黄色,继续培养,若细菌产氨基酸脱羧酶,则氨基酸在脱羧酶的作用下发生脱羧反应生成胺和二氧化碳,pH值上升呈碱性,使含指示剂的培养基由黄色变为紫色,由此,可通过培养基颜色变化判断细菌是否产生物胺。
脱羧酶培养基显色反应结果见表4,培养腐生葡萄球菌和阪崎肠杆菌,能够产腐胺、酪胺、尸胺、组胺和苯乙胺5种常见的生物胺;乳酪短杆菌产腐胺、酪胺、尸胺和组胺4种生物胺;芽孢杆菌产酪胺、尸胺、组胺和苯乙胺4种生物胺;阴沟肠杆菌产腐胺、酪胺、尸胺和苯乙胺4种生物胺。但是,北工商海洋杆菌和戊糖片球菌培养过程中没有检测到生物胺的产生,说明这两株菌自身不产生物胺。
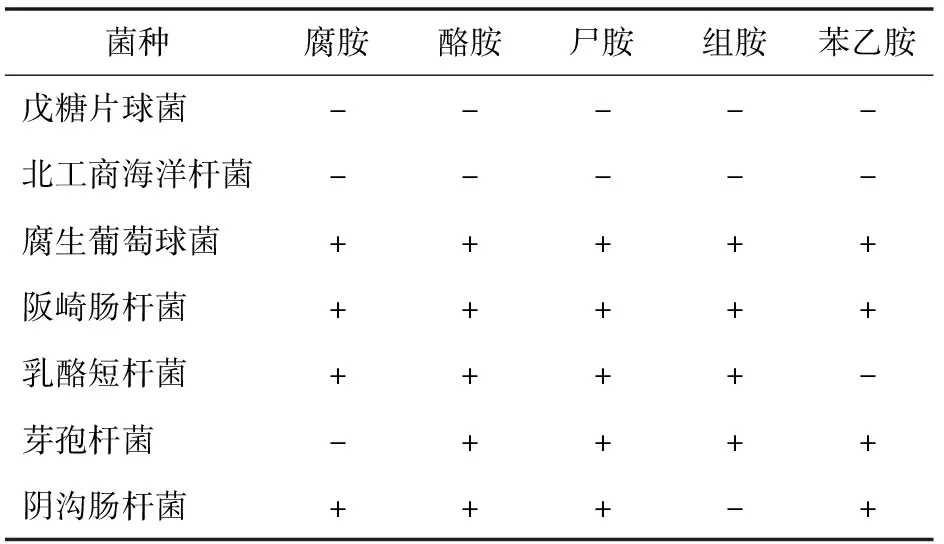
表4 生物胺显色反应实验
2.5 强化功能曲对黄酒生物胺的影响
添加北工商海洋杆菌和戊糖片球菌,制备强化功能曲,利用强化功能曲酿造黄酒,应用HPLC检测黄酒中的生物胺含量,实验结果如图3。强化功能曲酿造的黄酒与对照普通曲酿造的黄酒相比,各种生物胺含量均明显降低,生物胺总含量降低29.8%。表明添加强化北工商海洋杆菌和戊糖片球菌可以显著降低黄酒中的生物胺的含量,提高黄酒品质,可能是因为北工商海洋杆菌诱导戊糖片球菌产生细菌素,有效抑制了一些产生物胺杂菌的生长繁殖,而北工商海洋杆菌和戊糖片球菌本生不产生物胺,因此,应用强化功能曲酿造黄酒,可以显著降低黄酒中的生物胺含量。
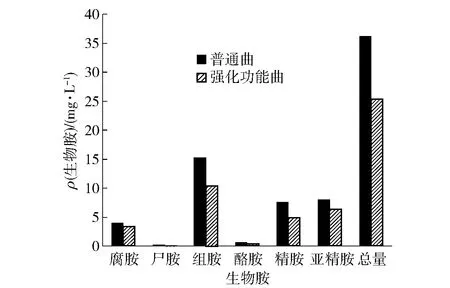
图3 2种黄酒中生物胺的含量
2.6 强化功能曲对黄酒风味品质的影响
添加北工商海洋杆菌和戊糖片球菌,制备强化功能曲,利用强化功能曲酿造黄酒,应用GC-MS检测黄酒中的香味物质,实验结果见表5和表6,强化功能曲酿造的黄酒中检测出烷烃类、醇类、酯类、酮类、醛类、酸类、吡嗪类、酚类和其他风味物质共105种,普通曲酿造的黄酒中,共检测出风味物质102种,而且风味物质除了酯类物质显著增加外,其他种类的风味物质和风味物质的总含量均没有显著差异。表明黄酒发酵工程中,强化添加北工商海洋杆菌和戊糖片球菌对黄酒的风味品质基本没有影响。
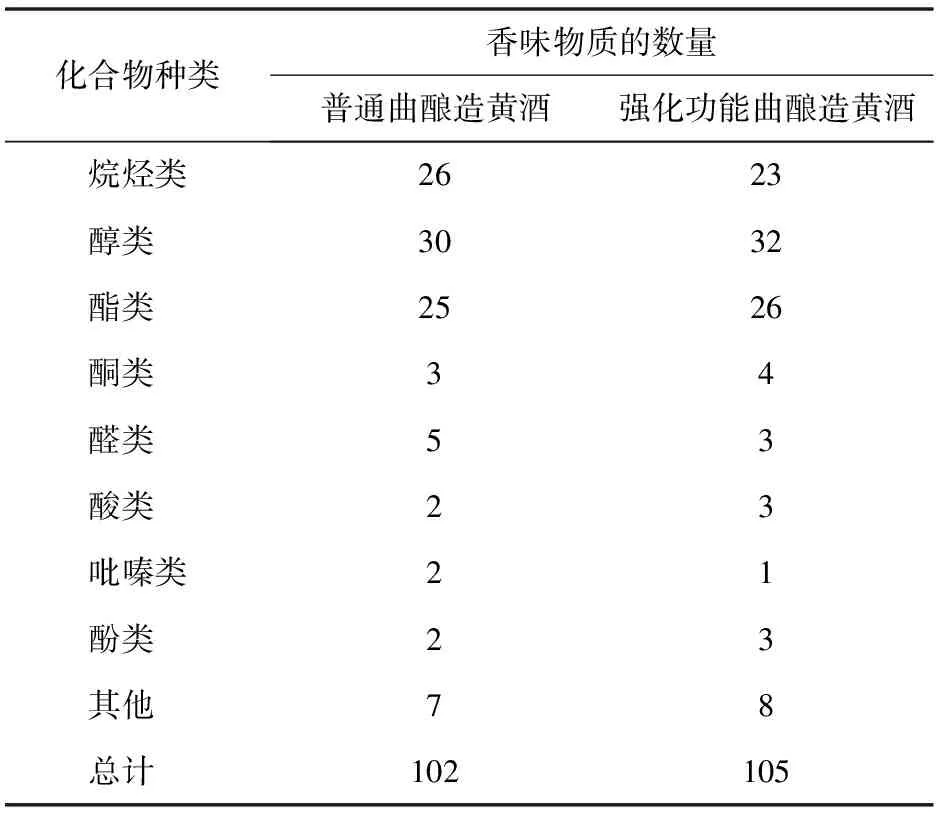
表5 2种黄酒中香味物质的种类
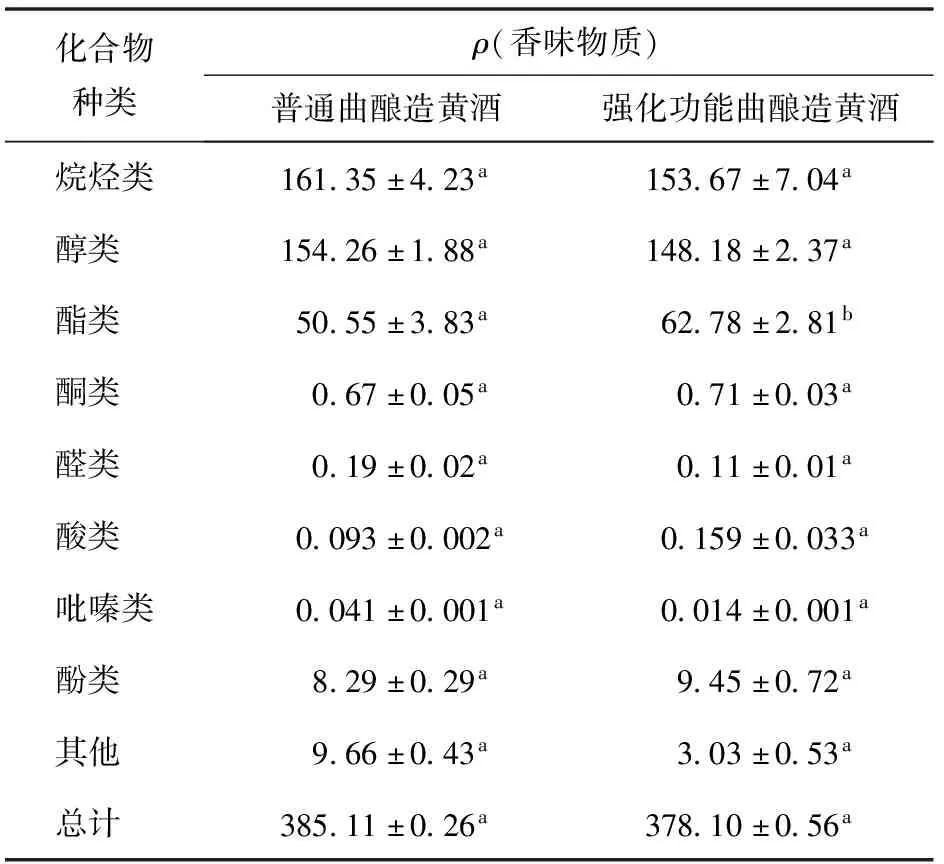
表6 2种黄酒中香味物质的含量
添加北工商海洋杆菌和戊糖片球菌,制备强化功能曲,利用强化功能曲酿造黄酒,分析检测黄酒中的总酸、总糖、非糖固形物、氨基酸态氮和酒精度,实验结果如表7所示,利用强化功能曲酿造的黄酒与对照黄酒相比,酒精度、总糖和非糖固形物没有明显变化,氨基酸态氮含量显著提高,酸度提高。分析原因,可能因为利用强化功能曲酿造黄酒,北工商海洋杆菌诱导戊糖片球菌合成细菌素,有效抑制了一些产生物胺杂菌的生长繁殖,氨基酸转化合成生物胺减少,氨基酸积累增多,因此,氨基酸态氮含量提高,总酸含量提高。
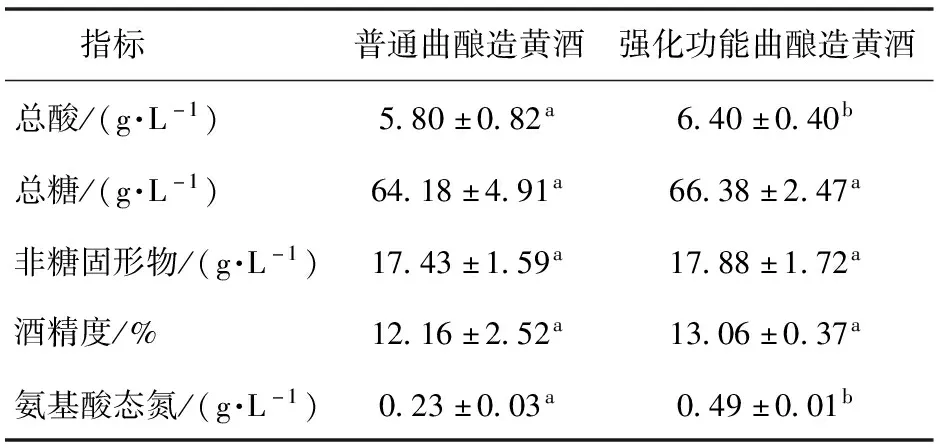
表7 2种黄酒常规品质分析
3 讨论与结论
黄酒生产上,针对黄酒生物胺的生物合成机制,通常从3个方面控制和降低生物胺的含量。首先,酿酒原料选择和处理上, 选择蛋白质含量低的原料或控制蛋白质的水解,可以影响游离氨基酸的含量水平,进而控制生物胺的生成量 但同时也会影响到黄酒的营养价值和风味品质;其次,通过发酵工艺控制生物胺,谢广发利用生物酸化浸米技术,降低了生物胺浓度[13]。但是,总体来说,改进工艺的方法费时费力,效率低,往往是针对特定企业的酒,不具有普适性;此外,筛选利用特定菌种,筛选不产生物胺的菌株、有效分解生物胺的菌株或者能抑制含脱羧酶菌株生长的菌株。不影响产品质量的前提下,如果可以筛选得到既无氨基酸脱羧酶活性又可产生有效抑制剂的菌株,则理论上效果更佳。
北工商海洋杆菌是由本课题组发现的新菌种,用发现单位北京工商大学校名命名,该新菌种能够诱导戊糖片球菌产生抑菌物质,是种间诱导产生的一种细菌素,诱导效果与菌体密度有关,关于其诱导合成机制,需要进一步分析研究。
北工商海洋杆菌和戊糖片球菌自生发酵不产生物胺,添加北工商海洋杆菌和戊糖片球菌,制备强化功能曲,利用强化功能曲酿造黄酒,北工商海洋杆菌诱导戊糖片球菌产生的细菌素抑制了产生物胺杂菌,黄酒的生物胺含量显著降低,氨基酸态氮含量显著提高,香味物质和酒精度没有明显变化,提高和改善了黄酒品质,从酿酒微生物相互作用方面,探索了一条降低黄酒生产中生物胺含量的新途径,提供了优质的菌种资源,将会在黄酒酿造和品质改良中发挥重要的作用。
