山茱萸中生物活性物质的分离、鉴定及其神经保护作用
2021-02-02钟祥键冀麟麟李金杰尚小雅
栾 娜,王 欣,钟祥键,周 娜,隽 京,冀麟麟,李金杰,尚小雅
(北京联合大学 生物活性物质与功能北京市重点实验室,北京 100191)
阿尔兹海默症(Alzheimer disease, AD)是发生在老年或老年前期的中枢性神经退行性疾病,临床主要表现为渐进性记忆减退、认知功能障碍、人格改变及语言障碍等神经精神症状[1]。由于缺乏有效的预防及治疗措施,AD已成为继心脑血管疾病、癌症和卒中的第四大致死病因,目前没有可治愈的药物[2]。从天然可食用材料中寻找具有潜在抗老年痴呆作用的成分是开发抗老年痴呆药物和功能食品的重要方向,具有神经保护活性的天然产物是作为开发的重点研究对象。
山茱萸(CornusofficinalisSieb.et Zucc.)别名肉枣、药枣、石枣等,为木兰纲(Magnoliopsida)山茱萸目(Cornales)山茱萸科(Cornaceae)山茱萸属(Cornus)植物,主产于我国山西、河南等地,主要使用部位为成熟果肉,其性酸、涩、具有补益肝肾和涩精固脱之功效[3-4]。山茱萸在食品工业中的应用已比较广泛[5-7],2018年已被中国食品药品监督管理局(China Food and Drug Administration,CFDA)正式收录在药食两用资源目录中。大量研究表明:山茱萸主要化学成分有环烯醚萜及其苷类、三萜类、黄酮类、鞣质类、有机酸类等[8-12],具有神经保护、抗炎、降糖、抑菌、抗肿瘤、肝保护等多种生理活性[13-16]。山茱萸含有多种药理活性,但研究多集中于粗提物水平[17-19]。
本课题组对山茱萸乙醇提取物进行初步分离,发现大孔吸附树脂用体积分数为20%的乙醇水溶液洗脱部位显示较好的神经保护活性,进一步研究发现,其中含量最大的莫诺苷已有文献报道具有神经保护作用[20],剔除莫诺苷后的组分进行活性测定仍发现有较好的神经保护活性;为了明确活性因子是什么,本研究采用多种色谱分离技术和波谱学方法,对剔除莫诺苷后的活性组分进行系统分离纯化,并对分离得到的化合物进行了体外神经保护活性筛选,除莫诺苷外,新发现有2个化合物具有较好的神经保护活性。研究为明确山茱萸神经保护活性的化学组成,进一步开发利用该植物提供了科学依据。
1 材料与方法
1.1 材料与试剂
山茱萸购买于河南西峡,经宣武医院王文教授鉴定为山茱萸CornusofficinalisSieb.et Zucc.的果实,留样保存于北京联合大学生物活性物质与功能食品北京市重点实验室。HP-20型大孔吸附树脂,日本三棱公司;Sephadex LH-20凝胶,Pharmacia公司;柱色谱硅胶(160~200目)和薄层色谱硅胶GF254,青岛海洋化工厂;低压反相硅胶色谱柱和正相氰基色谱柱,ISCO公司;SH-SY5Y细胞,中国医学科学院基础医学研究所;胰蛋白酶(1×104U/mg)和PRMI 1640培养基,Thermo Fisher公司;3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT),Dojindo La公司;FBS,HyClone公司;氯仿、甲醇、乙醇及硫酸等试剂均为分析纯,北京化学试剂厂;HPLC用溶剂为色谱纯,美国Fisher公司;实验用水为超纯水。
1.2 仪器与设备
Combiflash Companion型快速分离仪(正反相硅胶制备柱),ISCO公司;Inova 500型核磁共振仪,Varian公司;2545型高效液相色谱仪[配Sunfire C18型制备柱(19 mm×250 mm×5 μm), Waters 2998型检测器],Waters公司;纯水机,美国Pall公司;紫外灯,SWEEP公司;酶标仪,Molecular Device公司。
1.3 实验方法
1.3.1活性成分的提取与分离纯化方法
山茱萸25 kg,采用体积分数为50%的乙醇水溶液超声提取3次,每次1 h,合并3次提取液减压浓缩得到浸膏(4.3 kg)。将浸膏分散于水中,上样至用水平衡的HP-20型大孔吸附树脂色谱柱,分别用水、20%乙醇(体积分数为20%的乙醇水溶液)、60%乙醇(体积分数为60%的乙醇水溶液)、95%乙醇(体积分数为95%的乙醇水溶液)洗脱,浓缩各洗脱部分,得到4个部位。其中20%乙醇洗脱部位1.25 kg。将20%乙醇洗脱部位溶解,过正相硅胶柱,以V(氯仿)∶V(甲醇)=10∶90~0∶100进行梯度洗脱,得到V(氯仿)∶V(甲醇)=91∶9、89∶11和甲醇组分,共计3个组分(A1、A2、A3)。将A1部分过反相硅胶柱,以V(乙醇)∶V(水)=5∶95~100∶0进行梯度洗脱,得到组分A1-1~A1-14。组分A1-4首先通过正相硅胶柱色谱,以V(氯仿)∶V(甲醇)=95∶5~0∶100进行梯度洗脱,得到A1-4-1~A1-4-7,组分A1-4-2中有明显斑点,通过Sephadex LH-20凝胶柱色谱,以V(氯仿)∶V(甲醇)=67∶33进行洗脱,反复多次,得到化合物1(125 g)。组分A1-3通过正相硅胶柱色谱,以V(氯仿)∶V(甲醇)=95∶5~50∶50进行梯度洗脱,得到组分A1-3-1~A1-3-6,其中A1-3-3首先经过闪式低压反相色谱,以V(甲醇)∶V(水)=40∶60~100∶0进行梯度洗脱,得到组分再经过Sephadex LH-20,V(氯仿)∶V(甲醇)=67∶33洗脱,最后经高效液相色谱,以V(甲醇)∶V(水)=45∶55进行制备,得到化合物2(31 mg)和化合物3(26 mg);A1-3-2组分分别经过Sephadex LH-20凝胶柱色谱和闪式低压反相柱色谱,得到化合物4(15 mg)。组分A1-3-5经Sephadex LH-20凝胶柱色谱,以V(石油醚)∶V(氯仿)∶V(甲醇)=45∶45∶10洗脱,得到化合物9(176 mg)。将A1-1组分过正相硅胶柱,以V(氯仿)∶V(甲醇)=98∶2~90∶10进行梯度洗脱,得到A1-1-1~A1-1-6组分,A1-1-1组分中有明显的主要斑点,通过浓硫酸显色为绿色,将此组分反复通过Sephadex LH-20,以V(氯仿)∶V(甲醇)=67∶33为洗脱剂,富集此绿色斑点,将绿色斑点富集组分通过正相硅胶柱色谱,以V(石油醚)∶V(丙酮)=80∶20为洗脱剂,得到化合物8(92 mg)。A1-2组分反复通过Sephadex LH-20凝胶柱,以V(石油醚)∶V(氯仿)∶V(甲醇)=45∶45∶10进行洗脱得到组分A1-2-1~A1-2-4,其中A1-2-3亚组分通过闪式低压氰基色谱柱,以V(石油醚)∶V(丙酮)=95∶5~67∶33进行梯度洗脱,最后通过高效液相色谱,以V(甲醇)∶V(水)=65∶35进行洗脱,得到化合物5(19 mg)和化合物6(9 mg)。组分A1-2-4进行硅胶柱色谱分离,以V(石油醚)∶V(丙酮)=86∶14~67∶33进行梯度洗脱,得到化合物7(12 mg)。组分分离流程见图1。
1.3.2神经保护活性的测定
神经保护活性测定参考孙芳玲等[20]方法,评价活性成分对H2O2损伤的SH-SY5Y细胞的保护作用情况,测定方法稍作修改。SH-SY5Y细胞以RPMI-1640培养基辅以体积分数为10%胎牛血清于37 ℃、体积分数为5% CO2、饱和湿度培养箱中培养。细胞每2~3 d更换培养基,待细胞密度达到80%~90%时以质量分数为0.25%胰蛋白酶消化进行传代培养,实验选取对数生长期细胞。细胞以每孔5×103个的浓度接种于96孔板中,24 h后加入H2O2,H2O2终浓度为200 μmol/L,1 h后加入化合物处理细胞,24 h后采用3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT)比色法在酶标仪上测定560 nm处吸光度值,以此反映细胞的存活情况。
1.3.3活性成分中单体化合物的结构鉴定
对分离得到的单体化合物,首先采用TLC和HPLC检测其纯度,对于纯度大于95%的样品,进行核磁共振氢谱和碳谱及质谱数据的测试,然后将测定的数据与文献报道的数据进行对比,进而鉴定分离得到的单体化合物的结构。
化合物1:白色无定型粉末,ESI-MS给出分子离子峰为m/z429[M+Na]+。1H-NMR(CD3OD, 500 MHz)δ: 7.54(1H, s, H-3), 5.91(1H, d,J=9.3 Hz, H-1), 5.16(1H, dd,J=9.7, 2.2 Hz, H-7), 4.79(1H, d,J=7.9 Hz, H-1′), 4.35(1H, m, H-8), 3.89(1H, dd,J=12.3, 2.2 Hz, H-6′β), 3.71(3H, s, 11-OMe), 3.66(1H, dd,J=12.2, 6.3 Hz, H-6′α), 3.38(1H, m, H-5′), 3.31(1H, dd,J=9.0, 9.0 Hz, H-3′), 3.25(1H, m, H-4′), 3.15(1H, dd,J=7.9, 9.3 Hz, H-2′), 3.14(1H, m, H-5), 1.97(1H, m, H-6β), 1.87(1H, m , H-9), 1.62(1H, m, H-6α), 1.32(3H, d,J=6.9 Hz, H-10)。13C-NMR(CD3OD, 125 MHz)δ: 168.7(C-11), 154.5(C-3), 111.6(C-4), 100.1(C-1′), 95.5(C-1), 93.6(C-7), 78.5(C-3′), 77.9(C-5′), 75.0(C-2′), 71.6(C-4′), 67.0(C-8), 62.8(C-6′), 51.7(11-OMe), 40.4(C-10), 33.5(C-6), 27.8(C-5), 19.7(C-10)。化合物1的NMR谱图见图2,谱图数据与文献[21]报道一致,由此确定化合物1为7-β-莫诺苷。
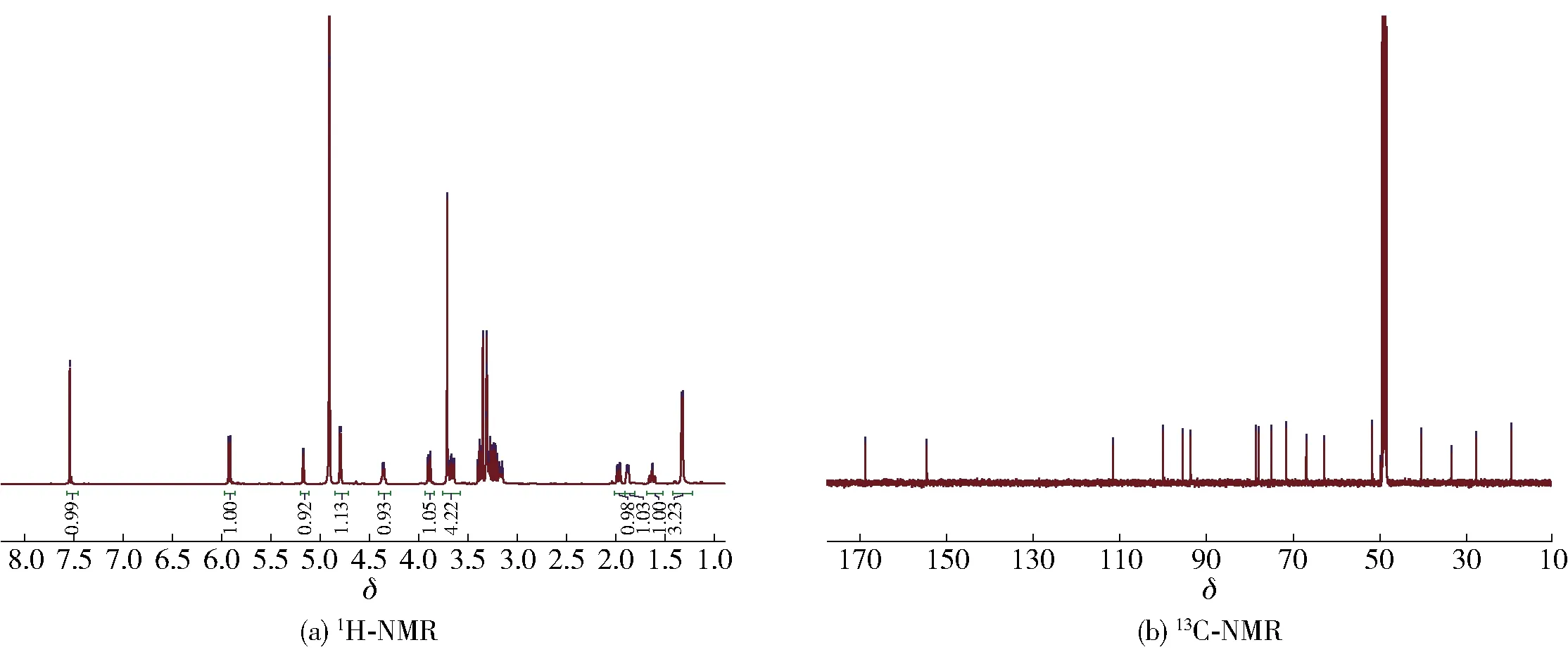
图2 7-β-莫诺苷的NMR谱
化合物2:白色无定型粉末,ESI-MS给出分子离子峰m/z457[M+Na]+。1H-NMR(CD3OD, 500 MHz)δ: 7.49(1H, s, H-3), 5.87(1H, d,J=9.3 Hz, H-1), 4.76(1H, d,J=7.9 Hz, H-1′), 4.73(1H, d,J=3.4 Hz, H-7), 4.26(1H, m, H-8), 3.86(1H, dd,J=12.3, 2.2 Hz, H-6′β), 3.67(3H, s, H-12), 3.63(1H, dd,J=12.2, 6.3 Hz, H-6′α), 3.37(1H, dd,J=9.0, 9.0 Hz, H-3′), 3.35(1H, m, H-5′), 3.33(3H, s, H-13), 3.28(1H, m, H-4′), 3.18(1H, m, H-2′), 3.02(1H, m, H-5), 1.90(1H, m, H-6β), 1.80(1H, m, H-9), 1.50(1H, m, H-6α), 1.33(3H, d,J=7.0 Hz, H-10).13C-NMR(CD3OD, 125 MHz)δ: 168.6(C-11), 154.5(C-3), 111.6(C-4), 100.1(C-1′), 99.5(C-7), 95.6(C-1), 78.5(C-3′), 77.9(C-5′), 75.0(C-2′), 71.7(C-4′), 66.8(C-8), 62.9(C-6′), 54.9(7-OCH3), 51.8(C-12), 40.3(C-9), 33.8(C-6), 28.0(C-5), 19.6(C-10)。化合物2的NMR谱图见图3,谱图数据与文献[22]报道一致,由此确定化合物2为7-β-O-甲基莫诺苷。
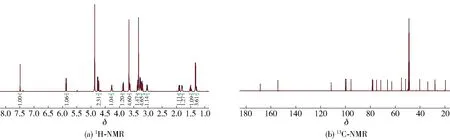
图3 7-β-O-甲基莫诺苷的NMR谱
化合物3:白色无定型粉末,ESI-MS给出分子离子峰m/z457[M+Na]+。1H-NMR(CD3OD, 500 MHz)δ: 7.50(1H, s, H-3), 5.80(1H, d,J=9.3 Hz, H-1), 4.77(1H, d,J=7.9 Hz, H-1′), 4.59(1H, dd,J=9.6, 1.85 Hz, H-7), 3.92(1H, m, H-8), 3.87(1H, dd,J=12.3, 2.2 Hz, H-6′β), 3.68(3H, s, H-13), 3.65(1H, dd,J=12.2, 6.3 Hz, H-6′α), 3.48(1H, m, H-5′), 3.47(3H, s, 7-OCH3), 3.37(1H, dd,J=9.0, 9.0 Hz, H-3′), 3.28(1H, m, H-4′), 3.19(1H, dd,J=9.3, 7.9 Hz, H-2′), 2.82(1H, m, H-5), 1.99(1H, m, H-6β), 1.80(1H, m, H-9), 1.38(3H, d,J=7.0 Hz, H-10), 1.14(1H, m, H-6α)。13C-NMR(CD3OD, 125 MHz)δ: 168.6(C-11), 154.5(C-3), 110.7(C-4), 104.6(C-1′), 99.8(C-7), 95.7(C-1), 78.5(C-3′), 77.9(C-5′), 75.0(C-2′), 74.2(C-8), 71.7(C-4′), 62.9(C-6′), 56.8(7-OMe), 51.8(C-12), 40.1(C-9), 35.7(C-6), 31.8(C-5), 19.7(C-10)。化合物3的NMR谱图见图4,谱图数据与文献[22]报道一致,由此确定化合物3为7-α-O-甲基莫诺苷。

图4 7-α-O-甲基莫诺苷的NMR谱
化合物4:白色无定型粉末,ESI-MS给出分子离子峰为m/z427[M+Na]+。1H-NMR(CD3OD, 500 MHz)δ: 7.49(1H, s, H-3), 5.63(1H, d,J=6.0 Hz, H-1), 4.74(1H, m, H-8), 4.66(1H, d,J=7.9 Hz, H-1′), 3.87(1H, dd,J=12.0, 1.8 Hz, H-6′β), 3.69(3H, s, 11-OMe), 3.63(1H, dd,J=12.0, 6.1 Hz, H-6′α), 3.22~3.36(4H, m, H-2′, 3′, 4′, 5′), 3.16(1H, m, H-5), 2.95(1H, dd,J=17.1, 7.5 Hz, H-6α), 2.60(1H, dd,J=17.1, 6.0 Hz, H-6β), 2.41(1H, m, H-9), 1.49(3H, d,J=7.0 Hz, H-10)。13C-NMR(CD3OD, 125 MHz)δ: 174.3(C-7), 168.1(C-11), 154.3(C-3), 111.4(C-4), 100.0(C-1′), 94.3(C-1), 78.5(C-3′), 77.9(C-5′), 76.7(C-2′), 74.7(C-8), 71.6(C-4′), 62.8(C-6′), 51.8(11-OMe), 39.8(C-6), 34.3(C-9), 27.9(C-5), 18.4(C-10)。化合物4的NMR谱图见图5,谱图数据与文献[23]报道一致,由此确定化合物4为金吉苷。
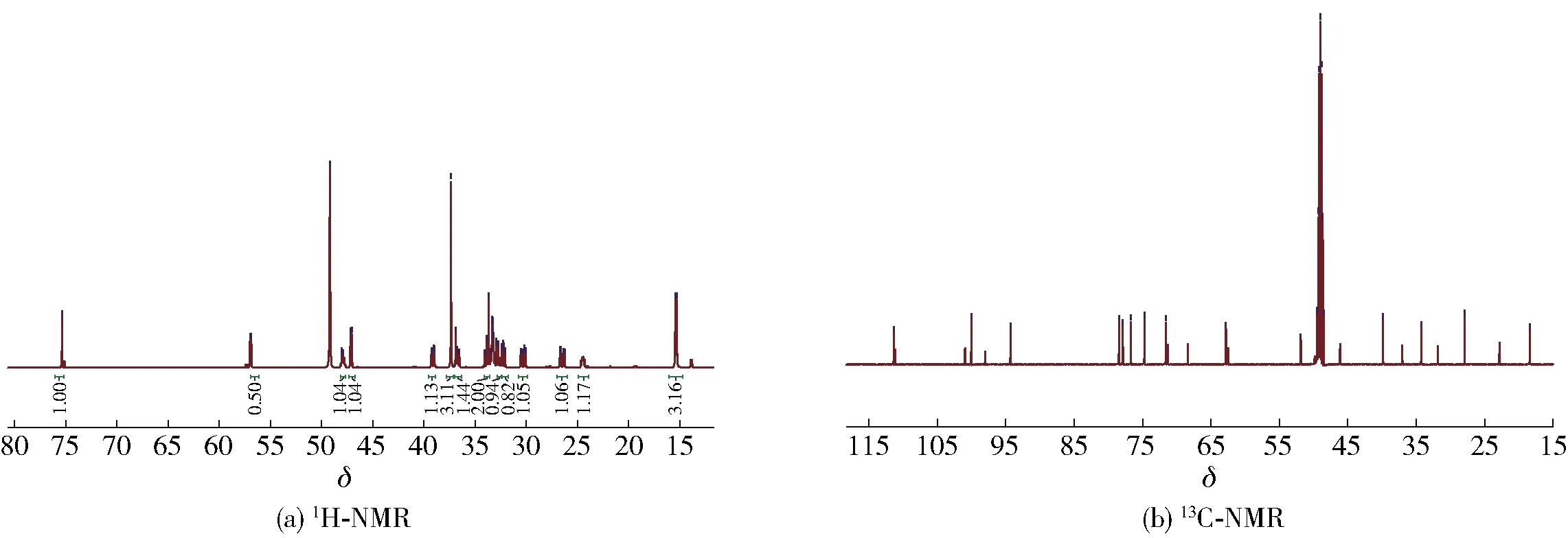
图5 金吉苷的NMR谱
化合物5:无色油状物,ESI-MS给出分子离子峰为m/z171[M+H]+。1H-NMR(CD3OD, 500 MHz)δ: 4.37(1H, dd,J=11.6, 4.3 Hz, H-1α), 4.14(1H, dd,J=11.6, 3.9 Hz, H-1β), 4.02(1H, m, H-6), 2.71(1H, dd,J=15.0, 7.2 Hz, H-4α), 2.86(1H, m, H-5), 2.31(1H, dd,J=15.0, 4.5 Hz, H-4β), 2.10(1H, m, H-7β), 2.01(1H, m, H-9), 1.79(1H, m, H-8), 1.31(1H, m, H-7α), 1.04(3H, d,J=6.9 Hz, H-10)。13C-NMR(CD3OD, 125 MHz)δ: 176.7(C-3), 76.2(C-6), 70.0(C-1), 43.9(C-9), 42.9(C-5), 42.4(C-7), 35.2(C-8), 34.0(C-4), 13.1(C-10)。化合物5的NMR谱图见图6,谱图数据与文献[24]报道一致,由此确定化合物5为cornolactones D。

图6 Cornolactones D的NMR谱
化合物6:白色固体,ESI-MS给出分子离子峰为:m/z299[M+H]+;1H NMR(DMSO, 500 MHz):δ7.18(1H, d,J=1.5 Hz, H-8), 6.51(1H, d,J=3.5 Hz, H-4′), 5.30(1H, d,J=3.5 Hz, H-3′), 4.98(H, s, H-2), 4.46(2H, s, H-6′), 3.77(2H, m, H-6, 9β), 3.59(1H, m, H-9α), 3.48(2H, m, H-7), 1.15(3H, t,J=7.0 Hz, H-10);13C NMR(CDCl3, 125 MHz):δ197.1(C-3), 160.5(C-5′), 149.4(C-2′), 126.8(C-4), 121.7(C-8), 121.4(C-3′), 110.3(C-4′), 97.9(C-2), 80.8(C-5), 74.4(C-6), 63.9(C-9), 62.2(C-7), 56.0(C-6′), 15.0(C-10)。化合物6的NMR谱图见图7,谱图数据与文献[25]报道一致,由此确定化合物6为pollenfuran A。
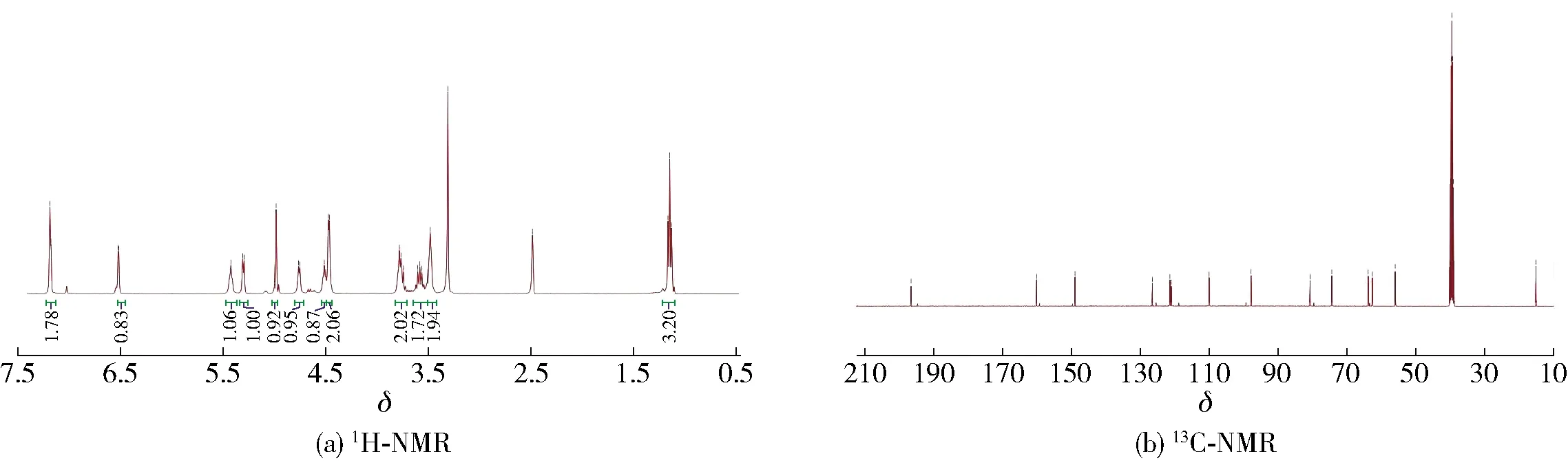
图7 Pollenfuran A的NMR谱
化合物7:白色固体,ESI-MS给出分子离子峰m/z349[M+H]+;1H NMR(CDCl3, 500 MHz):δ6.85(1H, d,J=8.0 Hz, H-5′), 6.83(1H, d,J=8.0 Hz, H-5″), 6.67(1H, dd,J=8.0.2.0 Hz, H-6′), 6.65(1H, dd,J=8.0.2.0 Hz, H-6″), 6.57(1H, d,J=2.0 Hz, H-2′), 6.55(1H, d,J=2.0 Hz, H-2″), 5.54(1H, d,J=6.0 Hz, H-3), 3.87(1H, m, H-1β), 3.80(3H, s, OMe), 3.76(3H, s, OMe), 3.74(1H, m, H-1α), 3.42(1H, m, H-1‴β), 3.27(1H, m, H-1‴α), 3.11(1H, m, H-2), 1.12(3H, t,J=7.0 Hz, H-2‴);13C NMR(CDCl3, 125 MHz):δ146.4(C-3′), 146.2(C-3″), 145.2(C-4″), 144.5(C-4‴), 131.9(C-1′), 130.9(C-1″), 121.9(C-6′), 120.7(C-6″), 114.1(C-5′), 113.7(C-5″), 112.1(C-2″), 109.7(C-2′), 83.6(C-3), 64.5(C-1), 64.4(C-1‴), 55.9(C-OMe), 54.2(C-2), 15.4(C-2‴)。化合物7的NMR谱图见图8,谱图数据与文献[26]报道一致,由此确定化合物7为threo-2,3-bis(4-hydroxy-3-methoxyphenyl)-3-ethoxypropan-1-ol。
图8 threo-2,3-bis(4-hydroxy-3-methoxyphenyl)-3-ethoxypropan-1-ol的NMR谱
化合物8:棕色油状物,ESI-MS显示m/z125[M-H]-。1H-NMR(CD3OD, 500 MHz)δ: 9.50(1H, s, H-7), 7.35(1H, d,J=3.6 Hz, H-3), 6.55(1H, d,J=3.6 Hz, H-4), 4.58(2H, s, H-6)。13C-NMR(CD3OD, 125 MHz)δ: 179.4(C-7), 163.2(C-5), 153.9(C-2), 124.6(C-3), 110.9(C-4), 57.6(C-6)。化合物8的NMR谱图见图9,谱图数据与文献[27]报道一致,由此确定化合物8为5-羟甲基糠醛。
图9 5-羟甲基糖醛的NMR谱
化合物9:白色无定型粉末,ESI-MS给出分子离子峰m/z155[M+H]+。1H-NMR(CD3OD, 500 MHz)δ: 7.37(2H, m, H-2,6), 6.73(1H, d,J=7.9 Hz, H-4)。13C-NMR(CD3OD, 125 MHz)δ: 170.2(C-7), 151.2(C-3), 146.0(C-4), 123.8(C-1), 123.0(C-6), 117.7(C-5), 115.7(C-2)。化合物9的NMR谱图见图10,谱图数据与文献[28]报道一致,由此确定化合物9为3,4-二羟基苯甲酸。
图10 3,4-二羟基苯甲酸的NMR谱
2 结果与分析
2.1 活性成分的分离和结构鉴定分析
采用大孔吸附树脂、正相常压硅胶、Sephadex LH-20凝胶、闪式低压正反相硅胶、反相高压液相等色谱方法从显示具有神经保护活性的组分中共分离得到9个单体化合物,根据核磁共振谱、质谱,同时结合已知文献数据对比对分离得到的化合物进行结构鉴定,鉴定其结构分别为7-β-莫诺苷(1)、7-β-O-甲基莫诺苷(2)、7-α-O-甲基莫诺苷(3)、金吉苷(4)、cornolactones D(5)、pollenfuran A(6)、threo-2,3-bis(4-hydroxy-3-methoxyphenyl)-3-ethoxypropan-1-ol(7)、5-羟甲基糠醛(8)和3,4-二羟基苯甲酸(9)(结构见图11)。从化合物类型上分化合物1~5为环烯醚萜类化合物,其中化合物1~4为环烯醚萜单糖苷;化合物6和8为呋喃化合物,化合物7和9为酚酸类化合物。其中化合物6和7为首次从山茱萸属植物中分离得到,化合物5为首次从山茱萸中分离得到。
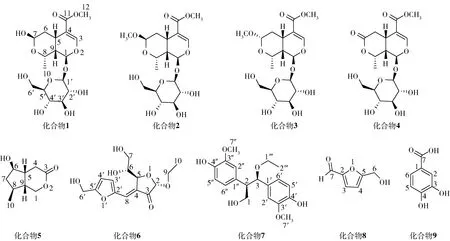
图11 山茱萸果实中鉴定的9个单体化合物结构式
在分离过程中发现,由于环烯醚萜苷类成分苷元为单萜,含有一个葡萄糖,极性较大,但在反相硅胶柱色谱上的保留较弱,化合物1采用纯水即可从色谱柱上洗脱,化合物2~4仅用体积分数为5%的乙醇水溶液即可洗脱,而其他成分则需在含醇量大于30%后方可洗脱,这种采用水和低浓度乙醇水洗脱的反相硅胶柱色谱方法可用于环烯醚萜苷类成分的快速大量富集。化合物1和化合物2结构相似,仅1个甲氧基的区别,分离过程中采用Sephadex LH-20凝胶柱色谱分离,当使用甲醇为洗脱剂时无法分离,而采用V(氯仿)∶V(甲醇)=2∶1为洗脱剂时可一次性分离,这为结构相似的成分的快速分离提供了一定参考。化合物2和化合物3在结构上为差向异构体,此类结构通常在分离时需采用手性色谱柱,而化合物2和3采用常规C18反相色谱柱即可实现分离,但洗脱剂需为乙腈水系统,甲醇水系统无法实现分离。
2.2 活性成分对神经细胞的保护作用
将分离得到的单体活性成分化合物在浓度10 μmol/L下,对H2O2损伤的SH-SY5Y细胞保护作用进行研究,以仅给予空白溶液细胞为对照组,以仅H2O2损失处理细胞为模型组,结果显示,化合物1~3能够显著提高细胞存活率,其中化合物1(莫诺苷)活性最好,细胞存活率为85.2%,这与之前研究报道的结果一致[20]。对山茱萸果实中鉴定的9个化合物结构与活性相关性进行分析,发现化合物1~4的结构类型一样,差别只是取代基不同,但神经保护活性的差别却很大,推测化合物2和3的羟基酯化降低了神经保护活性,而化合物4中羟基被羰基取代,活性消失,说明C7上-OH可能为山茱萸环烯醚萜苷类成分的活性基团。化合物5为环戊烷型环烯醚萜苷元,但未表现出显著的神经保护活性,是否是成苷之后活性提高,还需要进一步研究。这9个化合物对H2O2损伤SH-SY5Y细胞保护作用的影响结果见表1。
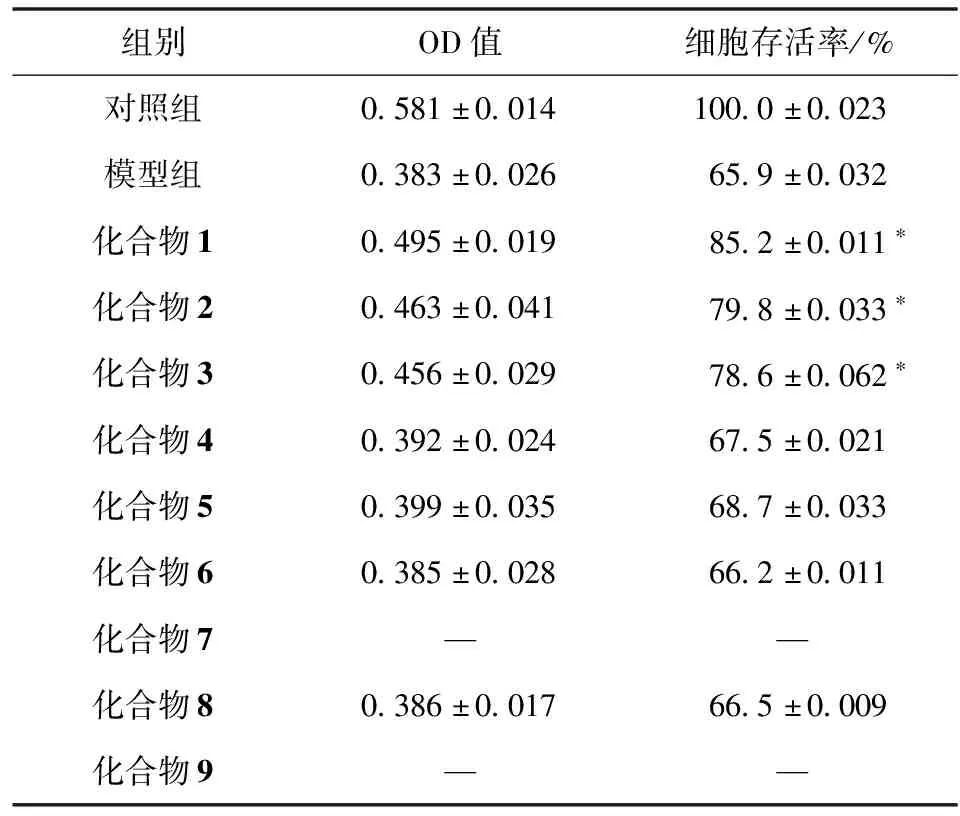
表1 化合物对H2O2损伤SH-SY5Y细胞的保护作用
3 结 论
本研究对山茱萸乙醇提取物中大孔吸附树脂体积分数为20%的乙醇水溶液洗脱部位进行了化学成分研究,从显示神经保护活性的组分中分离鉴定了9个化合物,包括环烯醚萜及其苷类、呋喃型类、酚酸类。同时采用H2O2诱导的SH-SY5Y神经细胞损伤模型对分离得到的化合物进行了神经保护活性测试,结果显示除已报道具有神经保护活性的莫诺苷(细胞存活率85.2%±0.011%)外,7-β-O-甲基莫诺苷(化合物2,细胞存活率79.8%±0.033%)和7-α-O-甲基莫诺苷(化合物3,细胞存活率78.6%±0.062%)也显示较好的神经保护活性,说明环烯醚萜苷类成分可能为山茱萸神经保护活性的主要活性成分类型,因此对其他神经保护活性环烯醚萜苷的研究对于最终明确山茱萸神经保护活性成分具有重要意义。
