aurT基因对金褐霉素生物合成的调控及其作用机制
2021-02-02于文辰郝若冰许德鑫
魏 杰,于文辰,郝若冰,杨 静,许德鑫,高 军
(1.辽宁大学 生命科学院,辽宁 沈阳 110036;2.辽宁省林业科学研究院,辽宁 沈阳 110032)
金褐霉素(Aureofuscin)是从我国土壤中分离得到的链霉菌新种——金褐链霉菌(Streptomycesaureofuscus)产生的一种四烯大环内酯类抗真菌物质,具有多个共轭双键,一个羟基侧链基团和一个大环内酯骨架,与纳他霉素结构类似[1-2]。金褐霉素为针状结晶,无色无味,没有明显的熔点,不溶于低级醚,几乎不溶于水,LD50为28.27 mg/kg[1]。金褐霉素在食品保鲜方面具有广阔的应用前景,极有可能开发为新型高效、低残留、安全、稳定的食品防腐剂。金褐霉素生物合成的调控机制尚未明确,并且金褐霉素的产量较低, 限制了其产业化应用。研究金褐霉素生物合成中关键调控基因以及基因改造等方法,提高金褐霉素的产量,成为目前需要解决的关键问题。
本项目组在前期研究中建立了一种新型的金褐霉素高效液相色谱(HPLC)的快速检测方法[3];采用核磁共振技术检测并优化分离提取工艺,优化野生菌株培养条件、发酵工艺[4];通过添加前体物质提高野生型金褐链霉菌的发酵产量[5];克隆得到金褐霉素生物合成基因簇中完整基因aurJ3M,在GenBank上公布,登录号为EU697915;发现基因aurJ3M能促进金褐霉素的生物合成,并且其对黑根霉具有很强的抑菌性;继续深入研究基因aurJ3M的途径特异性调控功能及其调控机制[6-8];金褐霉素对冬枣的保鲜效果优于纳他霉素[9],并且由茶多酚和金褐霉素组成的复合保鲜剂对虾夷扇贝也具有很好的保鲜效果[10]。本研究拟对基因aurT的功能及其对金褐霉素生物合成的调控机制进行分析,试图深入了解金褐霉素的调控网络,希望为通过基因改造等方法提高金褐霉素的产量奠定基础。
1 材料与方法
1.1 实验材料
金褐链霉菌SYAU0709(Streptomycesaureofuscus.n.sp)、大肠杆菌DH5α和JM109,由本实验室保存。大肠杆菌ET12567(pUZ8002)和大肠杆菌/链霉菌穿梭载体pSET152,由中国科学院微生物研究所的谢锋博士赠送。
可溶性淀粉、酵母浸粉、基因组提取试剂盒、质粒提取试剂盒等均购自鼎国昌盛生物技术有限公司;DNA Marker、T4 DNA ligase、BamHI、EcoRV、XbaI、HindIII,购自Takara生物技术有限公司。
1.2 主要仪器与设备
7500型Real-Time PCR仪,赛默飞世尔科技(中国)有限公司;DYCP-31E型琼脂糖凝胶电泳仪,北京市六一仪器厂;Veriti 96 2720 t100型PCR扩增仪,美国ABI 公司;SW-CJ-2FD型超净工作台,苏州安泰空气技术有限公司;UV-2201型紫外分光光度计,日本岛津公司;冰柜,山东省青岛海尔集团;SHZ-22型水浴恒温振荡器,江苏省太仓市医疗器械厂;GA110 型电子天平,梅特勒-托利多国际有限公司;Laborota 4010型真空旋转蒸发仪,德国Heidolph公司;CR-22型高速冷冻离心机,日本日立公司;KQ-500DB型数控超声波清洗器,江苏省昆山市定山湖检测仪器厂。
1.3 实验方法
1.3.1aurT基因的克隆与分析
参考文献[11-13]进行实验。根据NCBI-blast数据库中pimT基因序列,使用Clustal-w软件进行多序列同源性比对,用Premer Premier 5.0软件设计引物aurT-1(5′-ATGGTGTCCACGGAGAGCAT-3′)和aurT-2(5′-CTAGTCGGCGCGGCCCGTCG-3′),并以金褐链霉菌SYAU0709基因组DNA为模板进行PCR扩增;使用DNA片段纯化试剂盒进行回收,交由上海生物技术公司测序,采用Clustalw(http:∥www.genome.jb/tools/clustalw/)和MEGA7.0软件对aurT序列的同源性进行比对和分析。
1.3.2aurT基因过表达载体构建
参考文献[6]和文献[14]进行实验。设计并合成具有BamHI和EcoRV限制性酶切位点的引物,上游引物aurT-Bt4(5′-GTGGATCCATGGTGTCCACGGAGAGCAT-3′)和下游引物aurT-Et5(5′-GTGATATCCTAGTCGGCGCGGCCCGTCG-3′),获得带有限制性内切酶位点的aurT基因片段;与同种限制酶消化处理的pSET152载体进行连接,得到过表达质粒pSET152-aurT。重组质粒pSET152-aurT通过E.coliET12567与野生型S.aureofuscusSYAU0709菌株进行接合转移,筛选获得重组转化子,将转化子DNA进行PCR和酶切验证,获得aurT高效表达菌株♂aurT。
1.3.3aurT基因敲除载体构建
参考文献[15-17]进行实验。设计引物aurT-U-F(5′-CGGAATTC TGCACTCCAC TCGCTCCGCT-3′)/aurT-U-R(5′-GCTCTAGA GGCGCTTCTG ACGGATCTCC-3′)和aurT-D-F(5′-GCTCTAGATGCCCGTCAC CTCCTGGAAT-3′)/aurT-D-R(5′-CCCAAGCTTA ACCTCCACGGCGCCCTCGT-3′),以S.aureofuscusDNA为模板扩增获得aurT基因的上下游同源臂aurT-5和aurT-3;同时以pC1203质粒为模板,扩增抗性基因aac(3)IV及复制起始位点序列OriT的DNA片段aac(3)IV-OriT;以质粒pUC18为模板,通过酶切连接并转化E.coliDH5α感受态细胞,将aurT-5和aurT-3及片段aac(3)IV-OriT连接在pUC18载体上,即pUC18-5129质粒构建成功;用EcoRI/HindIII依次对pUC18-5129质粒和pC1203质粒双酶切,获得aurJ3M-5-aac(3)IV-OriT-3片段和pC1203大骨架载体,连接并转化E.coliDH5α感受态细胞;挑选阳性克隆,构建含有阿泊拉霉素抗性基因的aurT基因敲除重组质粒pDaurT,将此质粒转化至大肠杆菌ET12567/pUZ8002,利用接合转移将重组质粒导入到S.aureofuscus, 通过抗性筛选出双交换重组菌株,获得aurT基因敲除菌株ΔaurT。
1.3.4摇瓶发酵实验
将野生型S.aureofuscusSYAU0709菌株、♂aurT菌株和ΔaurT菌株用挖块法接种于装有50 mL种子培养基的250 mL 三角瓶中,29 ℃,220 r/min摇床培养40 h,以体积分数10%的接种量接种,摇床发酵72 h,待测。
1.3.5PI因子结构类似物对金褐霉素产量的影响实验
参考文献[18-19]进行实验。采用紫外分光光度计在303 nm处测定样品吸光度值,根据线性回归方程(Y=0.295 7X+0.037 7)计算发酵液中金褐霉素的含量;筛选不同PI因子结构类似物,确定最佳PI因子及其质量浓度;添加最佳PI因子,对比PI因子在野生型和ΔaurT菌株中对金褐霉素产量的影响。
1.3.6aurT基因的Real-Time PCR转录水平分析
参考文献[20-22]进行实验。提取S.aureofuscus总RNA,使用Takara公司的Reverse Transcriptase M-MLV反转录试剂盒,完成从mRNA至单链cDNA的反转录,通过使用SYBR Premix Ex Taq(Takara)进行Real-Time PCR反应。Real-Time PCR反应条件:第一链cDNA合成,50 ℃ 30 min,94 ℃加热2 min;扩增,94 ℃ 30 s,55 ℃ 30 s,68 ℃ 20 s,28或30个循环,72 ℃ 1 min。
aurT反转录检测引物:AURT1,5′-GTCGTCGGCAACCTCATCGGCTCATAC-3′和AURT2,5′-GCGCCCAGGCCCCACAGA-3′。扩增lysA基因的引物:LYSA1,5′-CGCCCGCCCACAGCAGG TCTTC-3′和LYSA2,5′-TGGGGGTGCATGAGGAACTGAT-3′。
2 结果与分析
2.1 aurT基因的克隆与测序结果分析
PCR扩增获得金褐链霉菌生物合成基因簇中645bp的aurT基因片段,结果如图1。NCBI Genbank登录号为MH247109.1。在NCBI-blast数据库中比较AurT与PimT的氨基酸序列,结果如图2。AurT与PimT的氨基酸序列同源性为92%,AurT属于RhtB家族调节因子[15],是金褐霉素生物合成的氨基酸转运蛋白。

图2 AurT与PimT的氨基酸序列同源性比较
2.2 ♂aurT菌株与野生型菌株的生长和金褐霉素产量的比较
通过筛选高产金褐霉素的♂aurT转化子(JH-T1~JH-T15),确定♂aurT JH-T2菌株的金褐霉素产量最高。图3为野生型金褐链霉菌SYAU0709菌株和♂aurT JH-T2菌株的生长情况(菌体干重)及金褐霉素发酵产量的分析结果。由图3(a)菌体干重对比结果可知,♂aurT JH-T2菌株的生长要比野生型菌株快;由图3(b)可知,在96 h时,♂aurT的金褐霉素产量达到904 μg/mL,比野生型菌株提高了1.3倍;由图3(c)可知,通过HPLC分析,♂aurT JH-T2菌株发酵产量显著高于野生菌株,进一步证实了aurT基因的过表达能够提高金褐霉素的产量,说明aurT基因能够促进金褐霉素的合成。
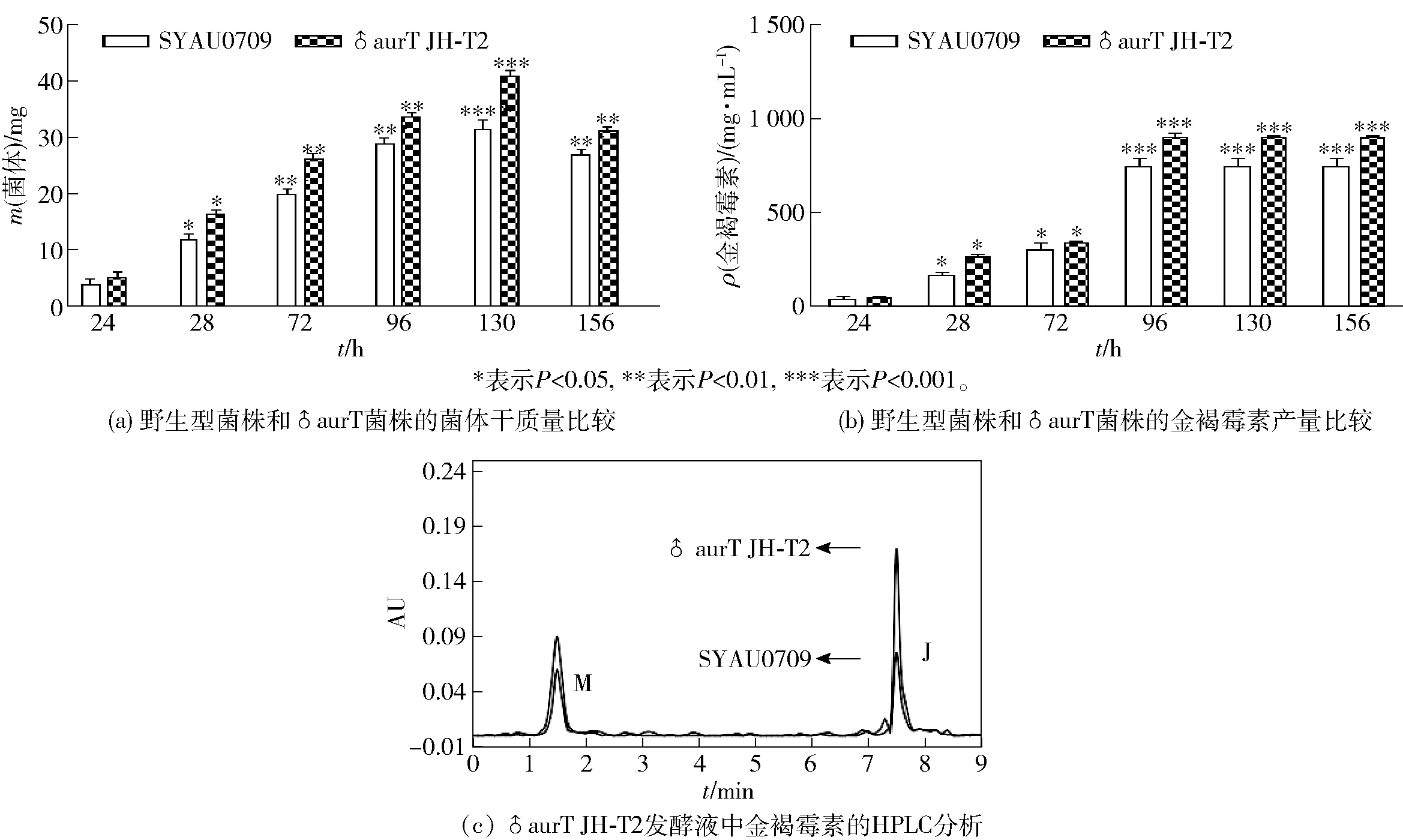
M,溶剂峰(甲醇); J,金褐霉素。
2.3 aurT敲除突变株ΔaurT的构建结果
PCR扩增引物aurT-UF/aurT-UR和aurT-DF/aurT-DR,获得502 bp的aurT-5(上游同源臂)和601 bp的aurT-3(下游同源臂),结果如图4。aurT基因敲除载体构建结果如图5,图5(a)是获得重组基因敲除质粒pC1203-ΔaurT的构建图。用Xba I酶切后,获得1 209 bp的aac(3)IV-OriT片段,证明基因敲除质粒构建成功,验证结果如图5(b)。
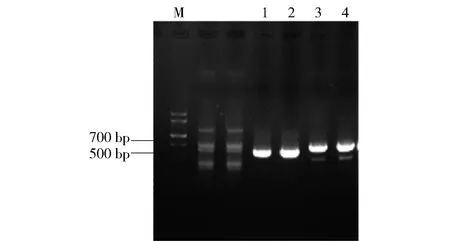
M,marker;泳道1、2,aurT-5;泳道3、4,aurT-3。

M,marker;泳道1、2,pC1203-ΔaurT Xba I单酶切获得aac(3)IV-OriT。
2.4 ΔaurT菌株与野生型菌株的生长和金褐霉素产量的比较
敲除菌株ΔaurT和野生型菌株产金褐霉素的比较结果见图6。由图6(a)可知,ΔaurT菌株在96 h时金褐霉素产量达到239 μg/mL,与野生型菌株的发酵产量(684 μg/mL)相比,降低了65%,但并未完全抑制金褐霉素的产生;图6(b)的HPLC分析结果表明,ΔaurT菌株的发酵产量低于野生型菌株,说明aurT对金褐霉素生物合成的调控过程不同于途径特异性调控基因aurJ3M,这很可能是通过PI因子的分泌来影响和调控金褐霉素的生物合成过程的[15]。
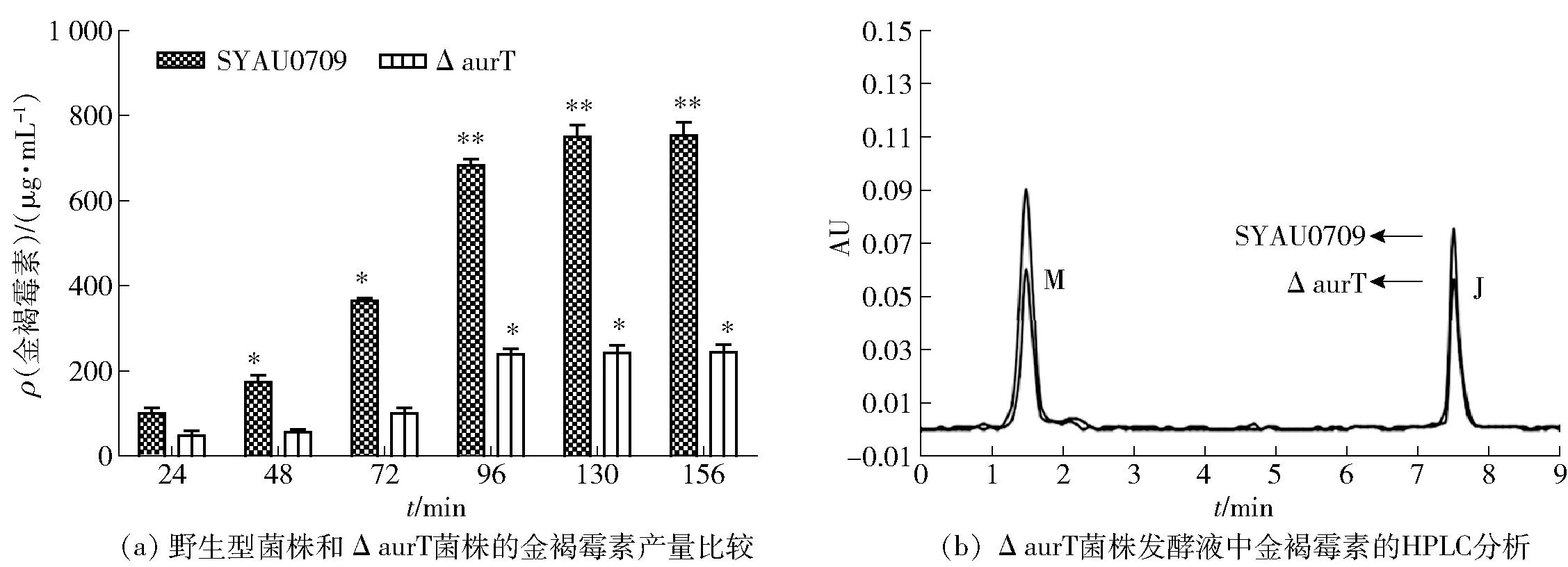
*表示P<0.05,**表示P<0.01。M,溶剂峰(甲醇);J,金褐霉素。
2.5 PI因子结构类似物对金褐霉素产量的影响
PI因子结构类似物对金褐霉素产量的影响,实验结果如图7。图7(a)表明,加入1,2-丙二醇、丙三醇、乙二醇、三乙醇胺后,金褐霉素的发酵产量分别是904、1 034、881、794 μg/mL,与空白对照组的产量(693 μg/mL)相比,发酵产量有不同程度提高,其中丙三醇对金褐霉素的生物合成影响最为明显。
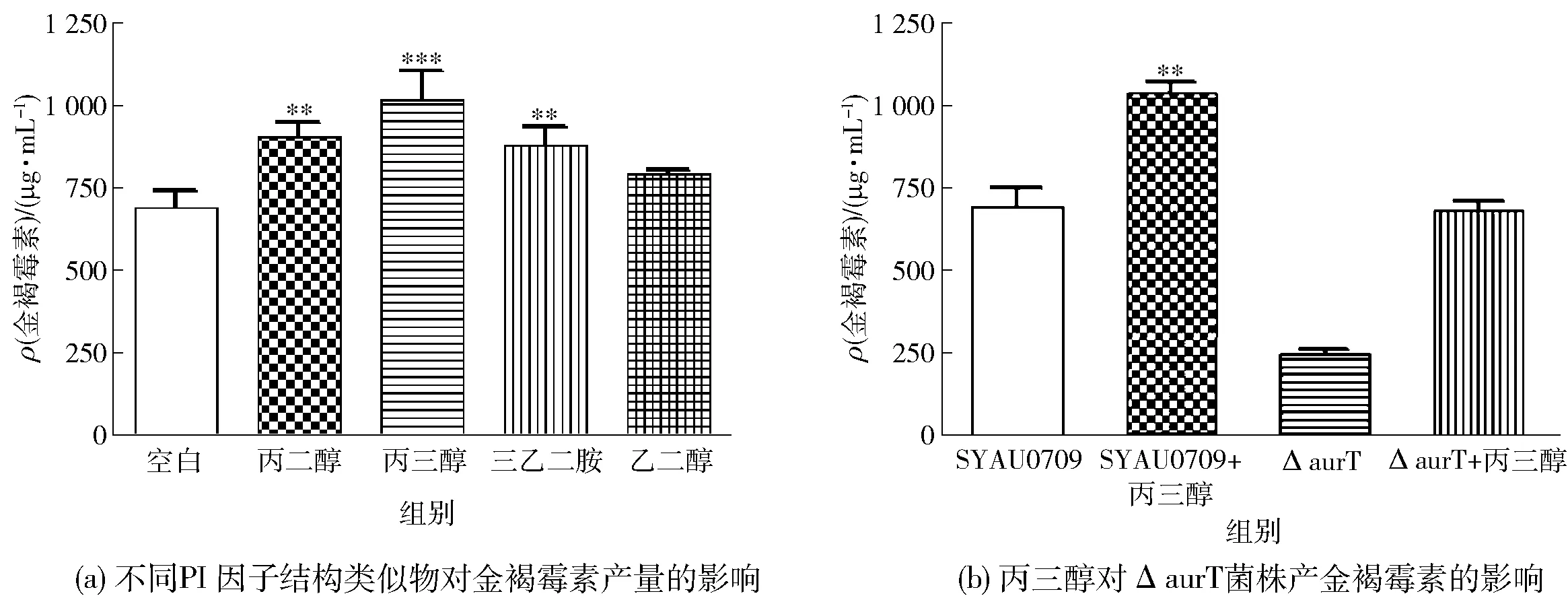
**表示P<0.01;***表示P<0.001。
图7(b)的结果表明:在野生型菌株和ΔaurT菌株培养时加入0.4 mL的丙三醇,发酵96 h后,野生型菌株的金褐霉素产量为1 034 μg/mL,比不添加时提高了1.5倍;ΔaurT菌株的金褐霉素产量起初为243 μg/mL,外源加入丙三醇后增加至784 μg/mL,与野生型菌株的产量接近。这种现象说明,PI因子结构类似物通过与基因簇内特异性受体结合,启动相关基因的表达,参与金褐霉素的生物合成调控,能够促进金褐霉素的合成。
2.6 aurT基因表达的RT- PCR分析
为了验证aurT基因表达是否受到PI因子诱导,在野生型菌株培养中,分别不添加和添加PI因子结构类似物,实验结果如图8。图8结果表明,添加PI 因子增加了aurT基因的转录水平,说明PI因子诱导aurT基因的表达,AurT可能是诱导物PI因子的输出器,当PI因子达到一定浓度后与基因簇上的受体蛋白结合,调控金褐霉素的合成[15]。
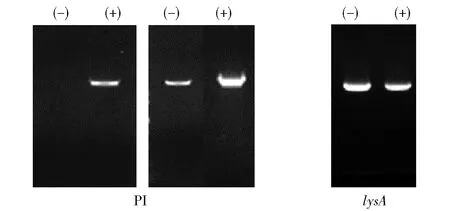
在金褐链霉菌野生型菌株培养中分别存在(+)或不存在(-)PI 因子的情况下进行分析,PCR扩增循环28个(左图)和30个(右图);lysA基因(编码二氨基庚二酸脱羧酶)的转录作为内部对照,显示了在30个PCR循环后不存在(-)或存在(+)PI因子的分析结果。
3 结 论
本研究获得了金褐链霉菌生物合成基因簇中aurT基因,645 bp,NCBI Genbank登录号为MH247109.1。根据NCBI结果分析,AurT属于RhtB家族调控因子,编码214个氨基酸,与PimT 有92%的氨基酸序列同源性,是金褐链霉菌的氨基酸转运子。
与野生型菌株比较,高效表达菌株♂aurT的金褐霉素产量为904 μg/mL,提高1.3倍,敲除菌株ΔaurT的金褐霉素产量减少65%,但是没有完全丧失生产金褐霉素能力。这说明aurT对金褐霉素生物合成有促进作用,但其调控作用不同于途径特异性调控基因aurJ3M,因为敲除基因aurJ3M会完全丧失产金褐霉素的能力。
比较了4种不同 PI 因子结构类似物对金褐霉素合成的调控作用,结果显示:丙三醇的效果最佳,当丙三醇质量浓度为0.4 μg/mL,发酵时间达96 h时,金褐霉素产量增加1.5倍,达到1 034 μg/mL;ΔaurT菌株金褐霉素产量是243 μg/mL,而外源添加丙三醇后产量提高到784 μg/mL,与野生型菌株的金褐霉素产量693 μg/mL接近,说明恢复了金褐霉素的合成。在野生型菌株培养中添加丙三醇后,通过RT-PCR反应验证PI因子诱导aurT基因的表达。丙三醇的添加增加了aurT基因的转录水平,表明丙三醇与基因簇内特异性受体结合并启动了相关基因aurT的表达,参与金褐霉素的生物合成调控。
本研究发现,在信号转导级联反应中,氨基酸输出分子参与生产多烯大环内酯类化合物,代表着我们对于了解多烯网络调控迈出了重要的一步。
