紫菜复合酶解液改善饮食诱导肥胖和调节肠道菌群作用
2022-12-31程枭杰张玉莹常耀光薛长湖唐庆娟
程枭杰,张玉莹,常耀光,薛长湖,唐庆娟
(中国海洋大学食品科学与工程学院 山东青岛 266003)
近年来,肥胖及相关代谢疾病已成为全球性疾病。肠道菌群组成和功能的变化与肥胖的发生息息相关[1],是通过膳食干预改善肥胖的重要靶点。海藻提取物等精加工产品可调节肠道菌群,辅助改善肥胖等慢性病,是食品行业的研究热点之一[2]。紫菜隶属于红藻类,营养价值高,是一种药食同源的藻。然而,当前对于紫菜产品的研究多集中于初加工产品,为数不多的精深加工产品主要有紫菜酱、紫菜油和紫菜饮料。目前,紫菜饮料的制作主要通过水提或蛋白酶降解制备紫菜原液,并利用食品添加剂调节风味[3]。该方法制作工艺简单,然而,其中含有高分子质量紫菜多糖,导致产品黏度较大,不利于后续的澄清过滤[4]。
紫菜多糖具有降血脂、调节免疫等多种生物活性[5]。通过物理法、化学法或酶法降解多糖,是充分发挥其生物活性,提高相关产品稳定性的有效途径[6]。酶解法条件温和且分子质量易控制,然而,专一酶不易获得[7]。沈照鹏等[8]利用市售琼胶酶降解紫菜,发现酶解可促进紫菜中营养物质溶出,尤其是总糖和还原糖含量显著增加。本实验室前期从海洋细菌中克隆一种新型GH16 β-紫菜酶,并将其与中性蛋白酶一同用于降解坛紫菜,所得复合酶解液与单纯蛋白酶酶解液相比黏度更低、紫菜转化率更高[9-10]。然而,其紫菜酶解液的生物活性仍需进一步研究。
综上,本研究利用中性蛋白酶和紫菜多糖酶制作紫菜复合酶解液,并通过高脂饮食小鼠模型探究其对饮食诱导肥胖的影响,以及对肠道菌群的调节作用。研究结果可为提高坛紫菜的附加值提供理论依据。
1 材料与方法
1.1 材料与试剂
坛紫菜,东山县远扬藻业有限公司。SPF 级C57BL/6J 小鼠(雄性,6 周龄,n=40),济南朋悦实验动物繁育有限公司。10%低脂饲料、45%高脂饲料,南通特洛菲饲料科技有限公司,饲料配方见表1。中性蛋白酶,南宁东恒华道生物科技有限责任公司;紫菜多糖酶Por16A_Wf,实验室自制。苏木精伊红(HE)染液,武汉赛维尔生物科技有限公司;Trizol 试剂,美国Invitrogen 公司;总胆固醇(TC)测定试剂盒、高密度脂蛋白胆固醇(HDL-c)测定试剂盒,南京建成生物工程研究所;RNA 纯化试剂盒,自天根生化科技有限公司;5×All-In-One RT 裂解反转录一体试剂盒和Eva Green Express 2×q PCR Master Mix,abm 公司。

表1 动物实验饲料成分Table 1 Ingredients of laboratory animal diets
1.2 仪器与设备
电动荧光显微镜(NIKON/Ni-E),日本尼康公司;酶标仪(SPARK 10M),瑞士TECAN;Nanodrop 2000/2000C(分光光度计),美国Thermo Scientific公司;Miseq 测序平台,美国Illumina 公司。
1.3 试验方法
1.3.1 紫菜酶解液的制备
1)紫菜单一酶解液 向40 g 紫菜中加入800 mL pH 6.5 的蒸馏水,静置复水,加入中性蛋白酶酶解。酶解条件为:按照10 500 U/g 的加酶量添加中性蛋白酶2 g,在45 ℃酶解6 h;酶解结束后,在100 ℃水浴10 min 灭酶,取出后自然沉降,4 000 r/min 离心15 min,所得上清液即紫菜单一酶解液。
2)紫菜复合酶解液 向酶解液中添加紫菜多糖酶Por16A_Wf 继续酶解。酶解条件:加酶量0.5 U/g,35 ℃酶解2 h,于100 ℃水浴中加热10 min 灭酶,然后4 000 r/min 离心15 min,所得上清液即紫菜复合酶解液。
1.3.2 紫菜酶解液理化性质分析
1)紫菜的酶解利用率 将紫菜酶解液离心,所得沉淀冻干称重,计算沉淀占干紫菜粉的比重。
2)紫菜酶解液黏度的测定 使用流变仪在25 ℃下测定样品黏度,剪切速率为0~100 s-1。
3)紫菜酶解液离心分离率及静置分层率测定 取10 mL 酶解液于离心管中,于4 ℃中放置7 d,8 000 r/min 离心10 min,取出上层溶液测定体积。离心分离率(%)=(上层溶液体积/总体积)×100。取10 mL 酶解液于刻度试管中,于4 ℃放置7 d,测定析出水层的高度(Lw)和饮料总高度(Ls)。静置分层率(%)=(Lw/Ls)×100。
4)紫菜酶解液中紫菜还原糖含量的测定 采用羟基苯甲酰肼(pHBH)法测定紫菜蛋白酶解液和紫菜复合酶解液中还原糖的含量。
1.3.3 动物饲养与取样 动物实验经中国海洋大学食品科学与工程学院动物伦理委员会批准后进行(编号SPXY2020061602)。将32 只雄性C57BL/6J 小鼠暂养1 周后,按照其体重随机分为4 组,低脂饮食组(LFD)、高脂饮食组(HFD)、紫菜单一酶解液组(SPEH)、紫菜复合酶解液组(CPEH),每组8 只(图1)。除LFD 组饲喂10%低脂饲料,其余各组均饲喂45%高脂饲料。饲喂1 周后,LFD 组和HFD 组均灌胃生理盐水,SPEH 组和CPEH 组分别灌胃两种紫菜酶解液【300 mg/(kg bw)】。小鼠两只1 笼,饲养环境为室温(23 ± 2)℃,湿度55%~58%。第10 周结束时,处死小鼠,取小肠、肝脏等组织,于-80°C 保存。

图1 动物实验设计图Fig.1 Schematic illustration of animal experiment
1.3.4 小鼠体重、摄食量及体脂率的测定 饲养期间,每两天检测1 次小鼠体重和摄食量。小鼠处死后,分别剥离皮下脂肪、附睾脂肪和肾周脂肪计算体脂率[11]。
1.3.5 血清脂质水平的测定 取小鼠血浆于灭菌离心管中,15 000 r/min 离心10 min 后取上清。用1.1 节中的试剂盒测定TC、HDL-c 水平,操作方法参照说明书。
1.3.6 脂肪组织HE 病理学分析 取白色脂肪组织用4%多聚甲醛固定,将其切成4 μm 的玻片,用HE 染色[11]。使用电动荧光显微镜观察脂肪细胞形态并拍照。各组选定5 个切片,每个切片随机选取8~10 个视野,采用Image J 软件统计脂肪大小,取平均值。
1.3.7 荧光定量PCR 分析 使用Trizol 提取肝脏、白色脂肪中的总RNA。使用RNA 纯化试剂盒去除蛋白质、无机盐离子等。使用5× All-In-One RT 反转录试剂盒制备cDNA。实时荧光定量PCR 按照EvaGreen Express 2×qPCR MasterMix试剂盒说明书操作。扩增条件:95 ℃,10 min;95 ℃,15 s,60 ℃,20 s,95 ℃,15 s(45 个循环);5 ℃升温至95 ℃(0.5 ℃/10 s),mRNA 相对表达量用2-ΔΔCT法计算。引物序列(表2)参考之前的研究进行设计[12-13]。
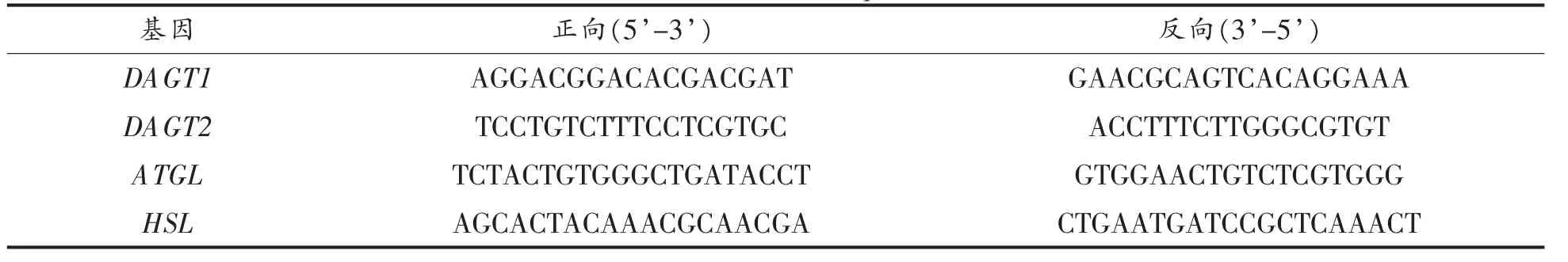
表2 引物序列Table 2 Primer sequence
1.3.8 短链脂肪酸(SCFAs)分析 采用Cao 等[14]的方法检测粪便中SCFAs 含量。称取粪便样品,加入超纯水(0.1 g ∶600 μL)后搅碎,漩涡振荡混匀。加入50%硫酸酸化处理后离心,取上清,分别加入内标二乙基丁酸和等体积无水乙醚,取1 μL用于气相色谱分析(安捷伦GC 6890)。载气为高纯氮气,所选色谱柱为安捷伦CB-FFAP(30 m ×0.25 mm,0.25 μm)。检测器为氢火焰离子化检测器(FID)。
1.3.9 16S rRNA 扩增子测序分析 以提取的粪便DNA 为模板,采用细菌515F/926R 引物扩增16S rRNA 的V4~V5 高变区序列。参考李晶等[15]的方法,进行PCR 纯化和扩增,所得PCR 产物采用Agencourt Ampure XP beat kit 核酸纯化试剂盒纯化回收。纯化后的扩增产物使用Tru SeqⓇDNA PCR-Free Sample Preparation Kit 建库试剂盒进行文库构建,文库合格后,使用Miseq 测序平台上机测序。
采用MiSeq 控制软件MCS 2.4.1 进行数据的预处理。FastQC0.11.2 软件进行测序原始数据的质量控制。随后双端读长的序列经PandaSeq 2.8 软件拼接成Contigs。由QIIME pipeline 1.9.1 去除接头和引物序列后,测序数据使用Green Gene 数据库中的数据信息进行快速多序列比对,进行物种注释分析,所得的OTU 表用于后续分析。利用R 3.6.1 中的ANCOMBC 程序包分析科水平上的显著差异菌,用selbal 程序包做balance 分析,并用Tax4Fun 程序包做肠道菌群功能预测分析。利用STAMP 软件筛选具有显著差异的肠道菌群功能(通路和酶)。
1.4 数据处理
所有试验数据均用SPSS 25.0 软件进行统计分析,作图均采用GraphPad Prism 8.0 专业软件,结果以平均值±标准差表示,组间差异采用单因素方差分析(One-Way ANOVA),以P<0.05 表示差异有统计学意义。
2 结果与分析
2.1 紫菜酶解液理化性质
2.1.1 紫菜的酶解利用率 单一酶解液和复合酶解液的紫菜酶解利用率分别为63%和78%,表明紫菜多糖酶的使用有利于对紫菜的充分利用。
2.1.2 紫菜酶解液黏度 图2 为剪切速率对紫菜酶解液黏度的影响。在剪切速率为0~100 s-1的条件下,紫菜单一酶解液的黏度为2~15 Pa·s,紫菜复合酶解液的黏度为1.9~8.5 Pa·s。由此可知,在紫菜多糖酶的作用下,复合酶解液的流变性与水接近,表明紫菜多糖酶显著降低了酶解液的黏度。

图2 紫菜酶解液黏度Fig.2 Viscosity of the porphyra enzymatic hydrolysate
2.1.3 紫菜酶解液的稳定性 如表3 所示,两种酶解液离心分离率和静置分层率间存在明显的差异,表明在不添加食品稳定剂时,复合酶解液放置7 d 后稳定性高于单一酶解液。

表3 紫菜酶解液稳定性Table 3 The stability of the porphyra enzymatic hydrolysate
2.1.4 紫菜酶解液中还原糖含量 如表4 所示,与紫菜单一酶解液相比,复合酶解液中还原糖含量增加了17.5%(以干质量计)。这说明在紫菜溶胀复水及蛋白酶酶解过程中,紫菜多糖被溶出,并在紫菜多糖酶的作用下被水解。

表4 紫菜酶解液还原糖含量Table 4 Reducing sugar content in the porphyra enzymatic hydrolysate
2.2 紫菜酶解液对肥胖小鼠体重、摄食量及能量摄入量的影响
肥胖的发生是因长期能量摄入过剩,临床上以体重增加和脂肪异常堆积为主要特点。饲养期间小鼠的体重和摄食量变化见图3a 和3b,各组小鼠体重保持稳定增长。摄入高脂饮食后,HFD 组小鼠体重增长率显著高于LFD 组(P<0.001),CPEH组小鼠体重增长率明显低于HFD 组(P<0.05),而CPEH 干预对HFD 小鼠能量摄入无明显影响。

图3 紫菜酶解液对高脂饮食小鼠体重、摄食量、体重增长率及能量摄入量的影响Fig.3 Effects of the porphyra enzymatic hydrolysate on body weight,food intake,body weight growth rate and mean energy intake in high fat diet-fed mice
2.3 紫菜酶解液对肥胖小鼠血脂水平的影响
长期摄入高脂膳食导致血清TC 水平上升,同时用于转运胆固醇的HDL-c 含量下降[16]。如图4所示,用紫菜酶解液干预后,SPEH 组和CPEH 组的血脂水在一定程度上得到改善,其中CPEH 改善血脂水平效果更为显著(P<0.05)。
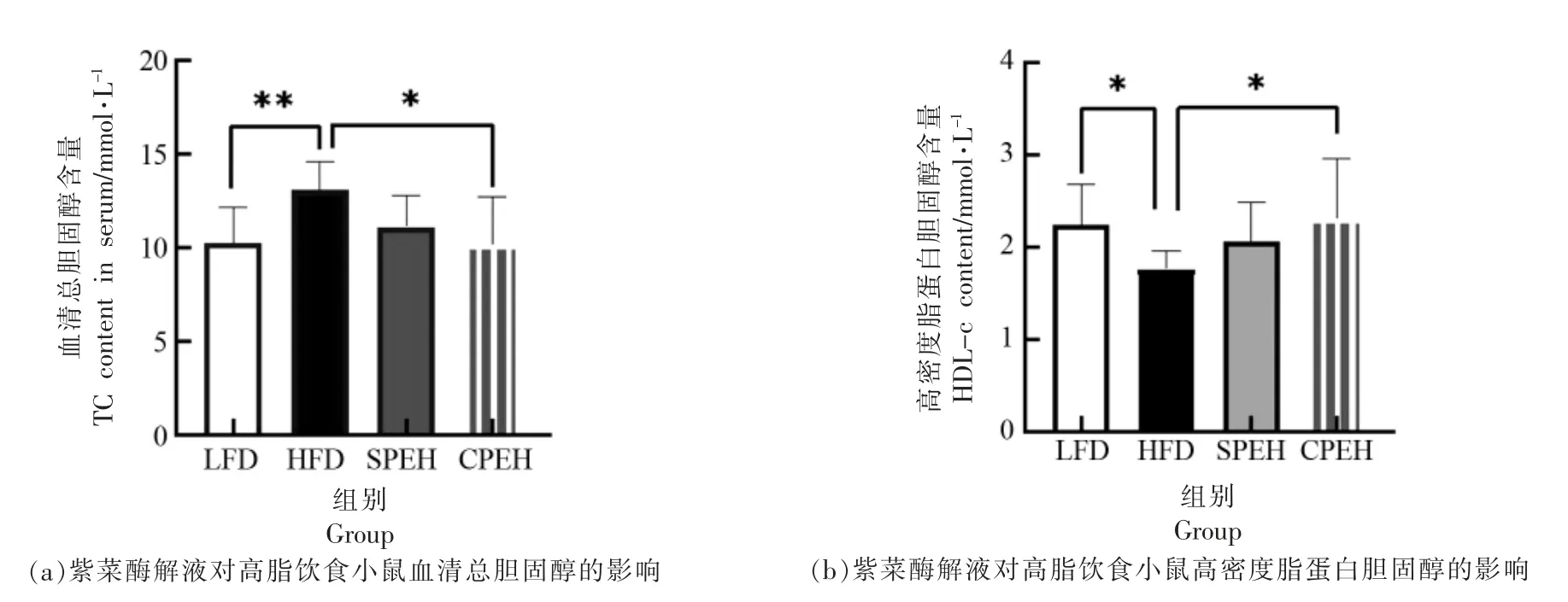
图4 紫菜酶解液对高脂饮食小鼠血清脂质水平的影响Fig.4 Effects of the porphyra enzymatic hydrolysate on serum lipid levels in high fat diet-fed mice
2.4 紫菜酶解液对肥胖小鼠脂肪细胞形态和体脂率的影响
脂肪细胞形态和尺寸的变化是脂肪沉积的重要特征[17]。如图5 所示,LFD 组小鼠细胞面积小,各细胞间大小均匀;HFD 组小鼠脂肪面积大,大小不均匀且细胞形态不规则。紫菜酶解液干预后,SPEH 组小鼠脂肪细胞形态、尺寸均未得到明显改善;CPEH 组与LFD 组脂肪的大小和数量较为接近。总之,紫菜复合酶解液可有效改善高脂饮食诱导的肥胖,且效果优于单一酶解液。

图5 紫菜酶解液对高脂饮食小鼠脂肪细胞形态、大小及体脂率的影响Fig.5 Effects of the porphyra enzymatic hydrolysate on adipocyte morphology and size,and body fat percentage of high fat diet-fed mice
2.5 紫菜酶解液对肥胖小鼠脂代谢相关基因的影响
饮食诱导脂代谢紊乱主要表现为脂肪合成水平升高,而脂肪分解利用水平下降。肝脏是人体内源性TG 合成的重要场所。二脂酰甘油酰基转移酶(DGAT1 和DGAT2)能催化TG 合成的最后一步[18]。如 图6 所 示,与HFD 组 比 较,CPEH 组 肝 脏DAGT1 的mRNA 的表达水平降低了31.62%,且肝脏DAGT2 的mRNA 的表达水平显著降低(P<0.05)。

图6 紫菜酶解液对高脂饮食小鼠脂代谢相关基因表达的影响Fig.6 Effects of the porphyra enzymatic hydrolysate on genes related to lipid metabolism of high fat diet-fed mice
脂肪甘油三酯脂肪酶(ATGL)和激素敏感脂肪酶(HSL)是参与细胞内TG 降解的关键酶[19]。与HFD 组比较,SPEH 组的白色脂肪ATGL 和HSL的mRNA 的表达水平显著升高(P<0.05)。结果表明,紫菜复合酶解液干预显著改善饮食诱导的脂代谢紊乱。
2.6 紫菜酶解液对SCFAs 合成的影响
SCFAs 是肠道菌群的主要代谢产物,在宿主脂质代谢调节中发挥积极的作用[20]。如图7 所示,与LFD 组相比,HFD 组的乙酸、丙酸和丁酸水平分别下降了45.9%,40.6%和38.3%。与HFD 组相比,CPEH 组的乙酸、丙酸、异丁酸的水平显著增加(P<0.05)。总之,紫菜复合酶解液干预10 周,可促进HFD 小鼠结肠内SCFAs 的产生,说明复合酶解液干预或许有助于调节HFD 小鼠肠道菌群。
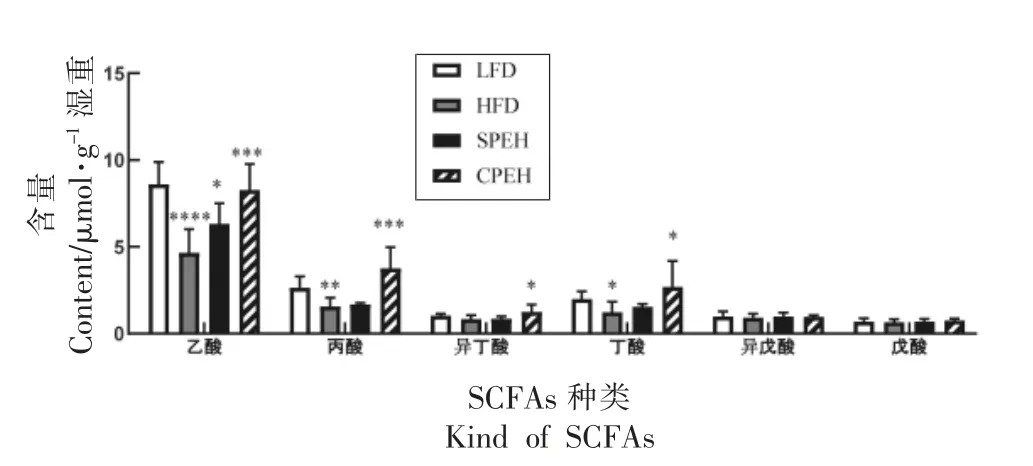
图7 紫菜酶解液对高脂饮食小鼠粪便中SCFAs 含量的影响Fig.7 Effects of the porphyra enzymatic hydrolysate on fecal SCFAs content in high fat diet-fed mice
2.7 紫菜酶解液对肥胖小鼠肠道菌群结构和组成的影响
2.7.1 对肥胖小鼠厚壁菌门和拟杆菌门比例的影响 研究表明,肥胖人群中厚壁菌门和拟杆菌门比例(Firmicutes/Bacteroidetes,F/B)升高,并且通过饮食干预可降低F/B 比例[21]。图8 可知,与HFD组相比,CPEH 组小鼠肠道菌群中F/B 比例显著降低(P<0.5)。

图8 紫菜酶解液对高脂饮食小鼠厚壁菌门和拟杆菌门(F/B)比例的影响Fig.8 Effects of the porphyra enzymatic hydrolysate on the ratio of Firmicutes to Bacteroidetes(F/B)in high fat diet-fed
2.7.2 对肥胖小鼠肠道菌群组成的影响 利用ANCOM 来分析组间显著差异的肠道细菌,结果见表5。与LFD 组比较,HFD 组链球菌科(Streptococcaceae)等相对丰度显著增加(校正后的P 值(Adjusted P value)小于0.01),红蝽菌科(Coriobacteriaceae)等相对丰度显著减少(校正后的P值小于0.01))。SPEH 组红蝽菌科等相对丰度显著高于HFD 组(校正后的P 值小于0.01)。与HFD组相比,CPEH 组Muribaculaceae 和螺杆菌科(Helicobacteraceae)等相对丰度显著增加(校正后的P值小于0.01),链球菌科相对丰度显著减少(校正后的P 值小于0.01))。以上结果表明紫菜酶解液的干预对高脂饮食小鼠肠道菌群组成影响显著。

表5 基于ANCOM 分析的科水平上组间显著差异的肠道细菌Table 5 Differentially abundant taxa at family level between groups identified by ANCOM
采用Selbal 分析,研究高脂饮食和两种紫菜酶解液显著调节的肠道细菌特征。如图9a 所示,由葡萄球菌科和毛螺菌科组成的整体平衡,准确预测了低脂饮食小鼠和高脂饮食小鼠之间微生物特征的变化(AUC=1.0)。由图9b 可知,厌氧菌科(Anaerovoracaceae)和链球菌科组成的平衡可以解释复合酶解液调节的微生物特征。链球菌科和厌氧菌科之间的平衡值为正值,较低的平衡值表明CPEH 减少了链球菌科的相对丰度。类似的,由消化链球菌科(Peptostreptococcaceae)和Muribaculaceae 组成的平衡对SPEH 处理具有很高的预测准确性(AUC=0.953,图9c)。
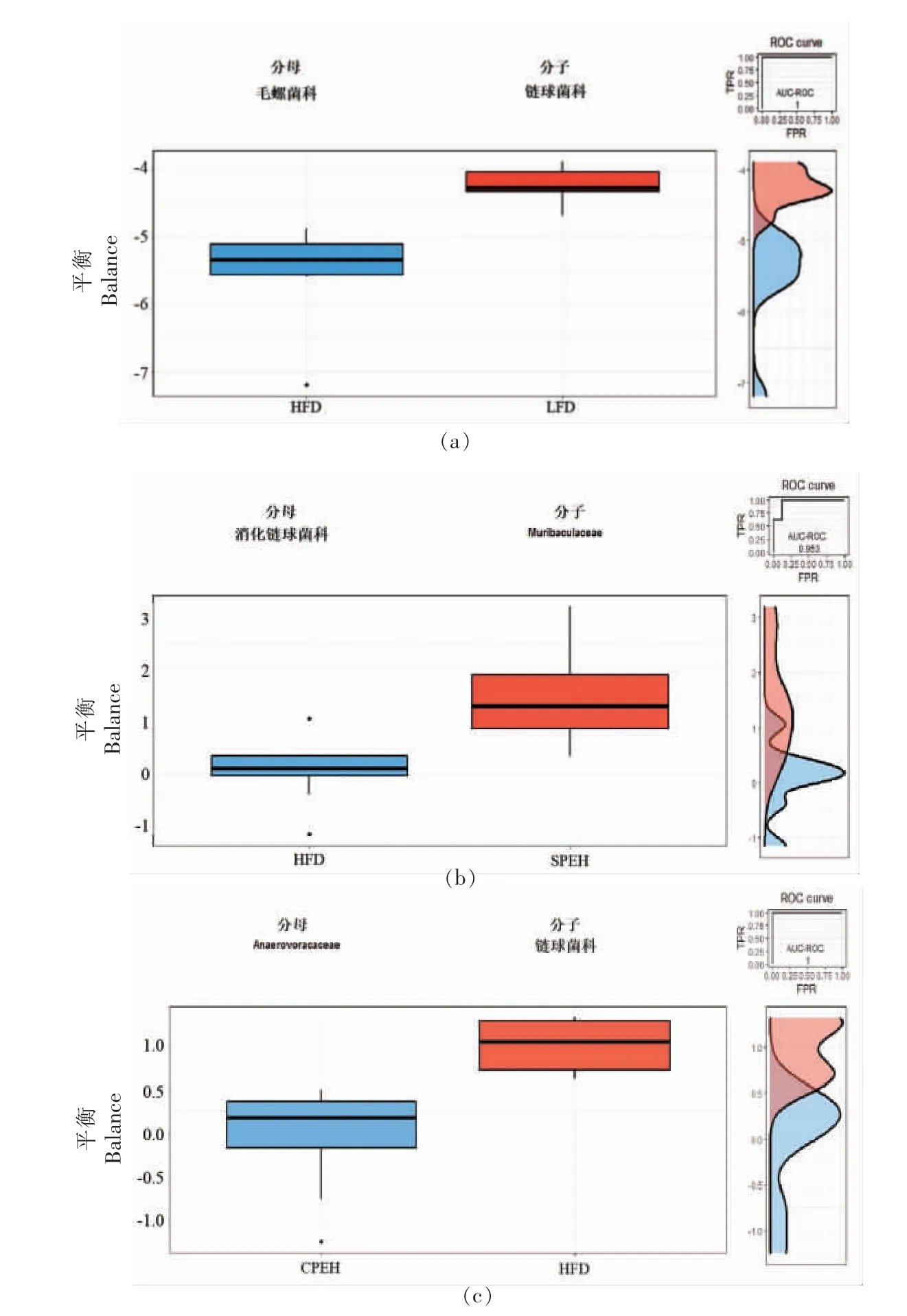
图9 紫菜酶解液对高脂饮食小鼠肠道菌群特征的影响Fig.9 Effects of the porphyra enzymatic hydrolysate on gut microbial feature of high fat diet-fed mice
2.8 紫菜酶解液对微生物功能的影响
将16s 测序数据与KEGG 数据库比对,对肠道菌群进行功能注释,进而将菌群功能与宿主代谢相联系。利用STAMP 软件分析组间显著差异的KEGG 通路,尤其是与脂代谢相关的通路。由图10a~10c 可知,与LFD 组相比,HFD 组有3 条通路(“脂代谢”“膦酸酯和次膦酸酯代谢”和“甘油酯代谢”)被抑制。此外,紫菜复合酶解液干预显著上调了“甘油酯代谢”。
值得注意的是,在HFD 组和CPEH 组间具有显著差异的酶,多与能量代谢、脂代谢等有关。由图10d~10f 可知,其中3 种酶(K00057“甘油-3-磷酸脱氢酶[EC:1.1.1.94]”,K01755“精氨酸代琥珀酸裂解酶[EC:4.3.2.1]”和K01940“精氨基琥珀酸合酶[EC:6.3.4.5]”)在HFD 组中显著富集。而与HFD 组相比,CPEH 组中的3 种酶的丰度均显著降低(P<0.5)。CPEH 干预影响了肠道菌群的功能。
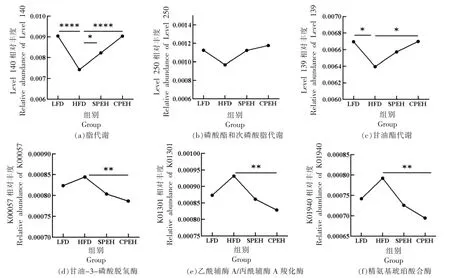
图10 紫菜酶解液对高脂饮食小鼠肠道菌群功能的影响Fig.10 Effects of the porphyra enzymatic hydrolysate on gut microbial function of high fat diet-fed mice

表6 基于ANCOM 分析的科水平上组间显著差异的肠道细菌Table 6 Differentially abundant taxa at family level between groups identified by ANCOM
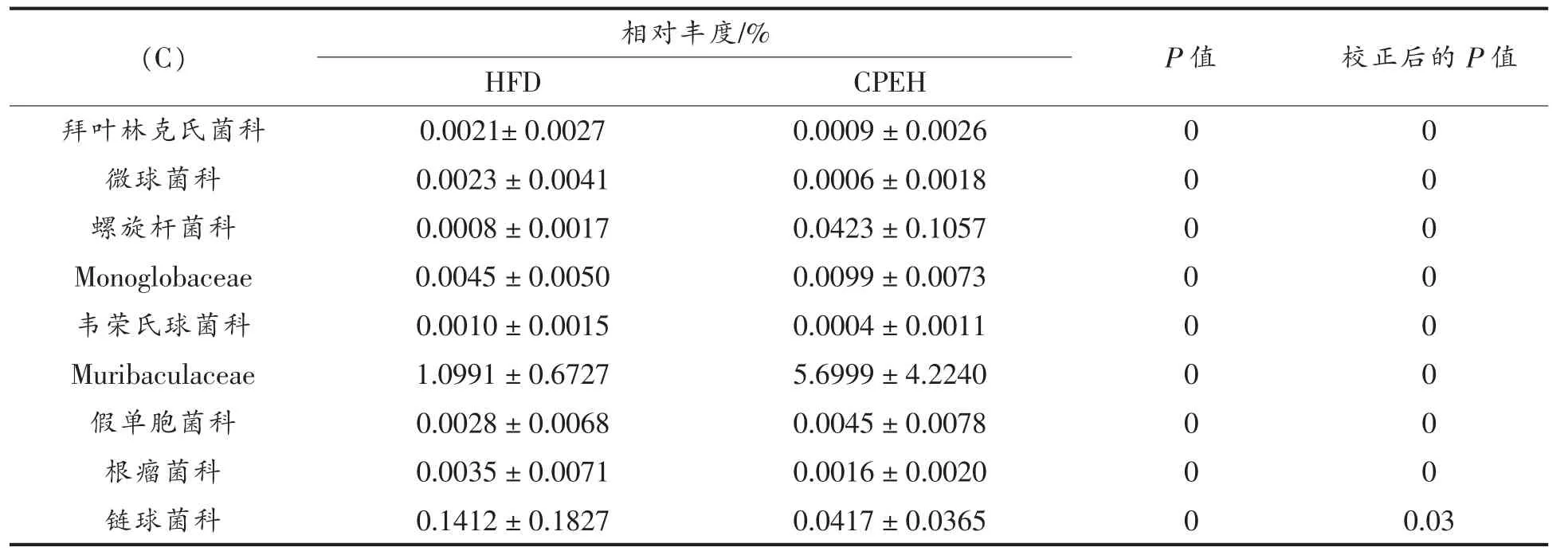
表7 基于ANCOM 分析的科水平上组间显著差异的肠道细菌Table 7 Differentially abundant taxa at family level between groups identified by ANCOM
综上,摄入紫菜复合酶解液可以调节肠道菌群组成,改善肠道细菌脂质代谢功能,从而有助于预防高脂饮食诱导的肥胖。
3 结果与讨论
本研究表明,紫菜多糖酶的使用提高了紫菜的酶解利用率,改善了酶解液的黏度和稳定性。此外,紫菜复合酶解液可有效预防高脂饮食诱导的肥胖,其机制是在转录水平上抑制肝脏脂肪的合成,促进脂肪组织中脂肪水解,进而降低血清脂质水平,减少体脂蓄积。
SCFAs 主要由乙酸组成,可参与调节宿主代谢调节,减少脂肪堆积[22]。紫菜复合酶解液提高了粪便中SCFAs(尤其是乙酸和丙酸)的水平。Xu等[23]利用坛紫菜多糖作为唯一碳源培养肠道菌群,发现肠道菌群可以降解紫菜多糖,从而促进SCFAs 合成。由此推测,与紫菜单一酶解液相比,复合酶解液中含有被降解的多糖,更容易被肠道菌群利用,增加了SCFAs 的产量,从而有助于改善饮食诱导的脂代谢紊乱。
肥胖患者肠道菌群组成会发生显著变化[24]。紫菜复合酶解液的干预可以降低高脂饮食小鼠肠道内F/B 比例,或许有助于改善宿主的能量代谢[25]。有研究指出,长期摄入高脂饮食会导致Muribaculaceae 和螺杆菌科丰度降低,而链球菌科丰度增加[26]。复合酶解液干预有助于提高Muribaculaceae和螺杆菌科的相对丰度,很可能与饮食诱导肥胖的改善有关[27]。根据功能预测的结果,紫菜复合酶解液干预可以改善脂代谢相关通路(如“甘油酯代谢”)。Cao 等[28]研究表明“甘油酯代谢”通路与高脂饮食诱导肥胖的发生密切相关,表明复合酶解液干预可以促进肠道菌群分解、利用脂质。总之,肠道菌群在紫菜复合酶解液改善饮食诱导脂质代谢中发挥了重要的作用。
4 结论
紫菜复合酶解液干预可以改善肠道菌群结构和组成,调节与脂质代谢相关的肠道菌群功能,并且预防高脂饮食诱导的肥胖。后续研究将在复合酶解液的基础上,添加辅料制备紫菜饮料,并进一步探究其生物活性。
