产氰混合菌浸出废弃线路板中金的实验研究
2021-02-02李晶莹温江先
郭 洋,李晶莹,温江先,徐 桐
(青岛科技大学 环境与安全工程学院,山东 青岛266042)
随着电子科技的飞速发展,手机、电脑等电子产品更新换代迅速,从而产生大量电子废弃物[1]。电子废弃物(E-wastes)也被称为废弃电子电气设备(WEEE),是指设备在生产、设计以及消费过程中,由于各种故障导致寿命终止或者丧失其审美价值,不能继续发挥它的使用功能而最终被丢弃的电子产品[2]。其中废弃线路板占据很大一部分,废弃线路板中含有丰富的金属资源,如Au、Ag、Cu、Fe、Al等,回收再利用的价值很高,因此废弃线路板被称之为“城市矿山”[3-5]。根据联合国环境规划署,电子废弃物产生量约为5 000万t·a-1,占全球固体废物总量的5%,且呈现每年增加500万t的趋势[6]。
处理废弃线路板(WPCB)常用的化学方法浸金速度快、效率高[7],但由于线路板中含有铅等重金属、阻燃剂等有毒有害物质[8],处理方法不当,不仅会对环境造成污染,还会危害人体健康,与环保这一大趋势背道而驰,因而开发一种相对绿色环保的处理方法非常重要[9-10]。利用生物浸出法具有成本低、环境友好,可减少土地资源占用等优点,因此,微生物法浸出技术正越来越广泛地被应用于线路板处理方面。
目前大多数的文章都是研究单个菌种对浸金的影响,很少有研究混合菌种对金的浸出,本研究主要以荧光假单胞菌和绿脓杆菌的混合菌为研究对象,将线路板中的金进行生物浸出,并通过控制单一变量进行多组平行实验来探究最佳浸金条件。
1 实验部分
1.1 材料与仪器
废旧老年机主板,购买于青岛市李村飞拉利电子信息城;荧光假单胞菌(型号为CICC21620)、绿脓杆菌(型号为ATCC 10145)、HNO3、氢氧化钠、蒸馏水、氢氟酸、浓盐酸、HCl O4、牛肉膏、蛋白胨、NaCl、琼脂粉。
密封式粉碎机,GJ-1型,昆山广测仪器设备有限公司;电子分析天平,AR1530型,美国奥豪斯公司;循环水式多用真空泵,SHZ-D 型,郑州生化仪器有限公司;热鼓风干燥箱,GZX-90330MBE 型,上海博讯医疗生物仪器股份有限公司;微波消解仪,MARS 5型,邢台天滕机械设备制造厂;火焰原子吸收分光光度计,TAS-986型,北京普析通用公司;智能光照培养箱,LGZ-260A型,宁波东南仪器有限公司。
1.2 微生物法实验原理
产氰菌中产生HCN 的代谢前体甘氨酸浓度可能会影响氰化物的溶解[11]。HCN 的形成是甘氨酸经过氧化脱羧形成的次级代谢物,其化学反应方程式如下所示:
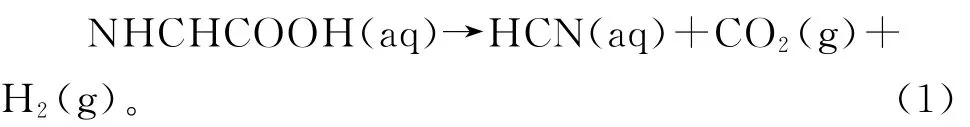
产氰菌中氰化物是一种次生代谢产物,金可以与氰化物反应生成稳定的络合态的离子[12]。金与氰离子反应会生成稳定的络合物,p H 值越低,Au的溶解度越低,因为氰化物仅在其游离离子CN-状态下被去质子化时才会促进Au 的氧化[13]。微生物浸金的反应机理:

产氰菌通过将废弃线路板中的金以络合态的形式浸出到溶液中,在通过电解、萃取等方式将络合态的形式转化为金属单质的形式将金属得到回收的目的。利用微生物来进行生物浸金的过程是一个环境无害化的技术,这使得生物氰化工艺成为有吸引力的工艺[14]。
1.3 实验方法
1.3.1 废弃线路板预处理以及元素的测定
将购买的废旧手机使用钳子、电加热板将其拆解出没有任何元器件的线路板,再用铁皮剪将线路板剪成约1 cm2的小块,放入粉碎机中粉碎成粉末[15],孔径74μm 国家标准分子筛后为后续试验做准备。为了将粉末中的铜等杂质金属去除避免干扰后续实验,在三角烧瓶中加入V(硝酸)∶V(蒸馏水)=1∶3共120 m L对5 g线路板粉末进行酸浸1 h,真空抽滤泵抽滤并用蒸馏水洗涤至p H 为7,不断重复此步骤。将粉末放于干燥箱中进行干燥。将酸浸的和未酸浸的线路板粉末称取0.2 g各5份置于微波消解仪中在每个消解罐中分别加入浓硝酸6 m L、浓盐酸2 m L、过氧化氢1 m L 以及氢氟酸0.5 m L进行消解,消解后倒入坩埚中在电加热板上进行赶酸,将其中的液体赶到1 m L 后倒入50 m L 容量瓶中用体积分数为3%的硝酸定容。配置金标准溶液将其与消解液利用火焰原子吸收分光光度计进行测定元素含量。测得酸浸处理前后金的含量分别为0.056和0.134 mg·g-1,铜的含量分别为125和0.389 mg·g-1。
1.3.2 混合产氰菌液浸金研究
本实验以无菌的150 m L 液体培养基为基础,加入荧光假单胞菌和绿脓杆菌的混合菌液(购买的产氰菌的配置配方每升蒸馏水中牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂20.0 g,其中液体培养基中无琼脂),通过改变不同的影响因素,在菌液生长到对数生长期中期时(24 h)加入线路板粉末继续培养细菌,每隔一定的时间间隔取5 m L 溶液透过0.45μm 微孔滤膜过滤后取上清液采用火焰原子吸收分光光度法测定金属元素含量,从而探求其浸金率,取样后应补加等量蒸馏水于锥形瓶中。
2 结果与讨论
2.1 混合菌液接种比例对混合浸金的影响
在无菌环境下利用移液管准确移取培养24 h的p H=9.0 绿脓杆菌与荧光假单胞菌(按1∶3、1∶2、1∶1、2∶1、3∶1的比例)混合菌液共10 m L,分别接种到冷却后的液体培养基中。将培养基置于水浴振荡器,设定温度37℃,转速150 r·min-1,振荡培养。24 h后加入0.2 g线路板粉末,根据时间间隔取样测定。
图1显示了加入不同比例的荧光假单胞菌和绿脓杆菌时混合菌液的浸金效率。从图1可以明显的看出,随着时间的增长,无论荧光假单胞菌和绿脓杆菌的加入比例是多少,产生的浸金率随时间的增长而逐渐增加。其中,可以明显的看出当溶液中荧光假单胞菌和绿脓杆菌的加入比例相差悬殊的情况下,对线路板粉末浸金率的影响最大,产生的效率都比其余的比例条件下的效率低。V(荧光假单胞菌)∶V(绿脓杆菌)=1∶3,3∶1时的浸金率比其余相当比例下的小的多,其中在V(荧光假单胞菌)∶V(绿脓杆菌)=2∶1时的浸金效率在所有的加入比例中是最大的。
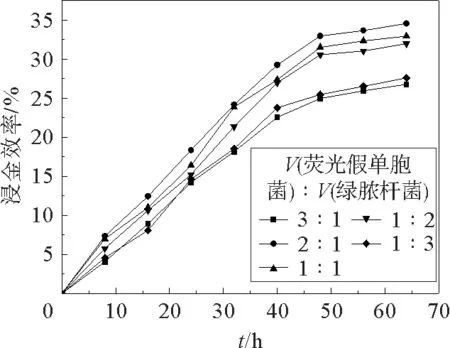
图1 荧光假单胞菌和绿脓杆菌混合菌液加入比例对浸金效率的影响Fig.1 Gold leaching efficiency of Pseudomonas fluorescens and Pseudomonas aeruginosa at different proportions
由于绿脓杆菌的生长繁殖能力较荧光假单胞菌来说比较强,在刚加入到培养基时前期会形成优势的菌种,生长繁殖能力比荧光假单胞菌快,二者形成竞争关系,绿脓杆菌占据了培养基中的大部分营养物质,但此菌种的的产氰量较荧光假单胞菌低,所以加入比例较大时产生的浸金率较低。荧光假单胞菌较绿脓杆菌而言生长缓慢,加入较大比例时,与绿脓杆菌竞争培养基中的营养物质,菌液浓度较低,所以浸金率较低。两种菌加入比例相当时,两种菌优势互补,荧光假单胞菌的产氰量较绿脓杆菌高,绿脓杆菌的生长繁殖速度较快,可以增强对外界环境变化的抵抗力,获得较好的浸金效果。最大浸金率出现64 h在V(荧光假单胞菌)∶V(绿脓杆菌)=2∶1时,为34.57%。
2.2 菌液加入量对混合浸金的影响
在无菌操作台中,分别用经过灭菌的移液管准确移取培养了24 h的p H=9.0的V(荧光假单胞菌)∶V(绿脓杆菌)=2∶1的菌液5,10,15,20,25 m L,接种到冷却后的液体培养基中,将培养基置于水浴振荡器振荡培养,设定温度37℃,转速150 r·min-1。24 h后加入0.2 g线路板粉末,根据时间间隔取样测定。
图2描绘了在液体培养基中加入不同量的V(荧光假单胞菌)∶V(绿脓杆菌)=2∶1 的混合菌液对实验中浸金效率的影响。在图2中明显的可以看出,混合菌液的浸金率随着时间的不断增加而逐渐增加,在30 h之前混合菌液的浸金率增长速率较快,这主要是因为产氰菌在30 h之前处于适应期、对数生长期和稳定期前期阶段,产生大量的HCN 合成酶从而促进浸金反应,使浸金率增长速度较快,在30 h之后,产氰菌处在稳定期后期和衰亡期阶段,这主要可能是浸出液中的氰化物前期已经被消耗了,仅剩少许的HCN 在反应中浸金,产氰菌营养物质不够存活,因此慢慢地浸出液中的浸金率趋于平缓,直到60 h左右趋于平缓不再增加。此外,在加入不同量的菌液的曲线中可以比较看出随着加入量的不断增加,浸金率逐渐降低,在150 m L液体培养基中加入5 m L 的混合菌液产生的浸金率最高,在菌液的适应期阶段浸金率的增加速率是差不多的,但在后期阶段浸金率则随着时间的增加曲线增加大不相同,这主要是因为加入的菌液越多,产氰菌互相竞争营养物质,导致培养基中的营养物质迅速减少,后期营养物质不能满足产氰菌正常进行新陈代谢活动,因此5 m L 是最佳的菌液加入量,最高的浸金率为39.23%。
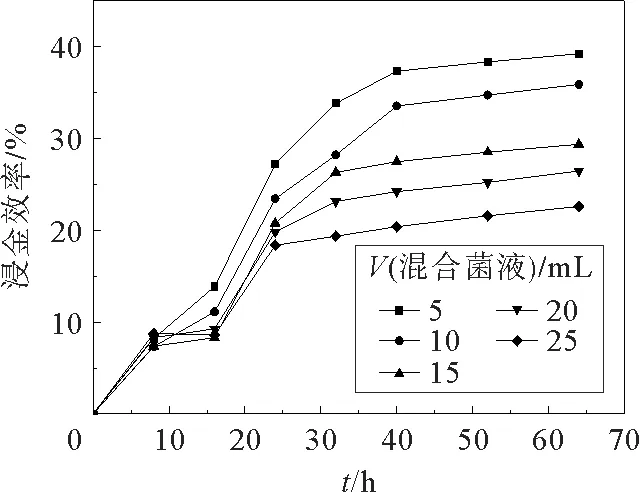
图2 荧光假单胞菌和绿脓杆菌混合菌液加入量对浸金效率的影响Fig.2 Gold leaching efficiency of Pseudomonas fluorescens and Pseudomonas aeruginosa at different amount of bacterial solution
2.3 粉末加入量对混合浸金的影响
在无菌操作台中,分别用经过灭菌的移液管准确移取培养了24 h的p H=9.0,V(荧光假单胞菌)∶V(绿脓杆菌)=2∶1的菌液5 m L接种到冷却后的液体培养基中,将培养基置于水浴振荡器,设定温度37 ℃,转速150 r·min-1,振荡培养。24 h后分别加入0.1,0.2,0.3,0.4,0.5 g经酸浸预处理后的线路板粉末,根据时间间隔取样测定。
WPCB粉末不同的加入量(液固比)是产氰菌浸金的又一个重要的影响因素,结果见图3。从图3可以看出,随着加入WPCB 粉末的不断增加,产氰菌的浸金率在不断降低;随时间的增加而增加,最后趋于平缓。其原因一是粉末加入量越多所含有的杂质金属越多,而这些金属与氰化物相互作用远比金更容易,使与金作用的氰化物急剧降低,与金形成竞争关系从而导致浸金率下降。二则是粉末中含有大量的贵金属以及有害金属,而这些有害金属则会对细菌的生长代谢过程产生抑制作用,从而影响产氰菌产生HCN,毒害产氰菌的生存环境,使产氰菌逐渐衰老死亡,最终使实验结果浸金率趋于平缓。粉末加入量为0.1 g时浸金效果最好,最高的浸金率为48.51%。
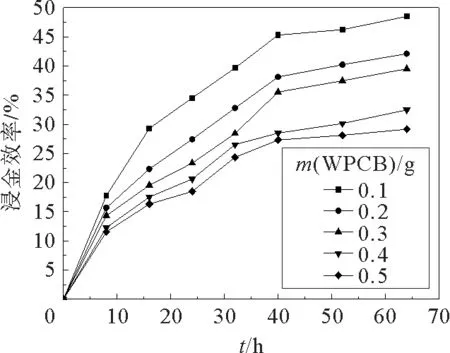
图3 不同WPCB粉末加入量下混合菌液的浸金效率Fig.3 Gold leaching efficiency of Pseudomonas fluorescens and Pseudomonas aeruginosa at different WPCB powder addition
2.4 NaCl浓度对混合浸金的影响
在无菌操作台中,分别用经过灭菌的移液管准确移取培养了24 h的p H=9.0的V(荧光假单胞菌)∶V(绿脓杆菌菌液)=2∶1的菌液5 m L 接种到冷却后的150 m L液体培养基中,准确称取0.75,1.50,2.25,3.00 g NaCl置于相应的锥形瓶中,配置成Na+浓度分别为8.5×10-2,1.7×10-1,3.4×10-1,5.1×10-1mol·L-1的培养基,其中空白样不添加。将培养基置于水浴振荡器振荡培养,24 h后分别加入0.1 g经酸浸预处理后的线路板粉末,根据时间间隔取样测定。
经过计算得出在不同浓度的NaCl下混合菌液的浸金率,绘制出的变化曲线见图4。由图4可以明显的看出,添加NaCl可以促进浸金,当NaCl的添加浓度为3.4×10-1mol·L-1时,测得的浸金率最高,最高的浸金率为65.33%,可见营养盐对浸金的效果影响相当显著,NaCl对产氰菌浸金的影响是最大的,提高量也是最高的。这主要是因为NaCl能够极大地促进产氰菌中酶的活性,使产氰菌产生较多的氰化物,是一种极为有效的催化剂和激活剂[16]。但是如果添加过量,则会抑制浸金反应的进行,因此在实验中可适当的添加一定量的NaCl来促进浸金反应的进行,提高浸金率,更多地回收线路板中的金。
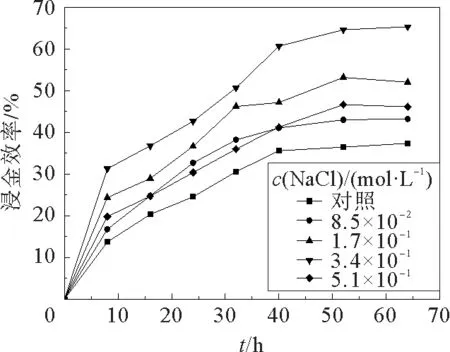
图4 不同NaCl浓度下混合菌液的浸金效率Fig.4 Gold leaching efficiency of Pseudomonas fluorescens and Pseudomonas aeruginosa at different concentrations of NaCl
3 结 论
通过改变荧光假单胞菌和绿脓杆菌的菌液混合比例,V(荧光假单胞菌)∶V(绿脓杆菌)=2∶1时两种细菌优势互补,浸金率最高。在一定条件下,金的浸出率随着菌液加入量的增加而逐渐降低,5 m L是最优的菌液加入量。废弃线路板粉末加入量为0.1 g时,金的浸出率最高;NaCl能够极大地促进产氰菌中酶的活性,是一种极为有效的催化剂,当NaCl的添加浓度为3.4×10-1mol·L-1时,溶液的浸金率最高可达65.33%。利用产氰菌进行浸出是一种相对绿色环保的处理方法,荧光假单胞菌和绿脓杆菌混合浸出金属元素还需要继续通过优化条件来进一步提高浸金率。
