Cu2-xSe-AIPH纳米材料的合成及体外抗癌性能研究
2021-01-29毛旖旎
陆 娟,毛旖旎,杨 骏
(西南大学 化学化工学院,重庆 北碚 400715)
0 引言
如今,癌症已经成为全世界人们健康的重大威胁之一,每年有无数人因癌症失去生命。而传统的化疗、放射性治疗、手术治疗等治疗方式存在着副作用较大、治疗效率低等问题,因此开发一些新颖有效的癌症治疗方式刻不容缓[1-5]。近年来,光热治疗(photothermal therapy,PTT)因其较低的侵入性在癌症治疗领域引发了越来越多科学家的关注[6-8]。其治疗原理是光热材料在吸收外界的光能之后可以将其有效地转换为热能,进而引发癌细胞的凋零或死亡。基于此,一批又一批优良的光热材料不断地被挖掘出来,其中包括具有独特物理和化学性能的二元硫属化合物[9]。同时,近红外光由于其相比于紫外光有更深的生物组织穿透深度,也与癌症治疗紧密地联系了起来[10-12]。
利用硒化物Cu2-xSe的光热效应并将其与其他治疗试剂结合。采用了经典的高温热解法合成了粒径分布为20-40 nm的Cu2-xSe纳米粒子,经由氨基修饰后负载上化合物2,2′-偶氮二[2-(2-咪唑啉-2-基)丙烷]二盐酸盐(AIPH),一种能在加热过程中迅速分解产生有毒烷基的偶氮化合物。由于肿瘤细胞间隙较大导致肿瘤微环境具有高通透性和滞留效应(EPR),抗肿瘤纳米材料会被动、靶向地聚集到肿瘤位点发挥治疗作用;人体正常组织在没有额外光热的条件下,其37 ℃左右的体温是不会使AIPH分解产生自由基的。因此AIPH本身不会对生物体正常组织造成损害。由于铜原子的缺失,Cu2-xSe纳米粒子在生物组织穿透力较强的近红外区域具有强烈的等离子体激元共振吸收(LSPR)和优异的光热性能,已经被越来越多地应用于光热治疗领域。本体系合成的Cu2-xSe-AIPH纳米粒子在吸收了808 nm的近红外光后,产生的光热温度可以达到48 ℃,足够用于光热治疗。在近红外光的作用下,Cu2-xSe纳米粒子的光热效应与AIPH自由基可以发挥协同作用杀死肿瘤细胞,通过体外系列实验初步证明了Cu2-xSe-AIPH材料的抗癌性能。
1 实验部分
1.1 实验试剂
本实验所用试剂氯化亚铜(CuCl)、氨基化聚乙二醇(NH2-PEG(2000)-NH2)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)以及油胺、十八烯、无水乙醇(C2H5OH)均为分析级,未进一步纯化而直接用于实验过程。所有化学品均购自Sigma-Aldrich公司。除了从国药集团化学试剂有限公司购买的硒粉(Se)。
1.2 制备过程
Cu2-xSe纳米粒子是根据以前的文献稍作改变,通过典型的溶剂注入法合成的[13]。制备过程主要分为两个阶段,首先合成Se-OAm(硒-油胺)的前驱体。称取10 mmol的硒粉和10 mL的油胺于三口瓶中,搭建好热解装置,通氮气,用加热套将其加热至140 ℃,保持10 min即可,以除去水分和些许低沸点杂质。随即升温至320 ℃保持一段时间,得到的褐色溶液即为前驱体Se-OAm。第一步恒温反应的同时,拿取另一个四口瓶,称量0.5 mmol CuCl、8 mL十八烯(ODE)与2 mL油胺于其中,同样在氮气环境下保持10 min,然后升温至200 ℃时立即注入上一步制备的Se-OAm溶液,再继续升温至220 ℃反应一段时间。得到的黑棕色溶液用乙醇、环己烷、乙醇交替洗涤三次即得到Cu2-xSe纳米粒子,其中每次洗涤溶剂的用量与反应溶液等体积,约为10 mL。接着将合成的Cu2-xSe纳米粒子进行氨基修饰,提高其亲水性以便后面的化合物负载和测试应用。将制备的纳米粒子与10 mg EDS和20 mg NHS于甲醇溶剂中混合,在黑暗环境中搅拌1.5 h。然后将40 mg的NH2-PEG(2000)-NH2加入上述溶液中,继续反应12 h后将所得溶液用甲醇和去离子水洗涤离心。随后,将0.2 g AIPH与氨基化的产物在70 ℃水浴下保持4 h。最后,将反应物用乙醇洗涤几次以除去过量的AIPH,收集沉淀物即可[14]。
1.3 性质表征
使用Rigaku D/max-TTR-Ⅲ衍射仪(Cu-Kα辐射λ=0.15405 nm)进行物相分析,扫描范围2θ=10°-90°,扫描速度为10°/min;使用FEI Tecnai G2S-Twin透射电子显微镜进行形貌观察(样品先分散在环己烷或者乙醇溶剂中,然后滴在碳支持膜上待溶剂挥发后进行观察);在Leica SP8设备上进行共聚焦激光扫描显微观察(CLSM);使用表面分析系统(Thermofisher Escalab Xi+)进行X光电子能谱(XPS)测试,测试时使用来自单色X射线源的AlKα辐射(hν=1486.6 eV)和500μm的光斑大小。以上表征均在室温下完成。
2 结果与讨论
2.1 形貌、物相和元素分析
图1(a)是第一步高温热解法合成的产物的XRD衍射图谱,可以看到,产物的XRD图谱展示出了主要特征峰的位置和相对强度,且与Cu2-xSe的标准图谱(JCPDS No.06-0680)匹配得很好,这证明了结晶性良好的Cu2-xSe晶体的成功合成。
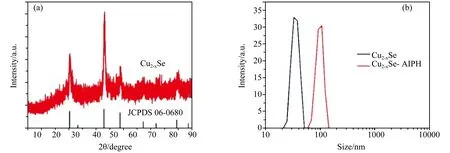
图1 (a) Cu2-xSe纳米粒子的XRD衍射图;(b) Cu2-xSe、Cu2-xSe-AIPH纳米粒子的动力学光散射粒径分布图
图2展示了Cu2-xSe与Cu2-xSe-AIPH纳米粒子的形貌。从图2(a)中可以清楚地看到,高温热解制备的Cu2-xSe纳米粒子的粒径分布为20-40 nm,形貌大多为四方形或球形,轮廓清晰可见。而经过转水和负载AIPH之后,从图2(b)可以看到,粒子的粒径增大到80 nm左右,且形貌转变为单一的球形。经过分析可知,纳米粒子前后粒径的增加可能是由于油性的Cu2-xSe纳米粒子在后续水溶液反应过程中发生了一定程度的聚沉。图3的Cu、Se、C、N、O元素的映射图也进一步验证了产物的成功合成。图1(b)是Cu2-xSe和Cu2-xSe-AIPH的动力学光散射粒径分布图,从图中可以看到粒子的粒径与之前透射图中的数值基本一致。

图2 (a) Cu2-xSe纳米粒子的TEM;(b) Cu2-xSe-AIPH纳米粒子的TEM

图4 (a)Cu2-xSe-AIPH纳米粒子中Cu 2p;(b)Se 3d的XPS谱图

图5 反应过程中每一步产物的(a)Zeta电位变化图;(b)AIPH的标准吸收曲线
图4是Cu2-xSe-AIPH纳米粒子中Cu、Se元素的XPS分谱谱图。特定地,图4(a)中Cu 2p特征峰的结合能为952.2、932.4 eV,证明了材料中一价铜的存在;图4(b)中Se 3d特征峰的结合能为54.7 eV,证明了材料中硒元素的价态是负二价。反应过程中Zeta电位的变化也佐证了每一步反应的进行。图5(a)是每一步反应产物水溶液(Cu2-xSe、NH2-Cu2-xSe、Cu2-xSe-AIPH)的Zeta电位变化图。可以看到,初始Cu2-xSe粒子溶液的电势为-10.35 mV,引入氨基后材料的电势有了明显的增大(-1.3 mV),最后担载完AIPH材料的Cu2-xSe-AIPH的电势进一步增大至16 mV。而Zeta电位的数值在某种程度上可以反映体系的稳定性,Zeta电位值(正或负)越低,吸引力超过了排斥力,体系中纳米粒子越倾向于凝聚。因此结合Zeta电位数值的变化可以从一定程度上解释透射图中粒子粒径与形貌的变化。刚开始Cu2-xSe粒子溶液的电势为-10.35 mV,粒子开始有聚沉倾向,但还较为稳定;在水溶液中修饰氨基后材料的电势变为-1.3 mV,Zeta电位负值变低了,体系开始变得不稳定,粒子会发生一定程度的聚沉;最终Cu2-xSe-AIPH材料的Zeta电位变为16 mV,Zeta电位正值较高,体系又逐渐趋于稳定。四方形或球形的Cu2-xSe粒子在溶液中发生聚沉后,导致最终材料的粒径增大,形貌转变为单一的球形。

图6 Cu2-xSe、Cu2-xSe-AIPH和AIPH的紫外-可见吸收曲线(a);45 ℃加热时AIPH与ABTS的反应曲线(b)
图5(b)是担载的化合物AIPH的标准曲线,由图可以得到AIPH的浓度(X)与其紫外-可见吸光度(Y)的线性关系为:Y=0.01207X-0.05899。图6(a)是Cu2-xSe材料担载AIPH前后的紫外-可见吸收曲线,可以看到,相比于Cu2-xSe纳米粒子的吸收曲线,Cu2-xSe-AIPH的吸收曲线在360 nm处出现了AIPH的特征吸收峰,证明了AIPH的成功担载。结合由AIPH标准曲线得到的线性关系,可以计算出AIPH的担载量为8.1%。为了验证AIPH自由基的生成,将1 mg/mL 2,2′-偶氮二(3-乙基苯并噻唑啉-6-磺酸)(ABTS)和相同浓度的Cu2-xSe-AIPH在45 ℃的水浴条件下反应了2 h,测定了反应溶液的紫外-可见吸收光谱。如图6(b)是反应产物ABTS的特征吸收曲线,证明在45 ℃的加热条件下AIPH分解生成了自由基,其进一步与ABTS反应从而生成了ABTS自由基。
2.2 光热转换性能
由于纳米粒子的光热效应对后续的肿瘤细胞的治疗起到关键作用,首先在水溶液中探究了合成材料的相关光热性质[15-17]。在近红外光(808 nm)照射下,使用红外热成像仪记录的Cu2-xSe、Cu2-xSe-AIPH溶液和溶剂水的温度变化曲线展示在图7(a)中。可以明显地看出,溶剂水的温度基本在室温上下浮动,而Cu2-xSe、Cu2-xSe-AIPH材料在808 nm激光的照射下溶液温度有了明显的升高,这初步证明了材料的光热转换能力。而且在较短的5 min时间内,材料的温度均可以达到48 ℃或以上,满足了体内外癌细胞治疗的温度要求。后续氨基的连接和AIPH的负载可能会在一定程度上阻挡光热剂Cu2-xSe对近红外光的吸收,但令人高兴的是,相比于光热剂Cu2-xSe,Cu2-xSe-AIPH纳米粒子每隔50 s的温度上升速度以及最终的稳定温度值也只有轻微程度的下降,并不影响材料的性能及应用[18]。
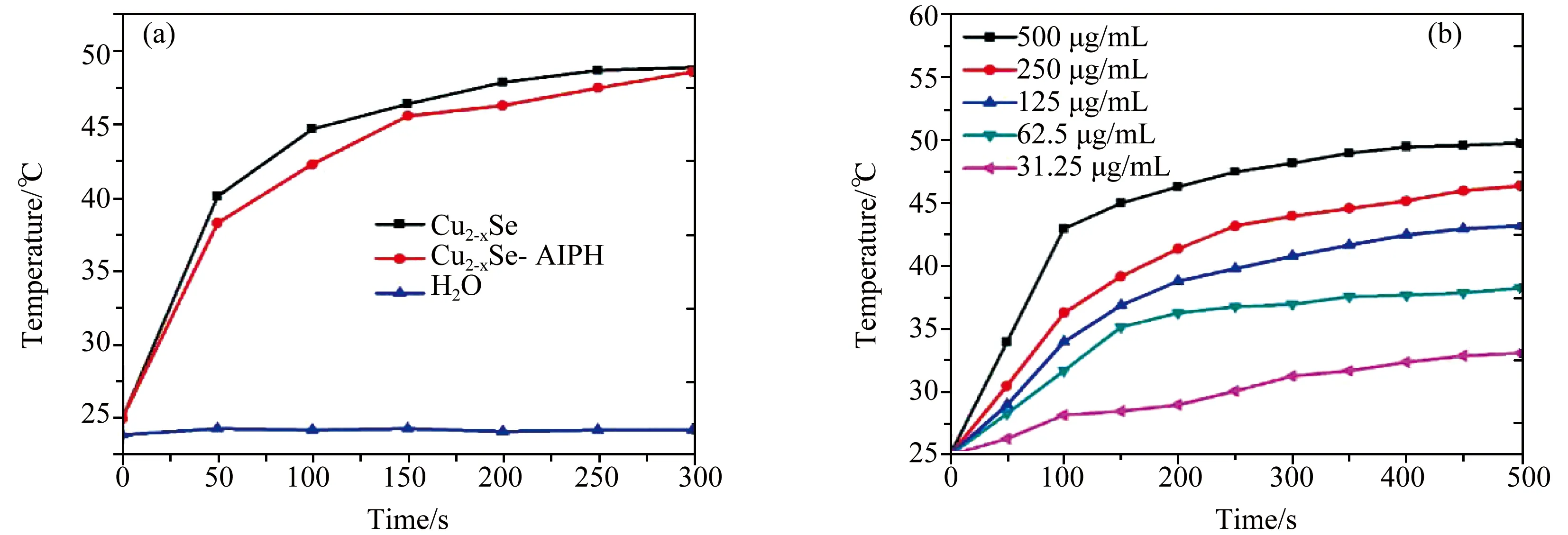
图7 (a) 808 nm激光照射时Cu2-xSe、Cu2-xSe-AIPH溶液和水的升温曲线;(b) 不同浓度的Cu2-xSe-AIPH溶液的温度随808 nm辐射时间的变化曲线。所有激光功率均为1 W/cm2
接着进一步探究了不同浓度(31.25、62.5、125、250、500μg/mL)的Cu2-xSe-AIPH溶液在500 s的辐射时间内的温度变化。由图7(b)可知,每组溶液的温度都随着红外光照射时间的延长而有规律地升高,并且溶液的浓度越大,升温的速度越快。当材料浓度为31.25 μg/mL时,升温速度最小,最终的稳定温度只有33 ℃左右,不及人体正常体温;而当材料浓度为500μg/mL时,升温速度最大,最终的稳定温度可达48 ℃左右,足够诱导癌细胞凋零死亡[19,20]。

图8 Cu2-xSe-AIPH材料(500 μg/mL) 的红外热成像图
为了更加直观地观察Cu2-xSe-AIPH材料的光热效应,我们使用红外热成像仪记录了500μg/mL的材料在808 nm激光照射5 min的时间内每一分钟的红外热成像图片。由图8可知,随着时间的延长,材料热成像图片的颜色逐渐由浅黄转变为深红直至白热化的颜色状态,由此可以确定材料在吸收了近红外光之后能产生大量的热量致使溶液温度有显著的提高。与标准温度条对比之后可以大致判断出材料最终的光热温度可达48 ℃左右。由以上测试可知,Cu2-xSe-AIPH纳米材料可以有效地将近红外光转换为热能,因而具有光热治疗的潜力。
2.3 体外抗癌性能研究
在进行生物实验之前,必须要对材料的生物相容性进行有效的评估,以免对生物体造成不必要的副作用[21]。将不同浓度(15.6、31.3、62.5、125、250、500μg/mL)的Cu2-xSe-AIPH材料与L929成纤维细胞共同培养24 h后,通过MTT分析评估了细胞的生物相容性。如图9(a)是与不同浓度的Cu2-xSe-AIPH纳米材料培养后细胞的状态,可以看到,即使材料浓度高达500μg/mL时,细胞的存活率仍然高达85%,这初步证明了Cu2-xSe-AIPH纳米材料有着良好的生物相容性。
紧接着,用类似的MTT法分析了纳米粒子对HeLa细胞的细胞毒性,图9(b)是不同条件下培养相同时间后的HeLa细胞的存活率柱状图。如图所示,将细胞分成了四组,分别是:AIPH、NIR、Cu2-xSe+NIR、Cu2-xSe-AIPH+NIR。由图可知,所有AIPH、NIR组的细胞的存活率均可达到95%以上,证明单独的AIPH培养或者红外光照射对细胞基本没有影响。Cu2-xSe+NIR组的细胞存活率降至50%左右(浓度为500μg/mL时),这归因于Cu2-xSe纳米粒子在近红外光作用下良好的光热性能;而Cu2-xSe-AIPH+NIR组的细胞存活率可降至20%(浓度为500μg/mL时)。由分析可知,这是由于相对于Cu2-xSe+NIR而言,Cu2-xSe-AIPH材料中的AIPH在Cu2-xSe的光热作用下还可以分解成自由基,二者的协同作用进一步增强了体系杀死癌细胞的能力[22,23]。

图9 (a) 不同浓度的Cu2-xSe-AIPH纳米材料的生物相容性;(b) 不同浓度的Cu2-xSe和Cu2-xSe-AIPH纳米粒子对HeLa细胞的细胞毒性
为了更直观地说明以上细胞毒性的结果,使用碘化丙啶(PI)进行了染色实验(该染色法只能用红色标记死细胞)[24,25]。如图10是不同培育条件下HeLa细胞的CLSM图像,同细胞毒性实验进行类似的培养后,染色实验也得到了相似的结果,即:AIPH、NIR分组中,死亡的红色细胞数最少;Cu2-xSe-AIPH+NIR死亡的红色细胞数最多即治疗效果最好,Cu2-xSe+NIR次之。综上所述,以上细胞实验可以初步证明Cu2-xSe-AIPH材料有着良好的生物相容性和抗癌性能[26]。

图10 不同条件培育下的HeLa细胞的CLSM图像(所有图像的比例尺均为100 μm)
3 结论
总而言之,一系列实验探究证明了构建的Cu2-xSe-AIPH体系光热转换温度高达48 ℃,可用于光热治疗;体外细胞实验证明材料的生物相容性较好,材料浓度为500μg/mL时,细胞的存活率高达85%;材料浓度为500μg/mL时,Cu2-xSe-AIPH+NIR组癌细胞存活率可降至20%。以上这些工作表明Cu2-xSe-AIPH材料具有肿瘤治疗的潜力,可进一步发展生物应用。
