一株油脂降解菌的筛选鉴定及降解效果分析
2021-01-27王森张卡王泳浩许雷
王森,张卡,王泳浩,许雷
中国农业科学院研究生院, 北京 100081
在自然环境和日常生活中,各行各业的生产生活活动都会对河流湖泊等水体造成油污染。比如工业含油废水和污水排放、屠宰场和榨油厂等产生的含油污水的排放,以及在食堂、酒店等日常生活场所中,食品加工食用时造成的水体污染。总而言之,人类的多数生产活动过程都可以成为环境水体油污染的来源。同时,据文献报道,我国城市生活垃圾的构成组分中,餐厨垃圾占到了约62%,而且这个比重仍然在以每年10%的幅度递增,每年新增的餐厨垃圾产生量据统计可以达到500万t[1]。随着生活水平和饮食结构的变化,在餐厨垃圾排放总量每年递增的同时,动植物油脂类物质的比例也逐渐上升。据文献报道,餐厨垃圾中粗脂肪的含量可以达29.07%以上。作为餐厨垃圾的重要成分,餐饮废弃油脂具有成分复杂、难于降解的特点,成为一种高度污染源。如果不能对餐饮废弃油脂进行正确的处理,会造成严重的环境污染和巨大的经济损失。
目前,油脂废水处理方式主要分为物理分离、化学去除和生物降解。其中物理分离方法包括重力分离、粗粒化分离、过滤分离和膜分离,分离过程中需要借助包括隔油池、去油罐、粗粒化罐、油水分离器、气体浮选器等一系列特殊设备,分离效率较低。化学去除法包括化学破乳和化学氧化,分离过程中需要消耗氯气、氧气、臭氧、双氧水、高锰酸钾以及Fenton 试剂等氧化剂,分离成本相对较高。生物降解的具体处理方法包括利用好氧活性污泥、接触氧化、以及厌氧氧化池塘等[2]。相对于其他方法,生物降解法具有高效、低成本、条件温和、无二次污染的特点,同时还能实现对废弃油脂的能源利用,具有良好的研究潜能和应用前景[1]。
到目前为止,国内外已发现了许多具有油脂降解能力的菌株,其合成的降解酶一般为诱导酶类,降解基因由质粒控制,在碳、氮源受限的情况下才会表达合成[3]。因此,如何筛选培养高效油脂降解菌株并获得关键酶基因就成为解决油脂污染的关键。早期研究分别从餐饮下水道和植物油精炼工厂污水排放点的污染土中驯化分离得到了具有油脂降解能力的细菌、霉菌和酵母菌,包含多萨假单胞菌、假产碱假单胞菌、洋葱伯克霍尔德菌、栗褐芽胞杆等[4-6]。但已有的研究中,以橄榄油为唯一碳源的菌株的筛选和研究工作开展得较少。因此,本实验的主要内容和目的是分离筛选得到一株具有橄榄油降解能力的菌株,并通过对菌株降解特性的测定了解和验证菌株的降解能力,以期为解决水体环境中的油脂污染提供理论基础和技术支持。
1 材料与方法
1.1 材料
1.1.1实验试剂 正己烷(色谱纯)、橄榄油(分析纯)、乙腈(色谱纯)、异丙醇(色谱纯)均购自Sigma公司。
用于筛选分离降解菌株的土样采自山西省左权县某屠宰场的污水排放口附近的地表污染土,采样时采用对角线采样法。
1.1.2培养基 驯化培养基:(NH4)2SO41 g·L-1,K2HPO40.5 g·L-1,NaH2PO40.5 g·L-1,MgSO40.25 g·L-1,FeSO4·7H2O 0.001 g·L-1,CaCl2,0.01 g·L-1,121 ℃高压灭菌 20 min。
筛选培养基:(NH4)2SO41 g·L-1,K2HPO40.5 g·L-1,NaH2PO40.5 g·L-1,MgSO40.25 g·L-1,FeSO4·7H2O 0.001 g·L-1,CaCl20.01 g·L-1,琼脂15 g·L-1,121 ℃高压灭菌20 min。冷却前加入灭菌的橄榄油10 mL·L-1,配置好的聚乙二醇溶液终浓度1 g·L-1作为乳化剂,混合均匀后制成固体平板备用。
LB 培养基配方:蛋白胨10 g·L-1,酵母粉 5 g·L-1,NaCl 10 g·L-1。制平板时(LB固体培养基)加入15 g·L-1琼脂。
1.2 方法
1.2.1油脂降解菌的分离纯化 梯度驯化法菌株筛选:称取约5 g污染土土样与100 mL驯化培养基混合均匀,配制于 250 mL锥形瓶中,30 ℃震荡培养7 d。第一次培养结束后,静置取上清约 5 mL加入到新的驯化培养基中,同时移液枪加入500 μL橄榄油[4], 30 ℃震荡培养7 d。使用含橄榄油的驯化培养基筛选菌株,并在驯化过程中每次增加橄榄油浓度,从500 μL·L-1橄榄油浓度最终提高到100 mL·L-1。
菌株初筛:通过梯度驯化筛选得到的菌株,菌液经10×、100×、1 000×梯度稀释后分别涂布于筛选培养基平板,放置于30 ℃培养箱后定期观察,出现降解圈后在LB平板上划线分离纯化菌株。
菌株复筛:将初筛培养基平板上所有出现降解圈现象且彼此形态有明显差别的菌株挑出,用含有100 mL·L-1橄榄油的驯化培养基再次筛选培养。以未加入菌株的驯化培养基作为空白对照,通过橄榄油比色法,使用紫外分光光度仪测定获得的降解菌株24 h后的橄榄油降解率。挑选降解率较高的菌株在LB 平板上再次划线分离出单菌落,4 ℃保存待用。
1.2.2菌株的鉴定 通过电子显微镜观察菌株的形态特征并使用Biolog试剂盒测定菌株的生理生化指标。通过聚合酶链式反应扩增得到实验菌株16S rDNA后,进行测序分析,测序结果使用Blast在Genbank中比对分析,最终通过使用MEGA 6.0软件构建系统发育树,确定实验菌株所属的菌属。其中,PCR扩增用到的通用引物分别为:27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-TACCTTGTTACGACTT-3′。
1.2.3生长曲线的测定 将实验菌株分别接种于含有100 mL·L-1橄榄油的驯化培养基中,30 ℃环境中160 r·min-1的摇床上震荡培养,紫外可见分光光度计测定48 h内培养基中菌液浓度,绘制生长曲线。
1.2.4培养基中橄榄油浓度测定 将配置好的驯化培养基分装至若干个50 mL锥形瓶中,每瓶加入培养基20 mL,橄榄油100 mL·L-1,并以1%的浓度接入实验菌株后,分为14组。每组添加未接菌的含橄榄油的驯化培养基作为空白对照,将菌液置于30 ℃环境中震荡培养。间隔6 h分别对橄榄油浓度进行检测,计算菌株降解率。液相色谱检测条件为:色谱柱:Zorbax Eclipse Plus C18(4.6 mm×150 mm×5 μm),流动相∶乙腈∶异丙醇(体积比)= 1∶1,上样量:5 μL,流速 0.8 mL·min-1,柱温30 ℃,极管阵列复合波长检测器进行检测,检测波长为290 nm[7-8]。
1.2.5外界环境对油脂降解的影响 当实验菌株生长至对数增长期时(OD600≈1.5)离心收集菌体,按5% 的接种量接种于橄榄油浓度为100 mL·L-1的驯化培养基中,分别测定不同生长环境中菌株的降解率。其中,pH的测定范围为5.5~10,温度的测定范围为10~50 ℃,培养基最高盐浓度为12%,并通过测定油脂的残余浓度计算菌株的降解率。
1.2.6菌株对不同底物的降解能力 配置好的驯化培养基分装至若干个50 mL锥形瓶中,每瓶加入培养基20 mL,并以1%的浓度接入实验菌株后,分为4组,分别用于测定实验菌株对大豆油、花生油、芝麻油和猪油的降解效率。每组均以80 mL·L-1的终浓度加入油脂后,加入1 g·L-1的聚乙二烯作为乳化剂, 在菌株最适条件下(35 ℃,pH 8)震荡培养72 h。使用等体积正己烷抽提油脂,液相色谱测定剩余量并计算各组降解率。
2 结果与分析
2.1 实验菌株的鉴定
2.1.1菌落形态和生理生化特征 由于筛选培养基由橄榄油通过聚乙二醇乳化后制备而成,倒板后呈白色雾状,故降解菌在培养基长出后周围出现透明状降解圈,菌落生长形态特征为圆形、乳白色、表面平滑,并可判定为革兰氏阴性细菌。通过Biolog试剂盒对实验菌株的生理生化特征进行鉴定(表1),最终显示实验菌株属于无色杆菌属(Achromobacter)。

表1 实验菌株的生理生化特性Table 1 Physiological and biochemical characteristics of experimental strains
2.1.2菌株16S rDNA 序列测定 实验菌株的16S rDNA 基因序列测序结果在NCBI上比对分析后,采用邻接法构建系统发育树(图1),实验菌株与Achromobacterpulmonis聚为一支,Biolog试验分析和16S rDNA基因测序比对结果基本一致,可以证实实验菌株为无色杆菌(Achromobactersp.)。
2.2 菌株降解率测定
2.2.1实验菌的生长曲线 如图2所示,实验菌株在含有橄榄油的无机盐培养基中,约18 h进入对数生长期直至30 h进入平台期,最大OD600值约为2.1左右。由此可以看出,由于油脂类物质的分子量较大,分解转化速率较低,作为唯一碳源时减缓菌株前期增殖。当有一定量油脂降解产物生成后,菌株增殖速率迅速增长,因此当考虑优化培养基时,可以添加少量其他碳源。
2.2.2菌株降解性能测定 通过建立好的液相色谱检测方法测定实验菌株对橄榄油的降解能力,计算与对照相比橄榄油的浓度变化来表示降解率,进而绘制降解曲线。从图3中可以看出,30 h前降解率增长较为缓慢,30 h左右之后先快速升高,之后趋于平缓,拐点出现在54 h左右,最大降解率约89%。

图1 基于16S rRNA基因序列同源性的系统发育树Fig.1 Phylogenetic tree based on 16S rRNA gene sequences and related stains
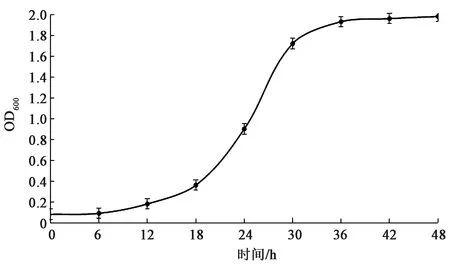
图2 菌株以橄榄油为单一碳源的生长曲线Fig.2 Growth curve with olive oil as only carbon source
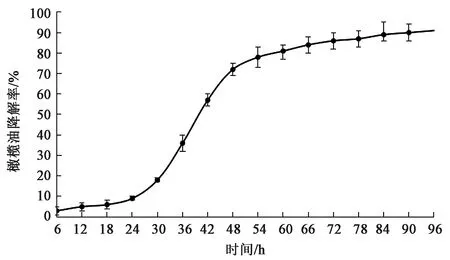
图3 菌株发酵过程中橄榄油降解率Fig.3 Degradation rate of condensed tannin during fermentation
2.3 环境因素对降解能力的影响
2.3.1pH对菌株降解的影响 前期实验配置的含橄榄油培养基自然pH通常为7.5左右,从图4可以看出,在pH 7.5左右,橄榄油降解率可以达到90%以上,在pH 7~9范围内,菌株对油脂的降解率可以保持较高值,可达到75%以上。当pH低于6.5时,降解率明显下降,可能是由于油脂降解产生脂肪酸等降解产物,若生长环境偏酸性,不利于菌株对脂肪酸的吸收降解。从总体趋势上看,明显可以看出降解菌株对碱性环境的耐受性高于偏酸性环境,这可能也与油脂降解产生的中间代谢产物有关。
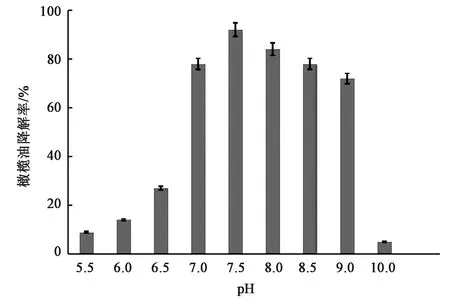
图4 不同pH条件下菌株对橄榄油的降解率Fig.4 Degradation rate of olive oil by strains under different pH conditions
2.3.2温度对菌株降解的影响 从图5中可以看出,培养温度在35 ℃时,降解率达到92%,温度过高或过低均不利于菌株生长,实验证明,当温度低于15 ℃时,环境因素阻碍菌株正常生长,当温度高于45 ℃时,菌株也出现生长缓慢的现象。在菌株正常生长的温度范围内,油脂作为单一碳源的培养基中,降解橄榄油的最适温度为35 ℃左右。该温度和菌种来源地环境温度以及筛选培养温度(30 ℃)相比较高,可能是由于相对高温有利于油脂的相变和乳化,从而促进菌株对橄榄油的吸收降解。
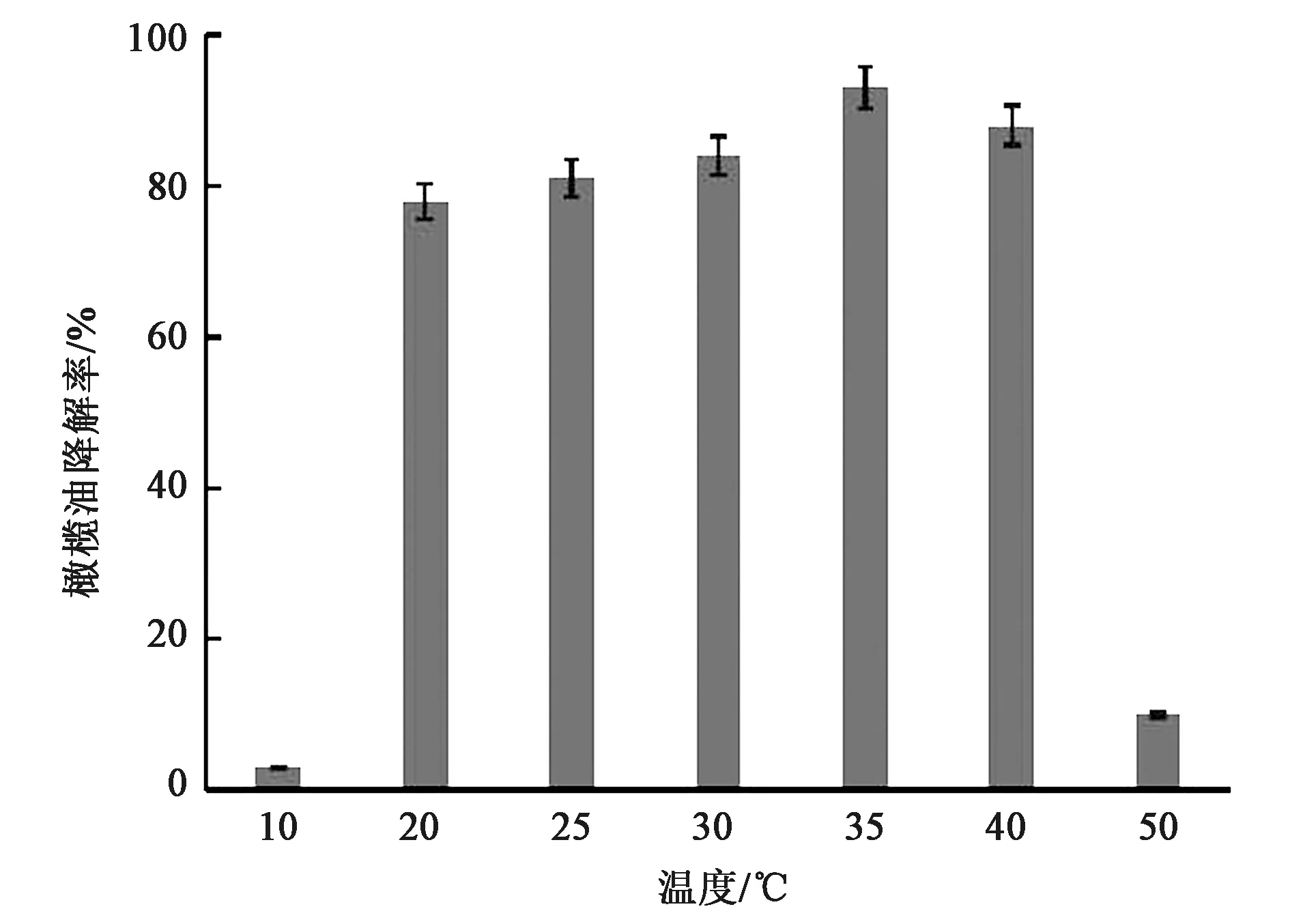
图5 不同温度下菌株对橄榄油的降解率Fig.5 Degradation rate of olive oil by strains at different temperatures
2.3.3盐浓度对菌株降解的影响 从图6可以看出,随着盐浓度升高,菌株对橄榄油的降解率逐渐下降,盐浓度在6%以下时,菌株对橄榄油的降解率可以保持在70%以上。当盐浓度高于6%菌株降解率明显下降,可能是高盐浓度环境中,菌株无法正常生长,同时,高渗透压又影响菌株对油脂类物质的吸收,从而急剧降低降解率。
2.4 菌株对不同底物的降解能力
图7是实验菌株对大豆油、花生油、芝麻油、猪油等不同食用油的降解情况,从图7中可以看出菌株对不同种类油脂的降解效率略有不同,这可能是由于不同油脂的成分和结构特点决定的。其中,猪油作为一种动物油脂,甘油三酯和游离脂肪酸中饱和脂肪酸含量较高,达到43%左右,在常温下一般以固态存在,对菌株的降解具有显著影响。花生油成分相对较为复杂,有报道表明其中含有40种有机酸、6种酮类、7种醇类及脂类,另外氨基酸及其衍生物9种,糖类及其衍生物5种,以及其他化合物总计90余种,由于复杂的化学组成,影响了菌株的降解效率,使得最终降解率有所下降,但可能由于成分中的小分子化合物含量相对较高,降解初期菌株生长速率和降解率相对其他种类油脂较高。大豆油与芝麻油的成分相似,各组分的含量有细微差别,其中芝麻油中不饱和脂肪酸含量相对较高,使得降解率有所差异,总体上看,实验菌株对不同种类油脂均保有较高的降解效率。
3 讨论
动植物油脂作为一种生物体的储能物质,可以在体内彻底氧化。但如果要作为机体的唯一碳源,需要其能够转化为糖类和氨基酸等其他必需生物大分子。本实验首先采集了屠宰场中长期受到动物油脂污染的土壤作为供菌源,随后通过富集培养、筛选分离得到了能够将橄榄油作为唯一碳源的实验菌株,在提供无机氮作为氮源的培养基中生长。随后在此环境中测定了实验菌株的生长曲线,通过对实验菌株的生理生化鉴定结果和16S RNA 序列比对结果分析,确定该菌株属于无色杆菌属(Achromobactersp.)。
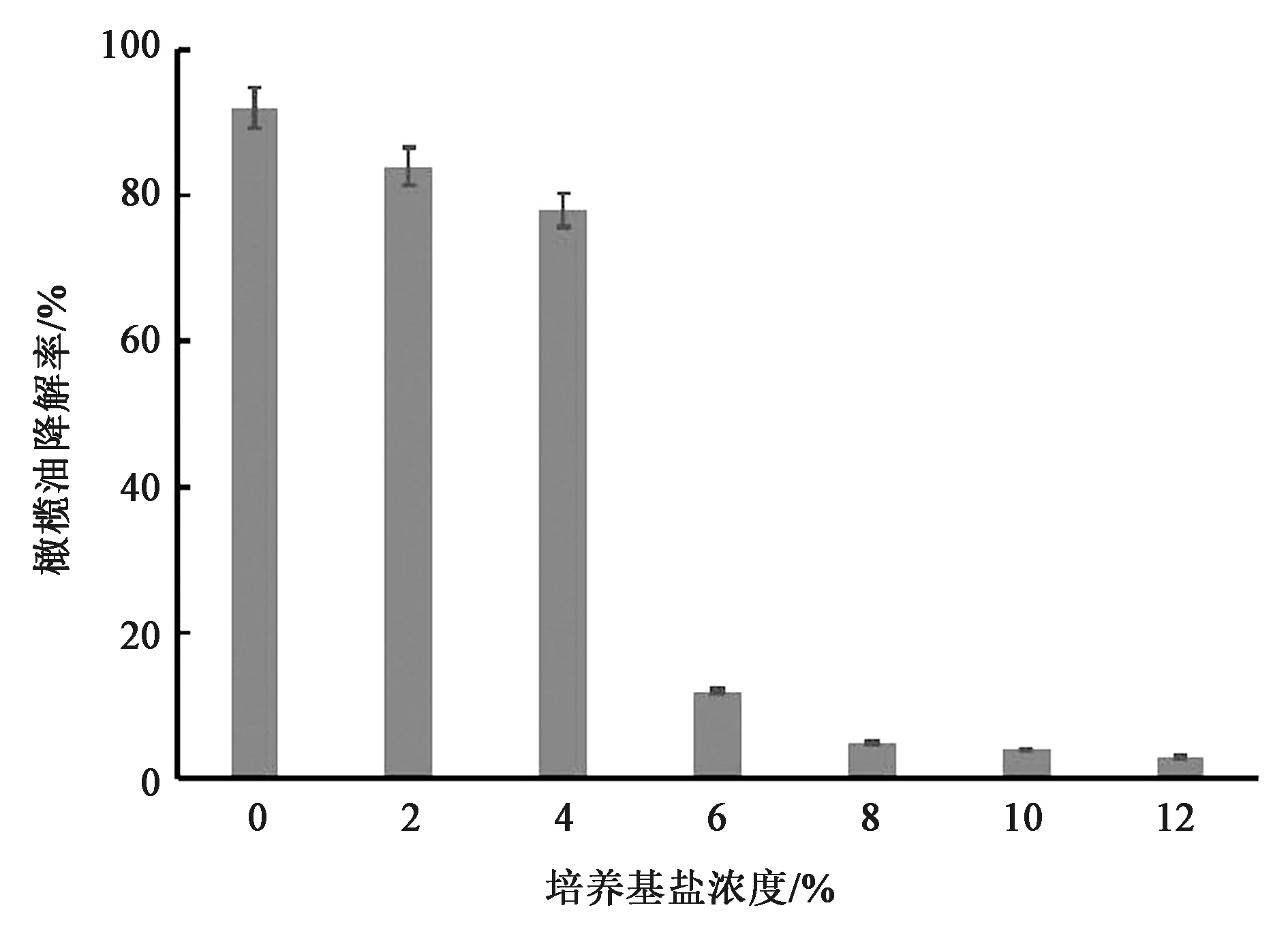
图6 不同培养基盐浓度条件下菌株对橄榄油降解率Fig.6 Degradation rate of olive oil by strains under different medium salt concentration
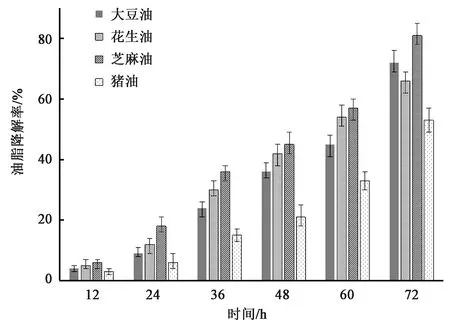
图7 实验菌株对不同种类油脂的降解情况Fig.7 Degradation of different kinds of oil by experimental strains
本实验对筛选分离得到的实验菌株的降解特性进行测定。实验结果表明,实验菌株降解油脂的最适pH条件为7.5、pH 7~9范围内菌株均能正常生长,并保持较高的降解率。实验菌株最适温度条件为35 ℃。在最适条件下,实验菌株接种后4~5 d降解率可以达到90%,同时,该菌株能够在盐浓度低于40 g·L-1环境中保持较高的降解率,实验表明,由于不同种油脂的成分和化学结构的差异,实验菌株的降解效率各有不同,从总体上看,实验菌株对不同种类油脂均保有较高的降解效率,表明实验菌株具有良好的环境适应能力和环境修复潜力。
相较于霉菌和酵母菌,细菌更易于实验操作和研究[9-10]。获得高效的有机物降解菌,是生物修复首先要解决的关键问题,对于菌株降解油脂的通路和关键酶已有研究报道,关键酶是乙醛酸循环中的异柠檬酸裂解酶和苹果酸合酶,只有将脂肪酸分解产物乙酰辅酶A通过该通路转化为琥珀酸才能合成单糖直接供能,从而将油脂作为唯一碳源进行生长[11]。因此,通过同源克隆获得关键酶异柠檬酸裂解酶和苹果酸合酶基因将是构建油脂降解工程菌株的关键[5]。这株实验菌不仅在解决水体环境污染和废弃物能源再利用方面具有重要经济价值,而且为构建多功能降解菌株提供了技术支持。
