中性脂含量高的微拟球藻藻株的快速筛选❋
2023-11-25陈小凡王路路肖腾飞朱葆华潘克厚
陈小凡, 王路路, 肖腾飞, 朱葆华, 李 赟, 潘克厚,2❋❋
(1. 海水养殖教育部重点实验室(中国海洋大学), 山东 青岛 266003; 2. 崂山实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237)
海洋微拟球藻(Nannochloropsisoceanica)属于真眼点藻纲(Eustigmatophyceae)微拟球藻藻属(Nannochloropsis)[1],是一种海洋单细胞微藻,具有生长速度快,油脂含量高等优点[2]。微藻体内油脂主要由中性脂与极性脂组成,中性脂是微藻碳和能量的储存形式,被认为是生物柴油的理想来源[3]。微拟球藻脂质含量占干质量的39.4%~44.9%[4]是微藻生物柴油生产的模式藻株。
在对已有的微拟球藻藻株进行比较基础上,开展诱变选育是获得高油脂产率藻株的重要途径。目前优良微藻藻株的育种方法包括诱变育种和转基因育种。微藻的诱变育种包括物理法(如紫外线、射线、等离子体和重离子束等)和化学法(如甲烷磺酸乙酯(EMS)亚硝基胍(NTG)等)[5-6]。转基因技术则是将油脂合成的功能基因转入微藻体内以定向改变油脂的积累能力。诱变是不定向的,转基因也需要考虑转基因藻株的最终生物学功能,故在诱变和转基因后,都需要对获得的藻株进行快速筛选。尼罗红染色荧光强度与中性脂质密切相关[7],利用尼罗红染色结合流式细胞仪分析是目前快速筛选高油脂含量微藻的有效方法,这一方法已广泛用于硅藻、金藻、褐藻和绿藻等微藻油脂含量的分析[8]。
微藻的油脂产率由微藻的生长速率和微藻的中性脂含量共同决定,因此筛选优良的藻株时需要同时考虑这两个因素。利用转基因方法、化学和物理诱变方法,本实验室获得了75株微拟球藻变异藻株。为评价这些变异藻株的油脂生产潜力,使用尼罗红染色结合流式细胞仪分析藻株的中性脂含量,同时考虑藻株的生物量,综合比较了藻株的油脂生产性能,以期为这些藻株的生产应用提供依据。
1 材料与方法
1.1 实验材料及培养方法
本实验所用微拟球藻诱变藻株均来自野生藻株085,其中基因过表达藻株12株[9],分别为Δ6去饱和酶基因(NoD6)3株、Δ12去饱和酶基因(NoD12)3株,以及2条来自三角褐指藻1条来自拟南芥的二酰甘油酰基转移酶DGAT基因,命名为PtDGAT1(2株)、PtDGAT2(3株)和AtDGAT(1株)。28株物理诱变藻株均为常压室温等离子(ARTP)诱变[10]。33株化学诱变藻株分别为博来霉素诱变5株[11],甲基磺酸乙酯(EMS)诱变7株[12],亚硝基胍(NTG)诱变18株[13-14]。另外还有Sandoz9785抗性筛选藻株3株[15]和烟气驯化实验1株。所有藻种均保存在中国海洋大学应用微藻生物学实验室微藻种质库,保存条件为 (17±1) ℃,光照强度35~45 μmol·m-2·s-1,光暗周期10 h∶14 h,每6个月转接1次。
为活化保存藻株用于实验,对藻种进行预培养,培养基为f/2海水培养基,盐度30±2,光照强度为50~60 μmol·m-2·s-1,温度为(25±3) ℃,每天定时摇瓶3次,培养至指数生长期用于后续实验。
1.2 藻株中性脂含量的检测
尼罗红是一种脂溶性荧光染料,其在特定波长下荧光强度与油脂含量呈显著的线性关系[16],可用于表征微藻的中性脂含量,其相关系数达0.998[17]。
本实验所用的流式细胞仪型号为Beckman Coulter FC500,氩离子激光器激发波长为488 nm,尼罗红发射波长为617 nm。分析软件为CXP Analysis,选择使用FL3通道。因微藻体内自有色素干扰实验结果,故在测定时先测定无染色藻株的自发荧光作为背底,后测量染色细胞荧光数值,去背底得到最终结果。每次测量时3个平行样品均取1万个细胞,共同计算表征样品荧光强度。
具体操作为取培养至平台期的微拟球藻藻液2 mL于离心管中,6 000 r/min离心5 min,去上清,加入过滤后的海水进行吹打清洗后再次离心,重复2次,弃上清,保留藻细胞。加入用海水稀释过的体积分数为25%的DMSO溶液0.5 mL,充分震荡后室温避光静置10 min[8]。为确定尼罗红浓度和染色时间,保持其他条件不变,设定不同浓度的尼罗红染料对微拟球藻进行染色处理:0,0.1, 0.3,0.5,1和5 mg/mL。在不同染色浓度的基础上设定了两组染色时间为10与30 min。每组实验重复3次,取平均值用于分析。
1.3 藻株培养过程中中性脂含量分析
为确定微藻中性脂含量测定的时间,选取野生藻株与ARTP诱变藻株194进行比较实验。
两株藻接种后藻液(75 mL)光密度值(OD)均为0.1,在100 mL的锥形瓶中进行培养,培养条件同预培养,每株藻均做3个重复。培养过程中,每天定时取2 mL藻液通过分光光度计(Hitachi U-3310)测定其在680 nm波长下的OD值[18],以1 mL蒸馏水进行调零。培养周期为12 d。
分别取培养第1,3,5,7,9,11,13天的藻液2 mL,如1.2所述步骤进行洗涤染色,采用优化后的染色条件,尼罗红浓度为1 mg/mL,染色时间为10 min,利用流式细胞仪测定中性脂的相对含量。
1.4 藻株生物量和中性脂产率的测定
取10 mL藻液于离心管中,用烘干至恒重的GF/C玻璃纤维素膜(直径47 mm,孔径0.45 μm)抽滤藻液,滤膜放入恒温箱中60 ℃烘干至恒重后,称量过滤后生物膜的质量,减去生物膜的质量,计算生物量。
以原始藻株作为标准,将变异藻株与原始藻株的生物量之比作为生物量提升的指标,同理将变异藻株与原始藻株的荧光强度之比作为中性脂提升的指标,二者乘积为变异藻株的相对中性脂产率,用于表征其产油能力的水平[19]。

1.5 数据处理
本文所涉及实验均设置3个平行,数据采用软件SPSS25.0进行单因素方差分析,事后分析为图基(HSD)检验,显著性水平P<0.05,采用Origin Pro 2018绘图。
2 结果分析
2.1 微拟球藻尼罗红染色方法优化
尼罗红染色后通过流式细胞仪进行荧光强度测定。结果显示(见图1),微藻荧光强度受染尼罗红染色时间和浓度共同影响,尼罗红浓度较染色时间对荧光强度影响更显著。染色10 min处理组中,荧光强度与染色细胞百分数均有所上升,染色细胞百分数1 mg/mL处理组与5 mg/mL处理组差别不显著。此外,染色30 min处理组中,当浓度为0.1~1 mg/mL时,随着尼罗红浓度的增加,荧光强度与染色细胞百分数均有所上升,但高浓度长时间处理会影响细胞活性,导致5 mg/mL处理组荧光强度与染色细胞数均下降。综合两方面的结果,浓度1 mg/mL的尼罗红染色10 min比较理想。
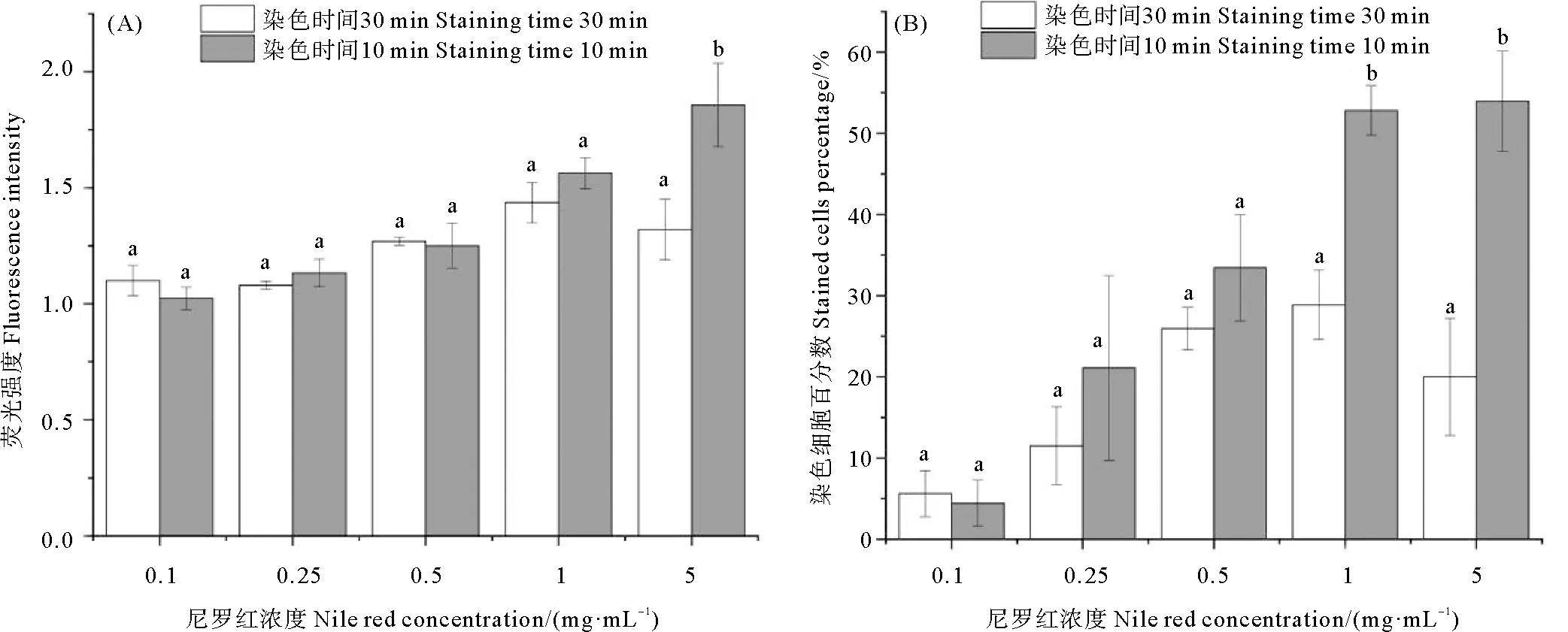
(a,b表示方差分析差异程度,同一图中有相同字母的组之间差异不显著(P>0. 05)。 a、b represents the analysis of variance difference. Values in the same picture with the same superscripts are not significantly different(P>0.05).)
2.2 藻株生长及中性脂含量测定时间的确定
用OD值表征微藻的生长情况,结果显示(见图2(A)),两株微拟球藻的生长周期无显著差异。在经过2 d的适应后,藻株进入指数生长期,藻细胞密度快速增长。在第6天进入平台期,生长放缓,生物量趋于稳定缓慢上升。随着微藻生长,藻细胞脂质含量经过一个先升高后降低并逐渐稳定的过程(见图2(B))。藻株085中性脂在第3天达到最高,第7天后趋于稳定。藻株194总体中性脂含量高于085,其脂质含量在第1天达到顶峰后产生波动,在第7天趋于稳定。由于第1天和第3天微藻处于指数生长期,生物量较低,第9天其生物量与油脂含量较高且处于稳定状态,同时考虑微藻生长与油脂积累,选择微藻培养至第9天为测量藻株油脂积累量的时间。
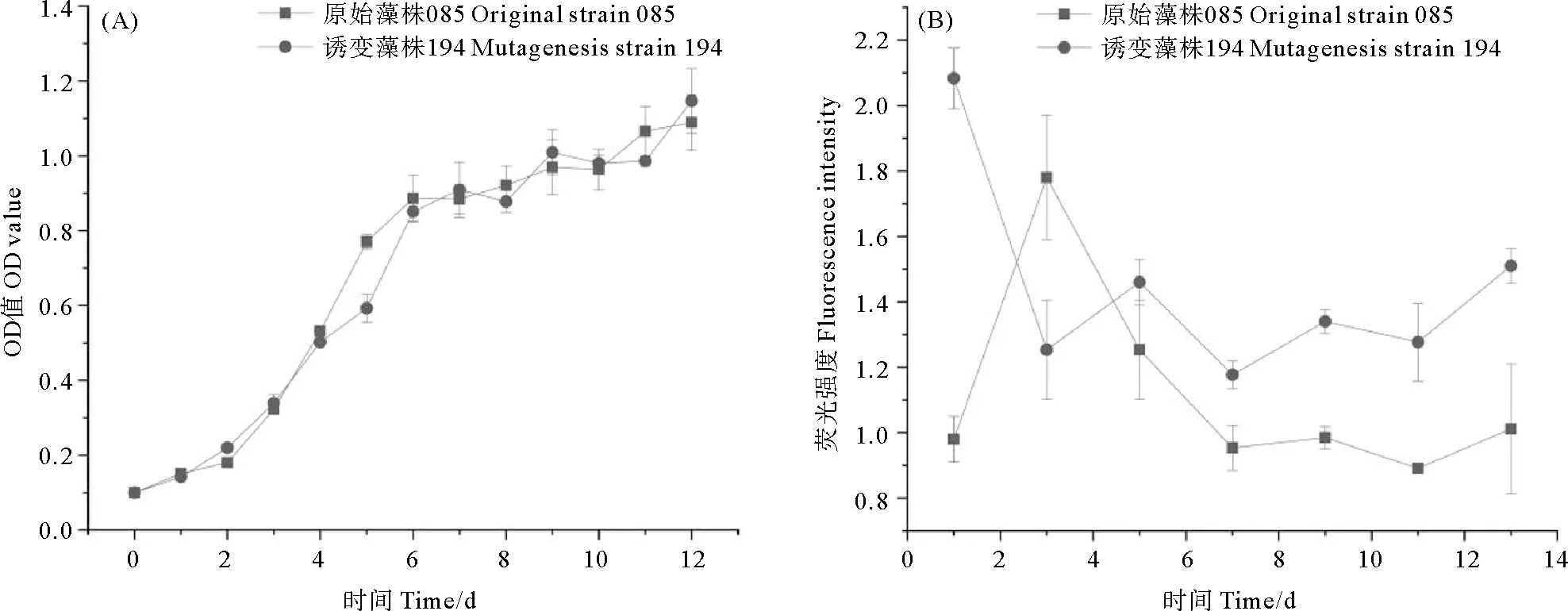
图2 原始藻株085与诱变藻株194培养过程中细胞密度(A)和荧光强度(B)的变化
2.3 微拟球藻藻株的筛选比较
2.3.1 变异微藻的油脂产率分析 以原始藻株085作为对照,分析实验藻株中性脂含量和生物量的增长情况,结果显示(见表1),除藻株104和198之外,其余实验藻株生物量均大于原始藻株,藻株183生物量提升幅度最大,为原始藻株的57.5%。除藻株229和191外,其余实验藻株中性脂含量均大于原始藻株,藻株183中性脂提升幅度最大,为原始藻株的154.9%。综合比较藻株中性脂的产率,结果显示,所有实验藻株的相对产率均大于原始藻株,其中藻株231相对产率提升幅度最大,为原始藻株的223.8%。
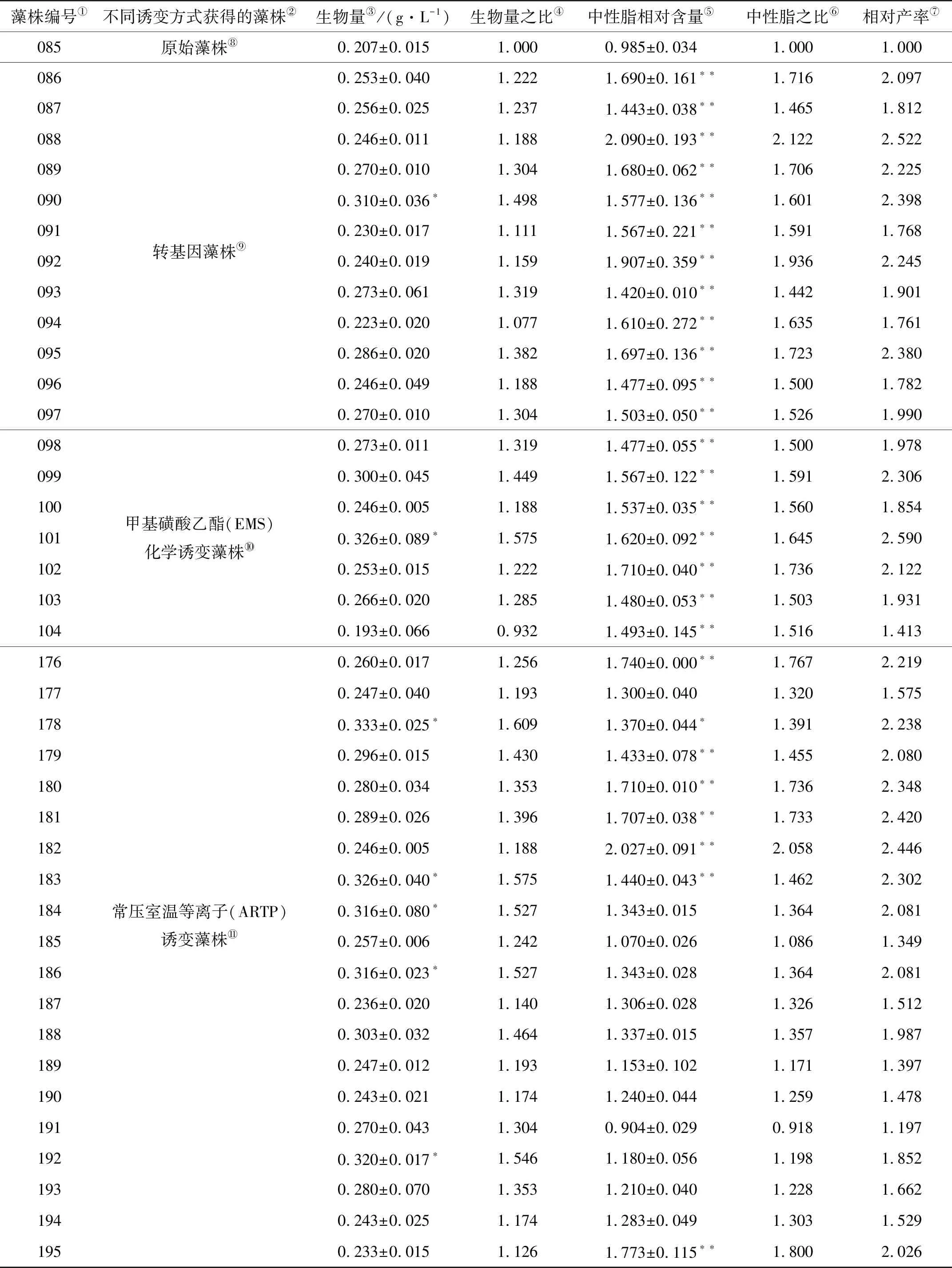
表1 75株微拟球藻生物量与中性脂相对含量
进一步分析发现,藻株192的生物量明显高于原始藻株(原始藻株的154.6%),但脂质含量未见显著提升(仅为原始藻株的119.80%),其油脂相对产率并不优异(仅为原始藻株的185.2%)。而藻株232脂质含量高于原始藻株(为原始藻株的146.50%),但生物量未见显著提升(为原始藻株117.4%),其相对产率也不突出(仅为原始藻株的172.0%)。这说明,微藻的脂质产率受到两方面的影响,一是生物量,二是油脂含量,在高油脂微藻藻株筛选过程中不仅要考虑藻株的脂质含量,也要考虑藻株的生物量生产能力。
2.3.2 不同育种技术提高油脂产率的效果分析 以油脂相对产率提升到210%做为优良藻株的筛选指标,转基因诱变藻株中,5株转基因藻株中性脂相对产率均高于210%,其中088号藻株相对产率最高,为252.2%。ARTP诱变藻株中,有6株相对产率高于210%,其中182号藻株相对产率最高,为244.6%。EMS诱变藻株中,有3株相对产率高于210%,其中101号藻株相对产率最高,为259.0%。博莱霉素诱变藻株,仅212号藻株相对产率高于210%,为247.8%。NTG诱变藻株中,有4株相对产率高于210%,231号藻株相对产率最高,为323.8%。另外,除草剂Sandoz9785筛选的3株藻株中,252号藻株相对产率最高,为196.8%,烟气驯化藻株相对产率较低,仅为126.5%。上述结果表明,不同育种技术用于微拟球藻高油脂产率的培育存在明显不同,其中231号、088号和101号藻株表现格外突出,其油脂相对产率均高于250%,有望应用于工业生产。
3 讨论
微藻中性脂传统的测定步骤包括溶剂萃取、薄层色谱(TLC)、气相色谱(GC)等,其操作繁琐,费时费力,难以实现对诱变藻株的快速筛选[17]。尼罗红(NR-9-二乙氨基-5-苯并[α]苯并恶嗪酮)是一种脂溶性荧光染料,Cooksey等在1987年发现,尼罗红可与细胞内的中性脂结合,产生黄金色荧光,荧光强度与细胞内结合中性脂的量密切相关,可作为微藻中性脂含量检测的方法[20]。2010年Doan等[21]将改良的尼罗红染色法运用到微拟球藻中性脂含量的分析之中并取得良好效果。2016年Alemán-Nava等[8]在前人的研究基础上制定了不同微藻尼罗红脂质测定的规范方法,该方法涉及脂质测定所必须遵循的五个步骤,本实验基于该方法开展了实验藻株中性脂含量的分析。
诱变和基因工程是促进微藻脂质合成的两种策略。基因工程可以按照设计者意愿直接改变油脂合成路径中的关键酶基因[22]。二酰甘油酰基转移酶(DGAT)作用于TAG生物合成路径中的最后一步,催化二酰甘油和游离酰基辅酶A缩合反应生成三酰甘油即TAG,此外Δ6去饱和酶与Δ12去饱和酶位于PUFA合成路径中,与油脂合成相关。结果显示,改变以上基因均有效地提高了微拟球藻的中性脂含量,因未改变生长过程相关基因,故其生物量并未出现显著变化。5株转基因藻株中性脂产率均高于210%,说明转入目标功能基因可大幅度提高微藻产油能力,但同时也可看到,本实验转基因藻株中性脂产率并不是最高的,说明进一步筛选油脂合成基因以及促进生长基因对于提高微拟球藻的油脂产率还是很有必要的。目前微拟球藻的全基因组测序工作已经全部完成[9],基因的注释工作还在继续,这为获得以上两方面优良基因提供了可能。
微藻常压室温等离子体诱变(ARTP)是一种基于射频和大气压离子体射流的物理诱变技术。Cao等[23]于2017年利用ARTP诱变获得了一株蛋白核小球藻的突变体,与对照组相比,其OD680增加了32.08%,干质量和产脂量分别增加了22.07%和16.85%。Sun等[24]利用ARTP诱变并定向筛选丙二酸(MA)抗性藻株,获得了高脂产率栅藻诱变株,其总脂含量比对照组高114.99%。本文28株微拟球藻ARTP诱变藻株中,有15株中性脂相对含量有显著提升,最高增加了105.8%,有5株生物量有显著提升,最高提升了60.9%,这说明ARTP诱变不仅可以提升藻株油脂含量也可以提升藻株生长。
甲基磺酸乙酯(EMS)和亚硝基胍(NTG)均属于烷化剂,其诱变机理为其活泼烷基与DNA分子中的氢原子发生烷化反应,引起碱基错配从而导致微藻的相关基因发生改变。Anandarajah等[6]使用EMS处理微拟球藻,与野生型相比,诱变藻株的总脂生产能力提高了25.7%。本实验的7株EMS诱变藻株,其中性脂相对含量均有显著提升,但仅有1株生物量有明显改变。Chou等[25]利用NTG诱变获得了一批耐热小球藻诱变株,其不仅可在40 ℃高温下生长还显示出比野生型更高的糖类和脂类含量。本实验18株NTG诱变藻株中,其中11株藻的中性脂相对含量有明显的改变,但所有诱变藻株生物量未发生显著改变,如诱变藻株231,尽管其油脂产率为原始藻株的323.8%,是实验藻株中油脂产率最高的,这主要是该藻株油脂积累能力比原始藻株高147.3%,而生物量仅提升了29.0%。这说明这类诱变剂可能更适用于微藻油脂含量的提升。
博莱霉素是一种来自放线菌的糖肽类抗肿瘤抗生素,其可与铁的复合物嵌入 DNA 中,导致 DNA 单链和双链断裂。张琳等[26]选取了5种抗生素对微拟球藻的抗生素抗性进行了比较,结果显示,微拟球藻对博莱霉素表现出高度敏感性。在固体培养中, 0.5 μg/mL的博来霉素即可完全抑制微拟球藻的生长。博莱霉素用于诱变微藻目前报道不多,本研究博来霉素诱变藻株中,藻株212号,生物量比原始藻株提高了49.8%,中性脂含量提高了65.5%,最终油脂产率提高了147.8%,说明博莱霉素不仅可以提高微拟球藻的油脂生产,也可以提高生物量的积累能力。
4 结语
本研究利用尼罗红染色结合流式细胞仪对75株微拟球藻进行了高通量筛选,结果显示该方法是一种方便快速的筛选方式。基于油脂产率是原始藻株250%这一选择指标,本实验75株藻株中,有3株表现突出,有望应用于生物柴油的生产。
