新型基因编辑技术在单细胞微藻中的应用进展
2021-01-27曹豪豪张红兵薛溪发李左群闫洪波李会宣
曹豪豪,张红兵*,薛溪发,李左群,闫洪波,李会宣
1.河北经贸大学生物科学与工程学院, 石家庄 050061;2.河北德诺商品检测技术服务有限公司, 石家庄 050061
当前化石能源短缺及其应用带来的污染日趋严重,阻碍了世界经济发展,研发替代能源势在必行,生物燃料作为可再生的能源形式潜力巨大,成为研究焦点[1]。微藻是自然界中起源最早、数量最多、分布最广的生物种类,是含有叶绿素a的光合作用微生物。由于许多种属的微藻在生长过程中能在细胞内大量积累生物质,已用于生产沼气、乙醇、生物柴油、生物氢等环保、清洁、经济的生物燃料,是化石燃料的理想替代品,同时利用藻类生物质生产食品和饲料添加剂乃至药物等也引起了广泛关注[2]。
为了充分发挥微藻生产潜力、优化生产工艺,有必要利用分子生物学技术研究微藻的遗传背景,解决脂质积累率偏低[3]、固定二氧化碳效率差[4]、培养周期长[5]等瓶颈问题。由于生物信息学和基因工程技术的迅速发展,尤其是新型基因编辑技术,已经成为解决上述问题的重要策略。其中,应用最广泛的是TALEN和CRISPR/Cas9 等基因编辑技术,在哺乳动物、植物等中已取得了较好的效果[6]。基于此,本文就上述技术在微藻遗传改造方面的应用进行综述,以期为相关研究提供借鉴。
1 基因组编辑技术
基因组编辑技术的核心是通过对生物体特定DNA片段的插入、敲除、修饰或替换等手段,使预期基因组序列发生改变并遗传,进而实现目标基因的编辑[7]。该方法不仅可以研究目的基因的功能,还可以赋予生物体新的生物学特性。特别是近几年被称为分子剪刀的工程核酸酶,极大地促进了基因组编辑的发展,包括锌指核酸酶(zinc finger nuclease, ZFN)、转录激活物样效应因子核酸酶(transcription activator-like effector nuclease, TALEN)和簇状规则间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats, CRISPR)/Cas(CRISPR-associated systems)核酸酶系统。
1.1 ZFN技术
目前应用的ZFN是一类人工合成的核酸内切酶,也就是具有特定基因编辑功能的蛋白质,由3个人工设计的锌指DNA结合结构域和1个FokⅠ核酸酶结构域组成,能特异剪切基因组某段DNA[8]。
ZFN的N末端是DNA的结合域,一般含3~4个串联的CysHis2锌指蛋白,其中每个锌指蛋白能够结合特定靶DNA序列中3 bp的片段;C末端多为非特异性FokⅠ核酸酶结构域,具有核酸内切酶活性,能够切割非特异DNA,切割时FokⅠ的催化结构域需要以适当的碱基距离形成异二聚体。如图1所示,为了进行有效的二聚化和切割,2个ZFN分子以尾对尾方式与相对链上的靶DNA结合,相间隔5~7 bp,在此间隔区中可以实现特定DNA位点的切割[10]。
1.2 TALEN技术
TALEN的DNA结合结构域源自转录激活子样效应物(transcription activator-like effector,TALE),该效应物是源于植物病原菌黄单胞菌属(Xanthomonas)[11]。
与ZFN相似,TALEN也包含2个结构域:N端为DNA特异性识别和结合区域TALE,C端为与ZFN相同的FokⅠ核酸酶催化结构域。其中TALE由N端转录信号、C端核定位信号、转录激活结构域以及DNA特异性识别和结合结构域组成。在TALE蛋白的转录激活结构域中含有由34个氨基酸组成的锌指模块同源重复序列,其中第12、13位为重复可变的双氨基酸残基(repeat variant diresidues,RVD)。TALE所识别的碱基是由不同的RVD所决定的,其中NI识别A、NG识别T、NH识别G、NN识别A或G、HD识别C、NS对4种碱基都可以识别,因此经过人工编辑TALE的RVD,能够识别对应的DNA序列。FokⅠ结构域来自FokⅠ核酸酶的末端活性域,需要二聚化才有活性。所以,在基因编辑的过程中需要2个TALEN蛋白,如图2所示,目标序列的上游与下游由2个TALE结构域分别识别,2个FokⅠ结构域作用在一段DNA上造成双链断裂,可以在该位点进行插入、敲除或点突变等操作[13-15]。
1.3 CRISPR/Cas技术
CRISPR/Cas系统是在细菌和古细菌中发现的一种获得性免疫系统,可用来对抗入侵的病毒及外源DNA[16-18]。CRISPR即成簇的规律间隔短回文重复序列,而 Cas 即 CRISPR 相关系统,位于 CRISPR序列的上游,包含多种功能蛋白基因[19]。
CRISPR是其中的靶位点识别组件,CRISPR转录生成CRISPR-RNA前体(pre-crRNA),随后前体被加工成短的成熟的CRISPR-RNA(crRNA),crRNA将与靶基因DNA通过碱基互补配对进行识别。切割DNA的组件为Cas核酸内切酶,CRISPR与Cas结合形成一种RNA-蛋白质的复合体,RNA特异性识别结合DNA,并引导Cas核酸酶特异性切割DNA[20]。
CRISPR/Cas免疫系统可分为TypeⅠ型、TypeⅡ型和Type Ⅲ型3种类型。其中Ⅱ型CRISPR系统CRISPR/Cas9是目前研究最为充分的系统,如图3所示,在CRISPR/Cas9系统中,向导RNA(guide RNA,gRNA)代替了上述crRNA和tracrRNA两者的作用,在gRNA的作用下,识别靶序列的原型间隔区相邻基序(protospacer adjacent motif,PAM)位点并引导Cas9核酸酶切割靶位点,通过非同源末端连接或同源重组进行修复以实现基因的敲除与修饰[22-23]。此外,Cas9蛋白还可在2个活性位点残基(D10A和H840A)发生突变,失去启动DNA双链断裂(double-strand breaks, DSBs)的能力,形成所谓的CRISPR/dCas9系统,可用于干扰和激活基因表达[24]。表1比较了3种编辑技术的优缺点。

图1 ZFN的作用机制[9]Fig.1 The mechanism of ZFN[9]
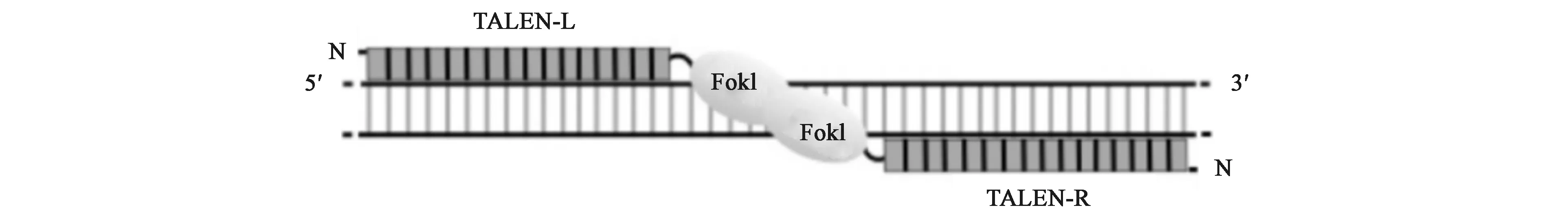
图2 TALEN的作用机制[12]Fig.2 The mechanism of TALEN[12]

图3 CRISPR/Cas9工作机制[21]Fig.3 The mechanism of CRISPR/Cas9[21]
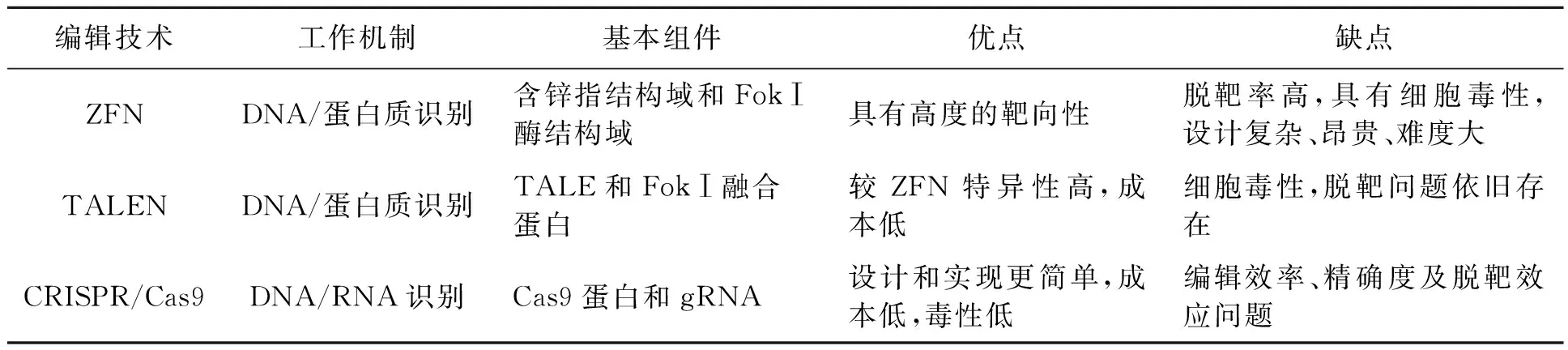
表1 新型基因编辑技术的比较Table 1 Comparison of new gene editing technologies
2 基因编辑技术在微藻中的应用
理论上,上述工具酶可以定点修饰任何物种的基因序列。它们结合到靶基因序列后,通过切割酶破坏靶DNA双链,然后启动非同源末端连接修复(nonhomologous end joining, NHEJ)或同源重组修复(homology-directed repair,HDR) 机制来修复靶基因,从而产生精确的定点修饰的靶基因而没有插入任何外源DNA片段,这种定点修饰就成为可以在后代中稳定遗传的变异[25],在微藻中同样适用。
2.1 ZFN技术在微藻中的应用
ZFN技术应用于微藻的研究非常少,只有1例。2013年,Sizova等[26]首次将ZFNs技术应用于莱茵衣藻(Chlamydomonasrehardtii,常作为基础和生物技术研究的通用模型),利用ZFNs靶向突变编码光敏一型视紫红质离子通道的COP3基因。ZFN的不同转化效率是由敲除抗性或荧光标记等报告基因来评估的,并根据结果修饰优化模块组合,选出亲和力和特异性最佳的核酸酶结合外源DNA共转化,实现对该藻株靶基因的定点敲除。这项技术不仅有助于衣藻单个基因功能的研究,而且还可以实现有效的基因定点修饰。
2.2 TALEN技术在微藻中的应用
TALEN诱导的靶向基因失活和靶向序列插入的方法,通过重塑硅藻新陈代谢方面的有效性在微藻中得到了证实。Daboussi等[27]首次将 TALEN 技术应用于硅藻的基因敲除。通过NHEJ介导的修复产生突变体,敲除了三角褐指藻(Phaeodactylumtricornutum)中参与油脂代谢的关键基因,其中尿苷二磷酸葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase,UCPase)基因的敲除突变株的甘油三酯(triacylglycerol, TAG)含量相比野生型藻株提高了45倍,使突变体具有工业生产的潜力。
之后的研究中,将TALEN表达盒与含有与TALEN靶位点同源序列侧翼的抗生素抗性基因的“敲除质粒”结合, TALEN与靶基因结合进行切割, “敲除质粒”则通过HDR整合到基因组, 敲除三角褐指藻P.tricornutum的尿素酶基因, 基于HDR的靶向插入更易获得突变体[28]。Hao等[29]通过TALEN基因组编辑技术破坏了P.tricornutum中硫酯酶基因,成功构建了ptTES1基因的敲除突变株,结果表明尽管微藻生长受到损害,但与野生型菌株相比,ptTES1基因敲除突变体显示出更高的TAG生产率,含量提高了1.7倍,证明了TALEN介导的靶基因敲除作为增强含油硅藻中TAG产生的有效策略的潜力。在最近的研究中,Kurita等[30]合成了编码为产油微拟球藻(Nannochloropsisoceanica)的Platinum TALENs,并通过在人HEK293T细胞中的单链退火实验验证了它们的DNA结合活性。以硝酸还原酶基因NoNR和酰基转移酶基因LPAT1为靶点,将Platinum TALEN的多合一表达载体转染到微绿球藻中。在N.oceanica候选位点没有可检测到的脱靶突变。同时引入TALENs靶向2个基因,获得双突变株。此外,这些多合一的TALEN载体在大肠杆菌中表现出高特异性和多重性。此研究为创造高性能藻类生物柴油的实际应用做出了贡献。
2.3 CRISPR/Cas9技术在微藻中的应用
首次应用CRISPR/Cas9对微藻的研究中,Jiang等[31]将Cas9蛋白和sgRNA(simple guide RNA,sgRNA)基因通过电穿孔导入衣藻细胞的实验,用非同源末端连接系统修复双链断裂,采用CRISPR/Cas9对微藻中的4个靶基因进行插入和缺失,成功在莱茵衣藻(Chlamydomonasreinhardtii) 细胞中表达Cas9蛋白与sgRNA,突变频率达42.8%。然而,由于Cas9的毒性,未能获得任何稳定遗传的转化子,严重降低了成功率。随后有研究表明,通过运送包含Cas9蛋白和sgRNAs的Cas9核糖核蛋白(ribonucleoprotein, RNPs)解决了这个问题,以避免与载体驱动的Cas9表达相关的细胞毒性和脱靶问题。在MAA7、CpSRP43和ChlM这3个位点获得了CRISPR/Cas9诱导的突变,与首次报道的转基因Cas9诱导突变相比,靶向诱变效率提高了100倍,通过使用Cas9 RNPs大大提高了基因敲除效率[32]。
Wang等[33]以硝酸还原酶(nitrate reductase, NR)为例,在工业产油性海洋微绿球藻(Nannochloropsisspp.)中建立了一种精确基因组编辑方法,用质粒载体介导的CRISPR/Cas9 技术敲除了微藻的1个硝酸还原酶基因,发现5 bp缺失突变体的比例超过1%,分离的突变体在NH4Cl作用下能正常生长,但在NaNO3作用下不能正常生长,是一个很有价值的转NR基因的基础菌株。有研究报道了在海洋微绿球藻中用CRISPR-Cas介导的基因组编辑的另一种方法:将RNP和编辑模板通过电穿孔直接导入微藻细胞,使Cas的表达可有可无,同源定向修复成为可能。Cas/RNPs与dsDNA修复模板的共导入有效地提高了靶位点的同源同组,产生了约70%的阳性突变系,阳性突变株比例显著提高,有利于高效产生微绿球藻靶向突变体[34]。
海洋硅藻是真核微藻,在海洋中具有重要的生态作用,所以更需要建立简单的CRISPR/Cas9体系。Nymark等[35]在三角褐指藻(Phaeodactylumtricornutum)中开发了CRISPR/Cas9系统,经优化后实现了稳定的靶基因敲除。该系统发挥功能需要的2个组分,Cas9核酸酶和引导核酸酶指向特定DNA序列的引导RNA,都可以在同一载体中表达,结果在26个转化实验中有8个得到了突变子,突变频率为31%。Moosburner等[36]提出了改进方法,改进后单基因和双基因突变细胞系都是通过将1个选择性Cas9和1个或2个sgRNAs接合后引入硅藻,同时利用阴性和阳性选择的外显子克隆策略,再利用人工测序、潮汐测序分析和T7核酸内切酶分析,开发了细胞系筛选和基因分型策略,缩短产生突变体所需时间,结果单基因和双基因敲除细胞系的突变率分别为48%和25%。
从微藻提炼油脂是解决石油枯竭和二氧化碳排放问题的一种可选择、可持续、有前途的发展趋势。鉴于微藻细胞生长和油脂含量的限制,利用CRISPR/Cas9系统进行改造具有重要意义。Lin等[37]证明农杆菌介导的质粒适合对小球藻(Chlorellavulgaris)进行基因插入,并以ω-3脂肪酸去饱和酶(fatty acid desaturase 3,Fad3)基因为基础构建了结构类似的含有Cas9片段的质粒,该片段含有设计在Fad3基因上的sgRNA,在小球藻FSP-E中表达脂质含量高达46%,这是首次成功将CRISPR/Cas9技术用于小球藻基因操作的案例。
本课题组目前正在进行微藻的相关研究,获得了带有 G418 抗性的Cas9质粒,将重组质粒成功转化到小球藻,为CRISPR/Cas9技术应用于小球藻提供参考[38]。
3 展望
ZFN和TALEN都是蛋白识别机制,CRISPR/Cas9系统识别机制则是通过人工设计的sgRNA实现,操作简便,便于上手,容易构建。此外,CRISPR/Cas基因组编辑的效率和精确度通过不断的努力得到了提高,包括Cas蛋白和sgRNA的不同表达策略,因而成为了主流的基因组编辑技术。
目前,基因组编辑技术主要是产生内源基因功能缺失的突变体,对基因定点替换及基因的定点插入仍具有极大的挑战性,无法做到对任一位点上高效地替换或插入任意序列,这就限制了基因组编辑技术在微藻中的应用。与此同时,微藻本身还有很多问题,由于它们独特的细胞壁和表面结构,很难将遗传物质转入细胞中,通常需去除细胞壁并使用原生质体转化,从而提高转化效率。微藻可能在转录或转录后水平上对引入的遗传物质(包括DNA和RNA)具有沉默机制,暂时抑制其中一个沉默组件可以提高其转化效率。
随着基因工程技术、生物信息学的飞速发展,微藻遗传背景日趋明晰,对微藻进行基因改造已成为现实。新型基因编辑技术仅在莱茵衣藻、三角褐指藻、海洋微绿球藻等几种微藻模型中进行了实验,通过基因组、转录组学等方法对某些潜在菌株进行全面分析,深入研究将充分发挥新型基因编辑技术在更多微藻中的应用潜力,以更有效和更可行的方式从微藻中生产生物燃料或其他有价值的产品,有可能彻底改变未来高效和精确的基因工程解决方案,具有无可比拟的优势和发展前景。
