辛伐他汀联合机械牵拉激活Wnt/β-catenin信号通路促进大鼠骨髓间充质干细胞成骨分化
2021-01-27陈斌伟刘圣曜黄帅王斌陈元鸿
陈斌伟 刘圣曜 黄帅 王斌 陈元鸿
广州医科大学附属第二医院(广州510260)
大段骨缺损和骨不连是骨科的棘手难题,不仅给患者带来身体及心理伤害,也给其家庭及社会带来沉重的经济负担。随着医学水平的发展及技术的不断提高,牵张成骨成为临床治疗大段骨缺损和骨不连的常用方法[1-2]。然而,治疗周期长及新骨生物力学性能差等缺点限制了牵张成骨在临床广泛应用[3]。如何加快新骨矿化速度、提高新骨生物力学强度及缩短治疗周期是一个亟需解决的临床难题。临床上使用骨形态发生蛋白(bone morphogenetic protein,BMP)等促进成骨,但存在价格昂贵、半衰期短等缺点[4]。因此,探讨促进牵张成骨的药物具有重要的临床及社会意义。
辛伐他汀(simvastatin,SIM)是一种常见的他汀类药物,临床上主要用于治疗心脑血管疾病。近年来,体内外实验研究发现辛伐他汀除降低血脂等作用外,尚可通过影响骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)分化影响发挥促成骨作用[5-6],且与Wnt/β-catenin、BMP/Smads 等信号通路密切相关[7-8]。虽然辛伐他汀及适当机械刺激均能促进成骨,但两者联合应用是否能起到协同作用尚无报道,其相关机制研究更少。为此,本研究从体外探讨辛伐他汀对机械牵拉环境下BMSCs 成骨分化的影响及Wnt/β-catenin信号通路在其中的作用。
1 材料与方法
1.1 材料普通级80~100 g 雄性SD 大鼠(Sprague Dawley Rats)由南方医科大学南方医院动物实验中心提供(许可证号:NFYY-2016-129),用于BMSCs分离培养等。低糖DMEM 培养基(Gibco,美国),胎牛血清(Gibco,美国),胰蛋白酶(Amresco,美国),CCK-8(日本同仁公司)。
1.2 方法
1.2.1 大鼠BMSCs 培养大鼠颈椎脱臼处死后放入75%酒精浸泡5 min,生物安全柜内无菌条件分离出大鼠股骨和胫骨,将附着于骨上的肌肉尽可能剥离干净后将骨依次浸泡于75%酒精和PBS(phosphate buffer saline)中各5 min,随后将骨两端干骺端剪断暴露骨髓腔,10 mL 注射器吸取低糖DMEM(Dulbecco's Modified Eagle's medium)培养液冲洗骨髓腔数次,冲出的骨髓装于15 mL 离心管。将离心管以1 000 r/min 离心5 min,去掉上层培养基后加4 mL 含FBS(Fetal Bovine Serum)的低糖DMEM 培养基将底层沉淀物制成混悬液,将混悬液加入25 cm2的培养瓶中,第2 天细胞换液,以后每2~3 天换液1 次,细胞长至80%~90%时进行传代,第3 代细胞使用成脂肪诱导液及成骨诱导液诱导14 d 及21 d 后行油红O 及茜素红染色,第3 ~4 代细胞用于后续实验研究。
1.2.2 大鼠BMSCs 表面抗原分子的检测第3 代BMSCs 长至80%~90%时将0.25%胰蛋白酶溶液消化细胞,将消化获得的细胞放至15 mL 离心管以1 000 r/min 离心5 min,收集细胞沉淀用PBS 重悬洗涤后,1 000 r/min 再次离心5 min,制成浓度为1 × 106/mL 单细胞悬液。1 × 105(100 μL)与5 μL荧光标记的单克隆抗体混合(抗大鼠CD45-PE、CD11b-FITC、CD79-FITC 和CD90-PE),并在暗室中孵育15 min。用PBS 洗涤细胞2 次后立即使用Coulter Elite-ESP 流式细胞仪进行检测分析。
1.2.3 实验分组实验分为对照组(CON)、辛伐他汀组(SIM)、机械牵拉组(STR)及SIM+STR 组。STR 组:第3 代BMSCs 细 胞以2.0 × 105/孔 接 种 于BioFlex 培养板中,将BioFlex 培养板置于FX-5000T细胞应力装置进行牵拉,以10%机械牵拉以1 Hz 进行牵拉,每天牵拉6 h 连续牵拉7 d。对照组不予机械牵拉,STR+SIM 在机械牵拉的同时加10-7mol/L辛伐他汀,实验中每2~3 天换液1 次。此外,添加20 nmol/L 的DKK1 观察Wnt/β-catenin 通路在联合应用中的作用。PCR、碱性磷酸酶(ALP)染色、Western blot 等方法检测各组成骨分化的变化。
1.2.4 ALP 活性检测各组细胞干预结束后按5×104/孔接种于12 孔板,成骨诱导液继续培养3 d。吸去各孔中的培养液后用PBS 轻洗细胞3 次,4%多聚甲醛固定细胞15 min 后再次用PBS 洗2 次。每孔加入配好的ALP 染色液1.5 mL 常温避光染色30 min;去掉染液后用PBS 冲洗2 次,在室温下晾干后显微镜下观察并拍照。ALP 活性检:PBS 洗涤细胞2 次利后加入10 mmol/L 的Tris-HCL裂解细胞。收集细胞于4 ℃预冷的离心机上以10 000 g 的速度离心10 min,收集上清液行ALP 活性检测。用0.1 mol/L 的NaOH 溶液中断后在波长405 nm 处测其OD值,并于波长570 nm 处用BCA试剂盒测总体蛋白含量,ALP 活性用总蛋白进行对照。
1.2.5 基因的定量分析方法(RT-PCR)各组细胞干预结束后检测成骨及β-catenin 相关基因,具体方法如下:提取细胞总RNA,按试剂盒说明书合成cDNA 第一链,于20 μL 反应体系中加入引物、cDNA 模板和SYBR Green Master Mix。PCR 扩增反应条件:94 ℃预变性3 min;然后进行30 个循环反应,其温度循环条件为:94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min;循环结束后72 ℃再延伸5 min。各基因引物序列如下:GAPDH:5'-GGCACAGTCAAGGCTGAGAATG-3'(正义链),5'-ATGGTGGTGAAGACGCCAGTA-3'(反义链);RUNX2:5'-GGCCACTTACCACAGAGCTA-3'(正义链),5'-GAGGCGGTCAGAGAACAAAC-3'(反义链);Collagen I(Col 1a):5'-CATGTTCAGCTTTGTGGACC-3'(正义链),5'-TTAGGGACCCTTAGGCCATT-3'(反义链);ALP:5'-AACAACCTGACTGACCCTTC-3'(正义链),5'-TCCACTAGCAAGAAGAAGCC-3'(反义链);β-catenin:5'-TTGTACGAGCACATCAGGAC-3'(正义链),5'-GCACCCTTCAACTATCTCCTC-3'(反义链);Osteocalcin(OCN):5'-GACTGCATTCTGCCTCTCTG-3'(正义链),5'-ATTCACCACCTTACTGCCCT-3'(反义链);LPR5:5'-CCTGGCGCTGTGACGGCTTCC-3'(正义链),5'-CAATGGCGCTGCTGTGGGCTGGTA-3'(反义链)。
1.2.6 Western blot 检测各组干预结束后,去掉牵拉板中上清液,PBS 清洗2 次,加RAPI 裂解液后收集细胞加入15 mL 离心管中以2 000 r/min 离心20 min,收集上清按Bradford 法测定各组蛋白浓度。取25 μg 蛋白行SDS-聚丙烯酰胺凝胶电泳,并转移至PVDF 膜,5%脱脂牛奶室温封闭1 h 后用TBST洗3 次,再加入一抗anti-β-catenin 和anti-GAPDH单克隆抗体,将其置于4 ℃冰箱孵育过夜,次日以TBST 洗3 次后加入HRP 标记的IgG 二抗室温孵育30 min,用TBST 洗涤3 次后加入超敏发光底物,曝光显影并用Image J 分析条带灰度值。
1.3 统计学方法所有的统计均使用SPSS 19.0软件进行分析。实验数据均采用均数±标准差表示,单因素方差分析用于比较不同组别间的差异,两组之间的差异用SNK-q检验进行分析。P<0.05时差异有统计学意义。
2 结果
2.1 大鼠BMSCs 性能及表面抗原分子的鉴定显示第3 代细胞以长梭形为主(图1A),BMSCs 经机械牵拉(图1B)BMSCs 经成骨诱导液诱导21 d 后茜素红染色显示大量钙结节形成(图1C),BMSCs经成脂诱导液诱导14 d后油红O染色示脂滴形成(图1D),这些结果表明分离的细胞具有成骨及成脂分化能力,具有干细胞特性。流式细胞仪行细胞表面抗原分子鉴定结果示:CD79 和CD90 呈阳性表达,表达量分别为(96.9±1.2)%和(97.4±1.5)%,而CD11b和CD45呈阴性表达,表达量分别为(9.4 ± 0.8)%和(5.9±0.5)%(图2),这些表面抗原表达符合BMSCs免疫表型。通过经典干细胞培养方法培养出大鼠BMSCs,为后面实验顺利进行奠定基础。
2.2 机械牵拉联合辛伐他汀促进大鼠BMSCs成骨分化ALP 活性结果显示:与CON 组相比,SIM 组、STR 组以及STR+SIM 组均能不同程度促进大鼠BMSCs 的成骨分化,且STR + SIM 组对大鼠BMSCs的成骨分化作用最明显(P<0.05,图3A)。
进一步检测各组成骨基因表达,COL 1a 是骨形成的关键因子,主要由成骨细胞分泌。ALP 是成骨早期的标志物,其含量高低与成骨细胞分化密切相关。OCN 是成骨晚期基质矿化相关因子。RUNX2 是成骨分化过程的转录因子,直接反映成骨分化的程度。PCR 结果显示SIM 组、STR 组以及STR+SIM 组成骨基因相对表达量较CON 组均上升,其中STR+SIM 组上升最明显(P<0.05),表明辛伐他汀、机械牵拉以及辛伐他汀联合机械牵拉均能不同程度促进大鼠BMSCs 的成骨分化,对BMSCs 早期和晚期成骨分化均有促进作用,且辛伐他汀联合机械牵拉对大鼠BMSCs 成骨分化作用最明显(P<0.05,图3B)。
2.3 机械牵拉联合辛伐他汀增加Wnt/β-catenin信号通路β-catenin 等基因表达PCR 及WB 结果显示:与CON 组相比,SIM 组、STR 组以及STR+SIM组β-catenin 基因及蛋白表达含量均升高,且STR+SIM 组升高最明显(P<0.05,图4),表明各组均能激活β-catenin 通路。
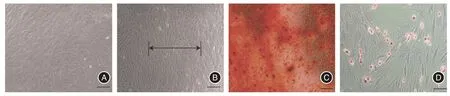
图1 BMSCs 体外培养不同阶段观察结果Fig.1 Observation of BMSCscultured in vitro at different stage

图2 第3 代BMSCs 表面抗原表达流式结果Fig.2 The immunophenotypic characterization of the third generation BMSCsanalyzed by Flow Cytometry
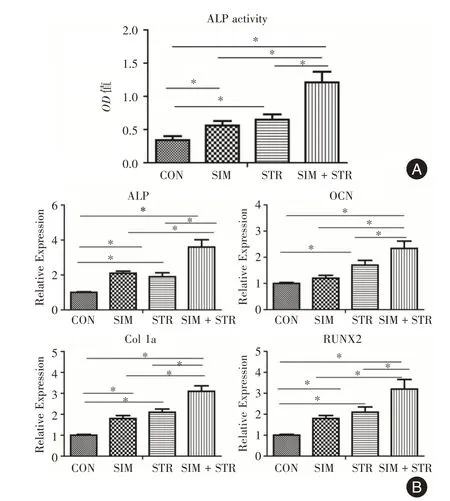
图3 各组ALP 活性及成骨相关基因表达Fig.3 The ALP activity and the expression of osteogenesisrelated genes
2.4 抑制Wnt/β-catenin 通路降低机械牵拉联合辛伐他汀促BMSCs 成骨分化效果为进一步验证Wnt/β-catenin 信号通路在STR+SIM 组促BMSCs 成骨分化中的作用,使用Wnt/β-catenin 特异性阻滞剂DKK1 进行处理,结果显示使用DKK1 后STR+SIM 组ALP 活性下降(P<0.05,图4D),表明STR+SIM 通过Wnt/β-catenin 信号通路促进BMSCs 成骨分化。
3 讨论
辛伐他汀已被证明具有促成骨分化能力,但其在牵张成骨中的作用及具体机制尚不清楚。本研究从体外探讨辛伐他汀对机械刺激环境下BMSCs 增殖及成骨分化的影响及其机制,结果显示适量的机械牵拉及辛伐他汀均能促进BMSCs 成骨分化,辛伐他汀能增加机械牵拉促BMSCs 成骨分化效果,且这一过程与激活Wnt/β-catenin 信号通路密切相关。

图4 各组β-catenin 通路基因蛋白表达及ALP 活性Fig.4 The expression of β-catenin and the level of ALP activity in each group
大量的研究[9]探讨机械牵拉对BMSCs增殖及成骨分化的影响,但研究结果尚不完全一致。CHEN等[10]设置机械牵拉装置为1 Hz,以2.5%、5%及10%机械牵拉作用于人BMSCs,探讨不同大小的机械牵拉刺激对人BMSCs 氧化及成骨分化的影响,结果表明机械牵拉对人BMSCs 具有抗氧化应激及促成骨分化作用;TAN 等[11]研究发现过度的机械刺激可通过诱发BMSCs 氧化应激减弱BMSCs 成骨分化。机械牵拉对BMSCs 增殖及成骨分化的影响主要受牵拉装置类型、牵拉应变率、牵拉频率及作用时间等因素影响[12]。且机械牵拉对BMSCs 的影响与刺激力的大小密切相关,过小或过大的机械刺激对BMSCs 无明显作用甚至有害,只有适量的机械刺激可引起BMSCs 增殖及成骨分化[13]。本研究选择频率为1 Hz 的10%牵拉力作用于大鼠BMSCs 7 d,结果表明其能促进BMSCs 成骨分化,这一结果与既往文献及以往研究结果一致[14],为进一步研究提供基础。
MUNDY 等[15]首次发现他汀类药物能提高细胞成骨基因表达。随后大量体内外研究发现他汀类药物具有促成骨分化能力。FENG 等[8]发现适量浓度的辛伐他汀可通过BMP-2/Smads 信号通路促进BMSCs 成骨分化发挥抗骨质疏松作用。LIN等[16]发现辛伐他汀在预防和治疗骨质疏松中发挥重要作用。杨建辉等[17]探讨不同浓度辛伐他汀对成骨细胞成骨分化的影响,结果发现辛伐他汀对成骨细胞增殖与浓度相关,辛伐他汀大于10-8mol/L可以增加成骨ALP 的表达含量,过低则无明显促成骨作用,表明辛伐他汀对成骨细胞增殖存在明显的量效关系。本研究发现10-7mol/L 辛伐他汀能够促进BMSCs 成骨分化,与以往文献结果一致。
辛伐他汀(生物因子)及机械牵拉(物理因子)均能促进BMSCs 增殖和成骨分化,但联合应用辛伐他汀及机械牵拉对BMSCs 成骨分化的影响尚不清楚。本研究联合应用10-7mol/L 辛伐他汀及10%机械牵拉作用于BMSCs,检测其对BMSCs 成骨分化的影响,结果表明辛伐他汀能够增加10%机械牵拉促BMSCs 成骨分化效能,ALP 及OCN 反应了BMSCs 成骨分化的早期和晚期阶段,结果显示机械牵拉联合辛伐他汀对BMSCs 早期及晚期成骨分化均有促进作用。这些结果表明辛伐他汀可协同机械牵拉促进BMSCs 成骨分化,为辛伐他汀促牵拉成骨提供理论基础。
Wnt/β-catenin 信号通路是Wnt 通路中的“经典途径”,与骨代谢密切相关[18-19]。Wnt 蛋白将信号导入后与frizzled 受体结合,Wnt 信号通路激活时,GSK-3β被募集并磷酸化LRP6,而不能磷酸化βcatenin 从而避免被其降解[20]。以往研究表明辛伐他汀及机械牵拉均可通过Wnt/β-catenin 信号通路促进BMSCs 增殖及成骨分化。本研究发现辛伐他汀、机械牵拉及机械牵拉联合辛伐他汀均能增加BMSCs 中β-catenin 基因及蛋白表达含量,且机械牵拉联合辛伐他汀组β-catenin 表达升高最明显。为进一步验证机械牵拉联合辛伐他汀是否通过Wnt/β-catenin 信号通路促进BMSCs 成骨分化,采用Wnt/β-catenin 通路阻滞剂DKK1 预处理,结果发现DKK1 能够抑制机械牵拉联合辛伐他汀促BMSCs 成骨分化效能。这些结果表明机械牵拉联合辛伐他汀通过激活Wnt/β-catenin 信号通路促进BMSCs 成骨分化。
综上所述,适当大小机械牵拉及辛伐他汀均能促进BMSCs 成骨分化,辛伐他汀能提高机械牵拉促BMSCs 成骨分化能力,且与激活Wnt/β-catenin 信号通路密切相关。该研究为辛伐他汀用于促牵张成骨提供理论基础,今后将进一步建立牵拉成骨模型探讨辛伐他汀对牵张成骨的影响并深入探讨Wnt/β-catenin 信号通路在其中的作用。
