去泛素化酶抑制剂Au(PPh3)PT对胃癌细胞活力和凋亡的影响及机制
2021-01-27张培全黄擎天龙惠丹李小芬
张培全 黄擎天 龙惠丹 李小芬
广州医科大学广东省蛋白质修饰与降解重点实验室(广州511436)
胃癌是最常见的恶性肿瘤之一,其发病率和病死率分别为全球恶性肿瘤的第五位和第三位[1]。在我国胃癌患者总体5年生存率不足50%[2],化疗作为晚期胃癌最常用的治疗手段之一[3-4],发挥了重要作用,但存在许多不良反应[5-7],迫切需要开发其他抗胃癌药物。Au(PPh3)PT 为实验室研发合成的一价金离子化合物,已被证实可以有效抑制多种去泛素化酶(deubiquitinase,DUB),是一种潜在的抗肿瘤药物[8]。本研究旨在探索Au(PPh3)PT 能否有效诱导胃癌细胞的毒性作用,为胃癌的治疗提供新的药物选择。
1 材料与方法
1.1 实验细胞人胃癌细胞系MGC-803 和SGC-7901 由广州医科大学附属肿瘤医院肿瘤研究所惠赠,均来源ATCC 细胞库。
1.2 实验药品与试剂RPMI-1640 培养基和胎牛血清购自Gibco;MTS 试剂盒购自Promega;抗caspase-3、抗caspase-8、抗caspase-9、抗cleaved caspase-8 及抗PARP 抗体购自Cell Signaling Technology;抗K48-、抗GAPDH、抗cleaved caspase-3 和抗cleaved caspase-9 抗体购于Bioworld Technology;Annexin V - fluoroisothiocyanate (FITC)/propidium iodide(PI)试剂盒购自江苏凯基生物技术股份有限公司;ECL 发光试剂盒、抗Ub 抗体、辣根酶标记山羊抗兔/抗鼠IgG 购自Santa Cruz;其他生化试剂为进口分装或国产分析纯。
1.3 实验仪器Varioskan Flash 酶标仪(美国Thermo 公司);荧光倒置显微镜(德国ZEISS 公司);HERA cell 150i 细胞培养箱(美国Thermo 公司);Accuri C6 流式细胞仪(美国BD FACSAria 公司);5810R 离心机(德国Eppendorf 公司)。
1.4 检测方法
1.4.1 细胞培养细胞用含10%胎牛血清的RPMI-1640 培养,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中。
1.4.2 MTS 法测定细胞活力收集细胞,调为1 ×105个/mL 细胞悬液,每孔100 μL,接种到96 孔板,细胞培养24 h;弃掉旧培养液,加入新培养液(含1%的Au(PPh3)PT 药物溶液)100 μL,设DMSO 溶剂对照及空白对照组,分别作用24、48、72 h,加入20 μL MTS,避光培养2 ~4 h 后检测OD值,计算抑制率及IC50。
1.4.3 倒置荧光显微镜观察细胞凋亡将胃癌细胞消化、计数,制成2 × 105个/mL 的细胞悬液,接种到6 孔板,每孔2 mL,培养24 h;弃掉旧培养基,加入3 mL 含药物的新培养基,培养24 h;PBS 洗涤后每孔加入500 μL 的Binding Buffer,再依次加入5 μL Annexin V-FITC 和5 μL PI 染色液,混匀,室温避光孵育15 min,倒置荧光显微镜拍照,记录细胞形态及荧光标记情况。
1.4.4 流式细胞术检测细胞凋亡细胞铺板、加药,培养24 h,PBS洗涤,用不含EDTA的胰蛋白酶溶液消化,PBS 洗涤,收集细胞;每管加入500 μL 的Binding Buffer,再加入5 μL Annexin V-FITC 和5 μL PI 染色液,混匀,室温避光孵育15 min,流式细胞仪检测细胞凋亡情况。
1.4.5 Western blot 检测蛋白水平细胞经消化、离心、PBS 洗涤后收集,蛋白裂解液裂解细胞,超声破碎仪破碎细胞。4 ℃,13 000 r/min,离心10 min,取上清,BCA 法测定蛋白浓度,将浓度调一致。SDS电泳法检测蛋白水平,10%的聚丙烯酰胺凝胶电泳分离蛋白;转膜,4 ℃冰浴,286 mA 恒电流150 min;将PVDF 膜完全浸入5%脱脂牛奶中,37 ℃平缓摇动1 h;封闭结束后加入一抗室温下孵育1 h;TBS/T漂洗后,将PVDF 膜浸入含8 mL 二抗的脱脂牛奶中,37 ℃摇动1 h;再用TBST 进行充分漂洗,最后采用ECL 化学发光法进行胶片曝光检测相关蛋白的变化。
1.5 统计学方法所有实验均独立进行3 次,GraphPad Prism 5.0 和SPSS 19.0 统计软件进行结果分析。数据均采用均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,两组间差异比较采用t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 Au(PPh3)PT 对胃癌细胞活力的抑制情况Au(PPh3)PT 作用24、48、72 h 后,MTS 方法检测Au(PPh3)PT 对胃癌细胞活力的抑制情况,可见Au(PPh3)PT 明显抑制胃癌细胞的活力,呈浓度和时间依赖性,见图1。

图1 Au(PPh3)PT 诱导胃癌细胞活力的抑制Fig.1 Au(PPh3)PT inhibited the cell viability in gastric cancer cell lines
2.2 Au(PPh3)PT 引起胃癌细胞形态学的改变实验发现随着Au(PPh3)PT 浓度的增高,Annexin VFITC/PI 双染的阳性细胞数增多,并伴有典型的细胞形态学变化,表明Au(PPh3)PT 可以诱导胃癌细胞的凋亡,见图2。

图2 Au(PPh3)PT 导致胃癌细胞形态学的变化Fig.2 Au(PPh3)PT induced morphological changes in gastric cancer cell lines
2.3 Au(PPh3)PT 诱导胃癌细胞凋亡的情况为进一步确证Au(PPh3)PT 诱导胃癌细胞凋亡,采用流式细胞仪检测。结果表明随着Au(PPh3)PT 浓度的增高,细胞凋亡率增高,与溶剂对照组相比差异有统计学意义(P<0.05),结果见图3。

图3 Au(PPh3)PT 诱导胃癌细胞的凋亡Fig.3 Induction of apoptosis in gastric cancer cell lines by Au(PPh3)PT
2.4 Au(PPh3)PT 引起胃癌细胞凋亡相关蛋白的变化免疫印迹结果显示Au(PPh3)PT 可以明显诱导胃癌细胞caspase-3、caspase-8、caspase-9 前体减少,活化带增多;PARP 切割带出现,表明Au(PPh3)PT 导致胃癌细胞凋亡的机制与caspase 系统的激活有关,见图4。
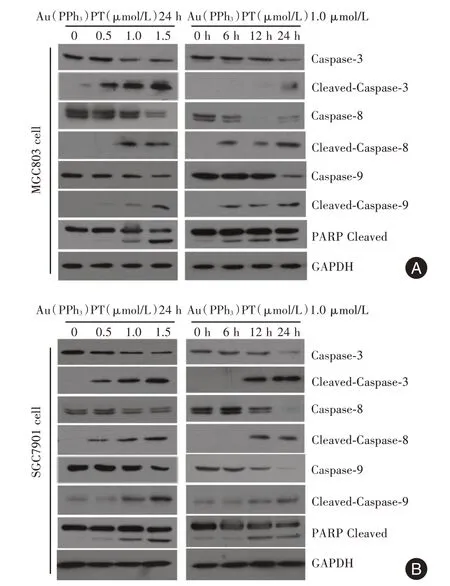
图4 Au(PPh3)PT 诱导胃癌细胞凋亡相关蛋白的改变Fig.4 Au(PPh3)PT resulted in changes of the apoptosisrelated proteins in gastric cancer cell lines
2.5 Au(PPh3)PT 引起胃癌细胞泛素化蛋白的改变免疫印迹结果显示Au(PPh3)PT 明显引起胃癌细胞总的及K48-链接的多聚泛素化蛋白的聚集增加,表明Au(PPh3)PT 能够抑制胃癌细胞的蛋白酶体功能,见图5。
3 讨论
泛素-蛋白酶体系统(the ubiquitin-proteasome system,UPS)降解细胞内80%以上的蛋白[9],不仅能清除错误的蛋白,还对细胞生长、DNA 修复等发挥重要作用[10-11]。UPS 功能障碍与多种疾病的发生发展密切相关,如神经退行性疾病、心血管系统疾病、病毒感染及肿瘤等[12-15]。多种肿瘤细胞蛋白酶体活性异常增高,表明这些肿瘤细胞比非肿瘤细胞更依赖UPS 来抵御细胞压力,靶向UPS 可以治疗多种肿瘤[16-18]。但靶向UPS 用于胃癌治疗的研究较少,效果不确切,需要更多研究证实[19-20]。

图5 Au(PPh3)PT 引起胃癌细胞泛素化蛋白的聚集增加Fig.5 Au(PPh3)PT induced increasing of ubiquitinated proteins in gastric cancer cell lines
蛋白酶体抑制剂分为20S 蛋白酶体抑制剂和DUB 抑制剂。硼替佐米是首个被美国FDA 批准用于临床治疗多发性骨髓瘤的20S 蛋白酶体抑制剂,取得了很好的疗效,但其耐药和副作用的问题有待解决[21-22]。与20S 蛋白酶体抑制剂相比,大部分DUB 抑制剂只针对一部分DUB,具有更好的特异性和选择性,用于肿瘤治疗具有重要意义[23]。DUB 抑制剂受到学者的高度关注,其应用前景非常广阔。但目前还没有用于临床治疗疾病的药物。
Au(PPh3)PT 为课题组研发合成的一价金离子化合物,研究证实其有效抑制19S 蛋白酶体相关DUB(UCHL5 和USP14)及胞浆内部分DUB(USP7,USP10,USP15,USP25)的活性[8],是一个潜在用于抗肿瘤的DUB 抑制剂。笔者推测Au(PPh3)PT 或许可以抑制胃癌细胞的生长。本研究对Au(PPh3)PT 对肿瘤细胞活力的影响进行检测,发现Au(PPh3)PT 确实可以有效抑制胃癌细胞的活力,并呈现剂量和时间依赖性。形态学及流式细胞术结果显示Au(PPh3)PT 可使胃癌细胞凋亡率明显增加。以上表明Au(PPh3)PT 能够诱导胃癌细胞的毒性作用,是一个潜在的抗胃癌药物。
泛素分子有76 个氨基酸残基,其序列高度保守,全长包含7 个赖氨酸位点(K6、K11、K27、K29、K33、K48、K63)和1 个C 端的甘氨酸位点,其中48位赖氨酸链接(K48-)被认为与蛋白酶体降解有关[24-25]。本研究发现Au(PPh3)PT 可以使总的及48 位链接的泛素化蛋白大量聚集,表明Au(PPh3)PT 抑制了胃癌细胞UPS 活性。有报道[23]抑制肿瘤细胞的UPS 活性可诱导肿瘤细胞的凋亡,本研究结果也表明Au(PPh3)PT 通过抑制胃癌细胞UPS的活性从而诱导其凋亡。
Caspase-8 和caspase-9 是凋亡启动子,其中caspase-8 可以启动死亡受体介导的外源性细胞凋亡通路,而caspase-9 可以启动线粒体介导的内源性细胞凋亡通路,两者都可激活下游的凋亡效应子caspase-3,发生级联反应,使细胞凋亡[26]。本研究结果显示Au(PPh3)PT 可以明显引起caspase-3、caspase-8、caspase-9 前体减少,活化的切割带相应增多,表明Au(PPh3)PT 通过影响caspase 通路从而引起胃癌细胞凋亡。
综上所述,本研究对Au(PPh3)PT 对胃癌细胞的毒性作用及其机制进行探讨,研究发现Au(PPh3)PT 明显抑制胃癌细胞的活力并诱导其凋亡,机制与激活caspase 系统和抑制UPS 活性有关。本研究为DUB 抑制剂用于胃癌的治疗提供新的理论依据。本实验尚存诸多不足,如缺乏体内实验,后续有待进一步开展;同时更多的蛋白酶体抑制剂对胃癌的作用有待探索和比较,以期找出高效低毒的抗胃癌药物,改善胃癌患者的生存率和生存质量。
