载辛伐他汀PCL-Gt/PCL屏障膜对兔颅骨缺损修复作用的研究
2022-01-17黄崇上朱慧勇
黄崇上,朱慧勇
在临床中由于各种原因导致的骨缺损十分常见,现有的骨缺损修复治疗方法包括自体骨移植、同种异体骨移植以及人工骨替代品移植。引导骨再生技术[1](guided bone regeneration, GBR)是近年来临床中用于治疗骨缺损的主要方法,其中屏障膜的使用能够选择性阻断缺损区域上皮细胞和纤维细胞长入,为成骨细胞增殖,新骨形成提供空间,是治疗成功的关键因素[2]。然而当下临床中所使用的屏障膜因缺乏成骨诱导作用,需要协同使用不可吸收的人工骨替代物来促进骨组织再生。因此,寻找既具有良好的屏障功能,又能够加载生物活性因子并进行缓慢释放的生物膜成为骨组织工程领域的研究热点。
静电纺丝技术能够通过对喷丝嘴施加高压,使不同的聚合物溶液形成核壳结构,制备出具有相互连接的三维多孔结构和巨大表面积的生物膜,被用作缓释系统搭载药物、生长因子或基因,广泛应用于生物医学工程领域[3-4]。我们曾利用静电纺丝技术成功制备了载有骨形态发生蛋白2(bone morphogenetic protein 2, BMP-2)的聚乙二醇/聚己内酯(PEG/PCL)膜,体内和体外实验证实了该膜能够促进成骨细胞分化和新骨形成[5]。但是,BMP-2价格昂贵,容易失活,在机体内使用可能引起免疫反应,在临床应用中受到较大限制。
辛伐他汀是一种脂溶性药物,能够通过提高BMP-2的表达来促进体内外成骨[6-7]。在临床中,辛伐他汀主要通过口服摄入并作用于肝细胞,较难在骨髓中达到有效浓度,调节成骨细胞及破骨细胞的生物学行为。有学者通过皮下注射来达到局部应用辛伐他汀的目的,但需一天多次注射以维持局部浓度,且存在增加炎症发生的风险,限制了它在临床中的应用[8-10]。因此,设计并制备能够加载难溶性辛伐他汀的生物膜,能够局部缓慢释放药物,显得至关重要。本研究拟通过同轴静电纺丝技术构建能控释辛伐他汀的PCL-Gt/PCL膜,评价其稳定性和对骨缺损愈合的影响,为该膜在骨组织工程领域的应用提供理论依据,并为新型骨生物材料的研发提供新思路。
1 材料与方法
1.1 实验动物
选取雄性新西兰大白兔18只(浙江大学动物实验中心提供),体重2.0~2.5 kg。随机分为空白组、阴性对照组和实验组,每组6只。空白组不植入生物膜,阴性对照组植入PCL-Gt/PCL膜,实验组植入PCL-Gt/PCL-辛伐他汀膜。本实验经由浙江大学医学院附属第一医院动物伦理委员会审批通过。
1.2 实验方法
1.2.1 载辛伐他汀Gt/PCL膜的制备及表征 将明胶(gelatin,Gt)溶解在三氟乙醇(2,2,2-trifluroroethanol,TFE)中,得到质量分数为12%的溶液;辛伐他汀溶解在质量分数为20%的聚己内酯(polycaprolactone,PCL)溶液中,最终质量分数为3.5%。同轴静电纺丝过程参照已有研究进行[11]。Gt/TFE溶液用于制备外壳;而含有辛伐他汀的PCL/TFE溶液用于制备内核,获得Gt/PCL-辛伐他汀膜。此后利用单射流将单纯PCL膜与Gt/PCL-辛伐他汀膜进行混纺,最终获得双层PCL-Gt/PCL-辛伐他汀膜(图1A)。同时制备不含辛伐他汀的PCL-Gt/PCL膜,所有膜于常温下避光保存。
使用场发射扫描电子显微镜观察PCL-Gt/PCL-辛伐他汀膜的Gt/PCL-辛伐他汀面及PCL面的表面结构,并测量两个面的平均孔径大小(样本量100)。
1.2.2 辛伐他汀缓释检测 将PCL-Gt/PCL-辛伐他汀膜(10 mm× 10 mm)置入离心管中,在37 ℃环境下用1 mL磷酸盐缓冲液(PBS)浸泡。每日收集200 μL上清液置于-20 ℃冰箱中保存,并加入200 μL新鲜PBS,持续28 d。使用高效液相色谱仪测定上清液中辛伐他汀的浓度,绘制累积释放曲线。
1.2.3 骨缺损模型建立 4%戊巴比妥钠1 mL/kg兔耳缘静脉注射麻醉。麻醉成功后,颅顶备皮消毒,无菌条件下切开颅骨外侧皮肤,暴露颅骨面,于头部正中额顶交界正中线一侧,用牙科低速球钻,0.9%生理盐水充分冷却下制备直径15 mm洞穿性全厚圆形骨缺损(图1B),置入相应膜。阴性对照组及实验组Gt/PCL面对准缺损区,空白组彻底去除骨膜。软组织复位,可吸收线分层严密缝合。

A:屏障膜大小为20 mm×20 mm;B:于兔颅骨正中制备15 mm圆形缺损
1.2.4 样本获取及Micro-CT检测 手术后4周及12周处死实验动物获取样本,4%多聚甲醛固定24 h后进行Micro-CT扫描,观察缺损区新生骨情况,检测骨体积/组织总体积百分比(BV/TV)、新生骨体积(new bone volume)。
1.2.5 HE染色 样本固定结束后,浸入0.5 mol/L的EDTA溶液中室温脱钙4周。经乙醇梯度脱水后,石蜡包埋,组织切片厚度为4 μm,苏木精-伊红染色,光镜下观察缺损区内新骨形成情况。
1.2.6 统计学方法 采用SPSS 10.0统计软件进行统计学分析,所得数据以均数±标准差表示,各组间比较采用t检验,P<0.05为有统计学意义。
2 结 果
2.1 PCL-Gt/PCL-辛伐他汀膜表面结构
通过同轴静电纺丝技术制备的PCL-Gt/PCL-辛伐他汀膜具有光滑的纳米纤维(图2)。Gt/PCL-辛伐他汀面为疏松层,交错纤维所形成的空隙平均最大直径为(31.71±4.23)μm;PCL面为致密层,空隙间平均最大直径为(14.05±3.41)μm。

图2 PCL-Gt/PCL-辛伐他汀膜电镜图Fig.2 Electron microscopic view of PCL-GT/PCL-simvastatin membrane
2.2 辛伐他汀缓释曲线
PCL-Gt/PCL-辛伐他汀膜中辛伐他汀的累积释放曲线如图3所示。在前15 d,辛伐他汀的释放量与时间呈线性关系,25 d后释放稍趋于平缓,至28 d时仍有辛伐他汀释放至PBS溶液中。
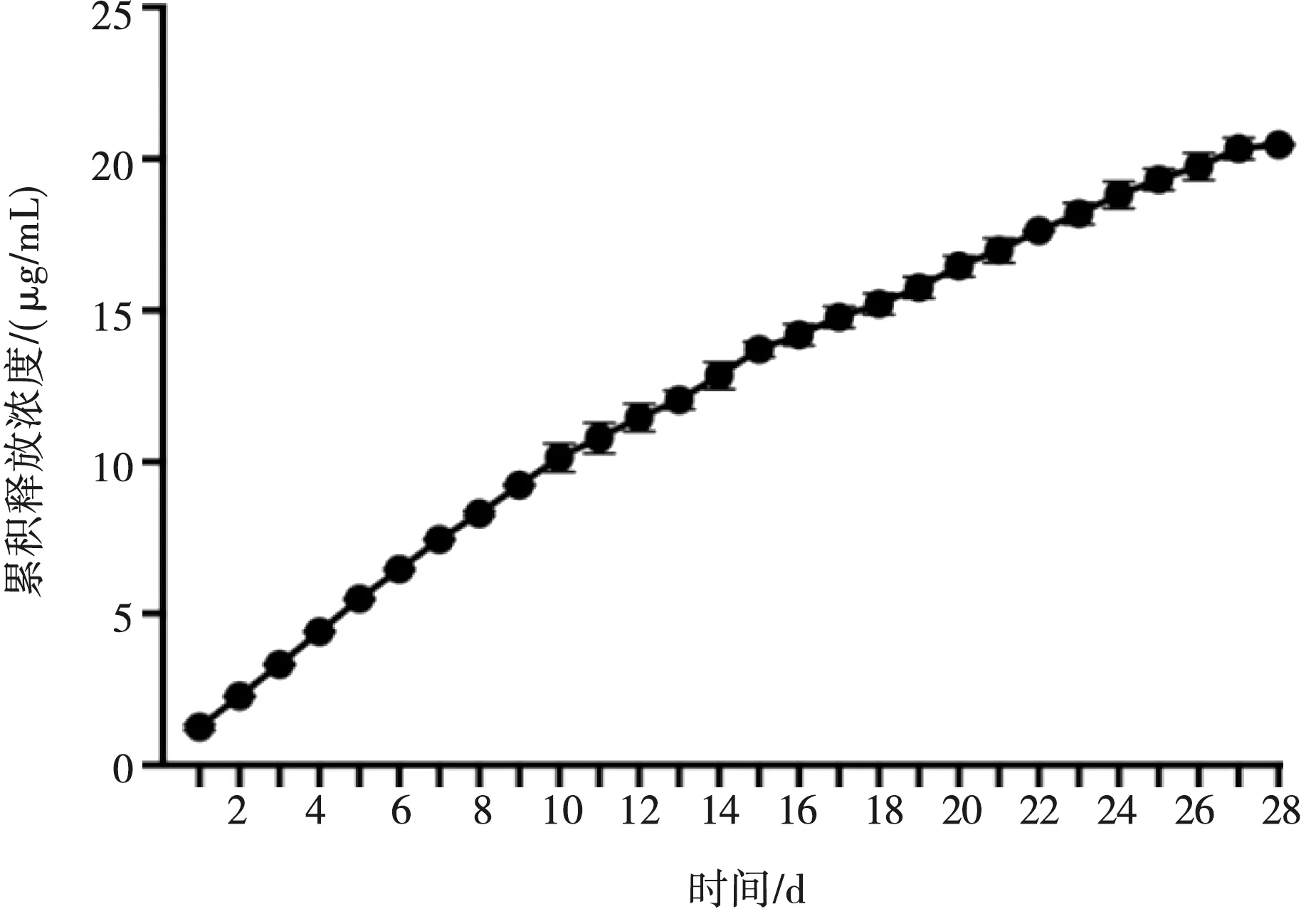
图3 辛伐他汀缓释曲线图Fig.3 Simvastatin sustained release curve
2.3 Micro-CT检测
在术后4周及12周,处死对应组别实验动物并获取样本(图4)。所获样本进行Micro-CT扫描,观察骨缺损区域新骨形成情况(图5A)。在4周时,三组在骨缺损边缘均可见少量新生骨组织,在12周时新生骨组织均较4周时增加,PCL-Gt/PCL组-辛伐他汀组术区骨缺损已基本愈合,仅余少量缺损区,显著优于空白组及PCL-Gt/PCL组。组间t检验统计分析结果提示,在4周及12周,无论是新生骨体积及相对骨体积,PCL-Gt/PCL组-辛伐他汀组均显著高于空白组及PCL-Gt/PCL组。
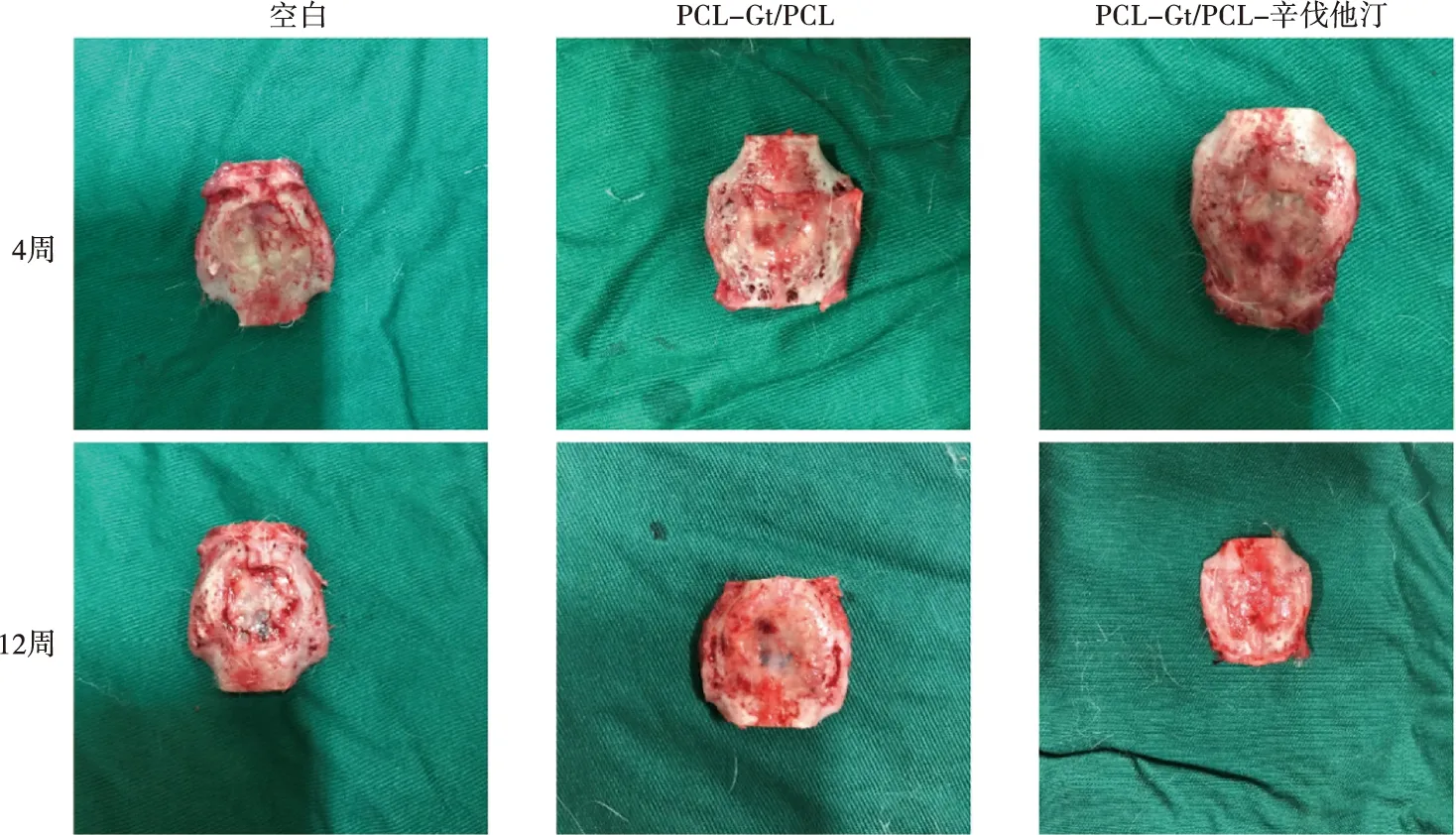
图4 样本大体照片Fig.4 General picture of sample
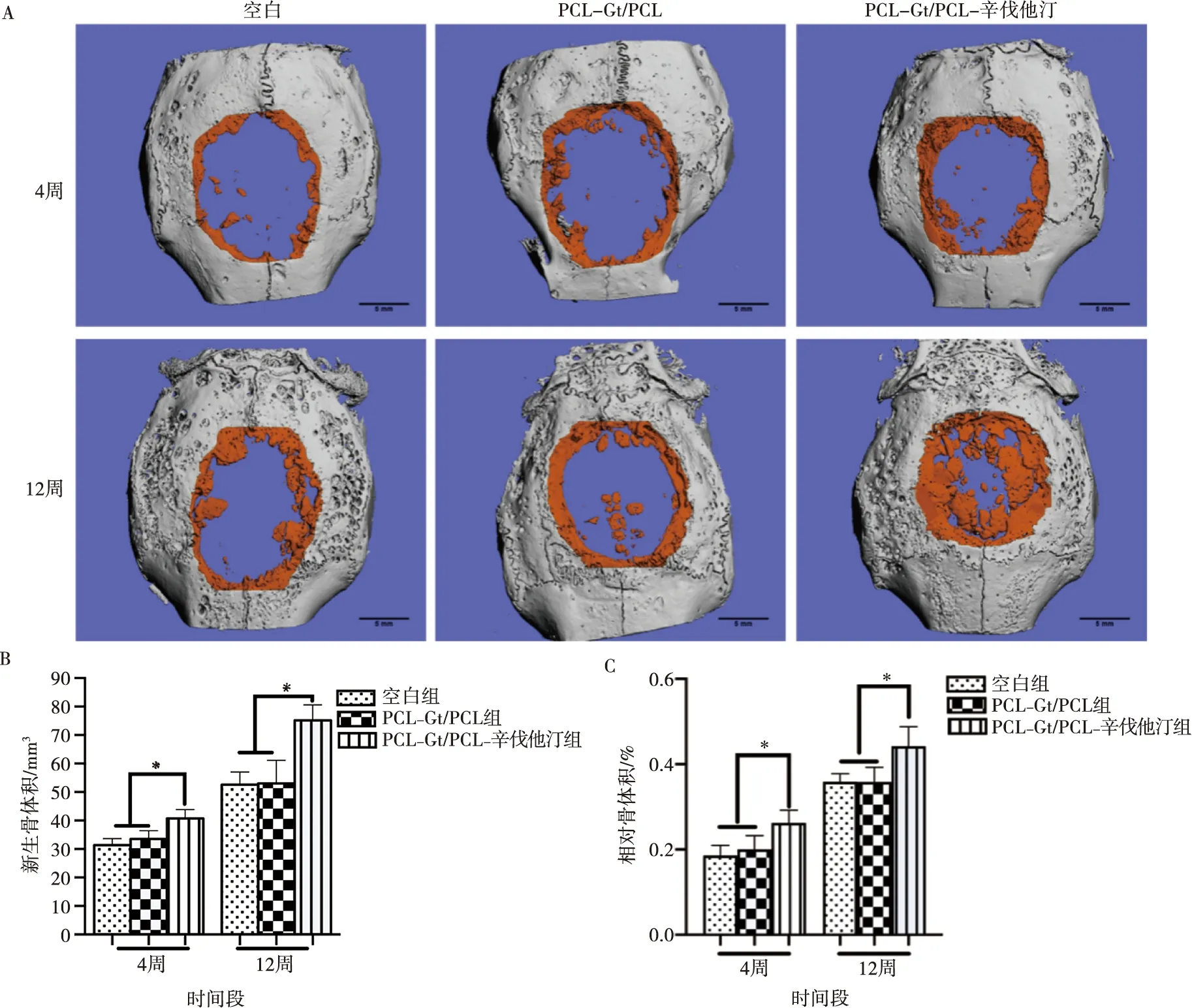
A:空白组、PCL-Gt/PCL组及PCL-Gt/PCL组-辛伐他汀组在4周及12周时骨缺损横截面新生骨形成情况;B:新生骨体积(new bone volume,NBV);C:相对骨体积(bone volume/tissue volume,BV/TV)。*:P<0.05
2.4 组织学特点
在4周及12周时获取标本,进行骨缺损横截面HE染色。结果如图6所示,在骨缺损愈合初期(4周)时,空白组骨缺损边界区仍为大量的纤维结缔组织,未见明显新生骨组织,而PCL-Gt/PCL组及PCL-Gt/PCL组-辛伐他汀组均可见新生骨岛形成,且可见轻微免疫炎症反应。12周时,三组的纤维结缔组织中均可见新生骨形成,未见显著炎症反应,且PCL-Gt/PCL组-辛伐他汀组较其余两组可以观察到更多的新生骨组织。
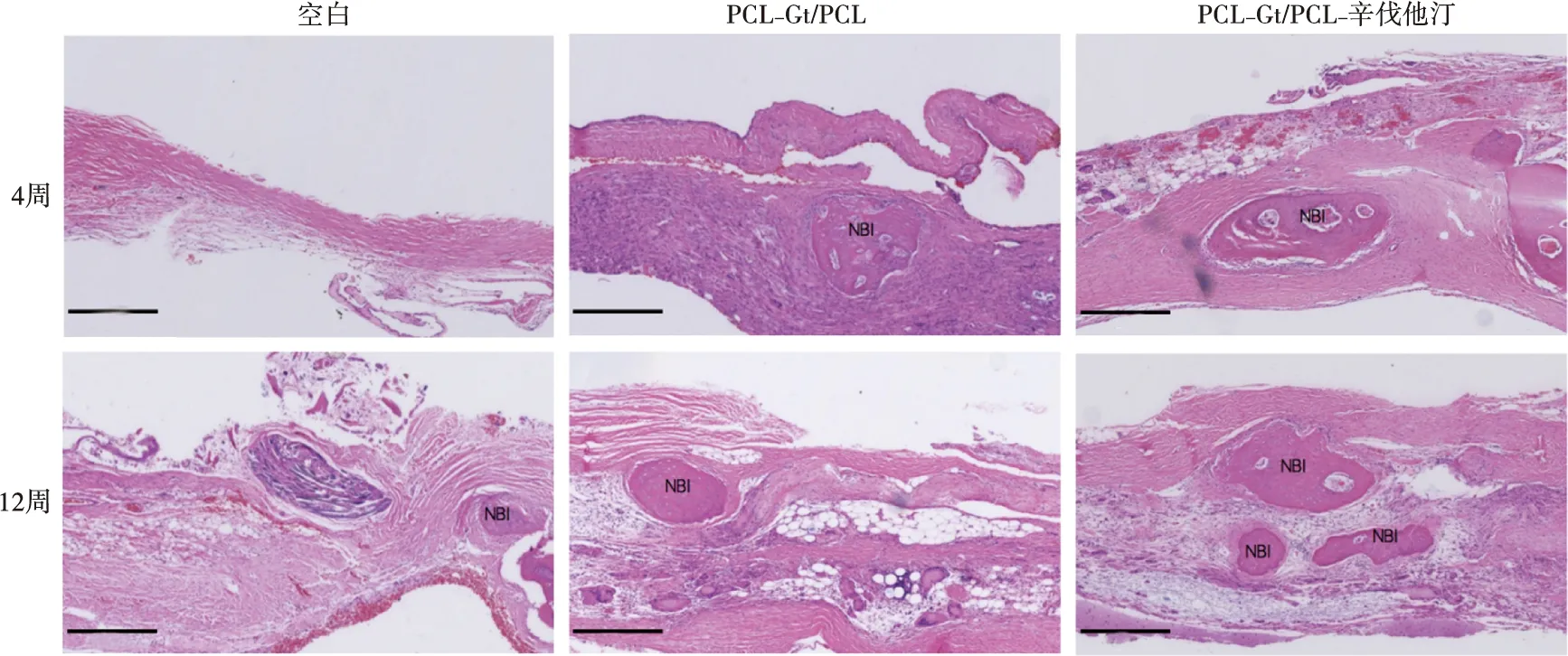
在4周时,PCL-Gt/PCL组及PCL-Gt/PCL组-辛伐他汀组均可见新生骨组织;12周PCL-Gt/PCL组-辛伐他汀组新生骨组织较4周时显著增多,且其成骨效果优于空白组及PCL-Gt/PCL组;NBI(New bone island):新生骨岛;标尺:400 μm
3 讨 论
设计及制备既能够调控细胞功能,又能促进组织再生的生物膜,是骨缺损再生医学的关键,因此大量生物活性材料及药物被用于优化生物膜结构来实现骨再生医学的目标。本研究制备了PCL-Gt/PCL-辛伐他汀膜,代替GBR术中使用的生物膜,结果表明,该膜不仅能防止纤维细胞爬入缺损区,还能稳定释放辛伐他汀,有效促进缺损区域骨再生。
随着生物材料的不断发展,当下对屏障膜的要求已不仅限于屏蔽纤维长入,屏障膜能否为缺损区组织细胞提供合适的生长空间对于骨缺损修复也至关重要。骨缺损区域内的细胞通过跨膜蛋白或整合素相互交流,这些蛋白或整合素作为细胞之间或细胞与细胞外基质之间的连接,允许钙、细胞因子和前列腺素等信使通过。因此屏障膜的孔隙大小不仅影响细胞的生长,也影响细胞间的物质连接与交换,从而影响骨修复过程[12]。本研究所构建的PCL-Gt/PCL-辛伐他汀膜具有三维结构,有利于细胞粘附和迁移的多孔结构。PCL-Gt/PCL-辛伐他汀膜的疏松载药面孔径为(31.71±4.23)μm,能够为骨髓间充质干细胞的附着、增殖和分化提供合适的网络,致密面孔径大小为(14.05±3.41)μm,能够在渗透足够营养进入缺损区的同时阻止纤维细胞移入,从而更好地诱导骨缺损区域组织再生。
单纯的生物膜在常规骨缺损治疗中虽然能够防止纤维长入,加快缺损愈合,在面临骨极限缺损时,它对骨再生的促进作用仍然有限。骨极限缺损的概念最早由Schmitz等[13]提出,指在特定骨组织上造成的无法自行愈合的最小缺损,兔颅骨极限缺损直径为15 mm[14],因此本研究通过体内制备骨极限缺损模型明确机体和PCL-Gt/PCL-辛伐他汀膜之间的相互关系。辛伐他汀主要应用于治疗高脂血症及动脉粥样硬化等疾病。近年来的研究证实辛伐他汀不仅能够促进成骨细胞合成BMP-2,还能够促进骨钙素、骨桥蛋白及Ⅰ型胶原等成骨标志性因子的表达[15]。无论是全身应用或局部应用辛伐他汀[16-18],都具有促进成骨细胞分化及新骨形成的作用。我们的结果证实在骨极限缺损条件下,PCL-Gt/PCL-辛伐他汀膜组在术后4周及12周骨缺损区域可见更多的骨组织,表明该膜能够有效促进缺损区的新骨再生,诱导缺损自然愈合。然而,骨缺损修复不仅需要防止纤维细胞爬入,还需要提供足够的骨修复空间,本实验所使用的PCL-Gt/PCL-辛伐他汀膜不具备支撑作用,用于临床中可能出现凹陷,在未来需继续改进屏障膜特性,从而获得既具有支撑作用又能够诱导骨生成的屏障膜。
在骨缺损修复治疗过程中,不仅应该明确载药生物膜在机体骨愈合过程中的作用,是否能进行可控给药也是非常重要。与生长因子或基因治疗相比,在机体局部应用辛伐他汀具有较低的风险。但有学者研究表明,辛伐他汀快速大量释放,在局部高浓度聚集,有导致炎症反应的风险,并且缓释辛伐他汀更加有利于骨髓间充质干细胞的成骨分化[19-20]。因此,需要一种缓慢释放辛伐他汀的载体,使其在较长时间内发挥作用,同时限制炎症反应的发生。通过静电纺丝技术制备的PCL-Gt/PCL-辛伐他汀膜,能够缓慢释放辛伐他汀。辛伐他汀的累积释放曲线与膜在PBS中的孵育时间呈线性相关,且所释放的辛伐他汀仍具有良好的生物活性,能够在体内长期有效促进新骨形成,表明了PCL-Gt/PCL膜是一种非常稳定的载药控释系统。
综上所述,PCL-Gt/PCL-辛伐他汀膜在体内不仅能够阻止纤维细胞爬入骨缺损区域,还能够缓慢释放辛伐他汀,有效诱导骨愈合过程启动,促进骨缺损区域新骨形成,为骨组织工程领域提供一种有应用前景的新型骨生物材料。
