载体水热处理时间对Co-Pd/TNTs催化CH4-CO2两步梯阶转化合成乙醇和乙酸的影响
2021-01-23陶诗琪
陶诗琪,黄 伟
(太原理工大学 煤化工研究所 煤科学与技术教育部和山西省重点实验室,山西 太原 030024)
随着原油价格剧烈波动以及储量的不断下降,加之新近发现的储量丰富的页岩气、煤层气、甲烷水合物等,作为清洁化石能源和化工原料的天然气备受关注。 目前,天然气转化工艺已经较为成熟[1,2],天然气转化成合成气后,可以制备成高附加值的化学品,如合成氨和甲醇;也可以制成柴油、煤油等液体燃料。 但是上述过程反应条件严苛,能量消耗巨大。 因此,探明一条甲烷高效转化路径具有很高的经济价值和科学价值。
有效地活化CO2是绿色化学的重要研究课题。降低CO2排放量、将CO2直接转化为燃料或高附加值化学品, 是许多科研团队当下积极探索CO2转化新路径的目标。 然而,CO2分子中的碳原子为+4价,是碳原子的最高价态,C-O键键能为783 kJ/mol, 标准吉布斯自由能(△Gθ)为-394.38 kJ/mol,因此活化CO2非常困难。
为解决温室效应问题,本课题组将储量丰富的CH4资源与温室气体CO2相结合,提出一条CH4与CO2直接合成乙酸的新路径。 乙酸是化工行业的一种重要原料, 将CH4和CO2直接转化为乙酸是一个100%原子经济的反应。 然而,该反应的热力学性质不利(△Gθ298K>0)。 在这一转化路径中,为了绕过直接合成乙酸的热力学限制,关键是要将反应过程拆分成两步[3-12],该转化路线既环保又经济,具有很高的工业应用价值。
针对CH4-CO2两步梯阶转化直接合成乙酸的反应,本课题组前期研究发现,Co-Pd/TiO2是最佳的催化剂,但载体的比表面积较低。 黄颖等[9]研究发现,利用溶胶-凝胶法制备Co-Pd/TiO2催化剂时加入表面活性剂,能够有效地增大催化剂的比表面积,获得较高的乙酸收率, 但其最高比表面积为64.95 m2/g,仍然远低于TiO2纳米管的比表面积。
Kasuga等[13]首次以TiO2纳米颗粒作为前驱体,采用水热法将TiO2纳米粒子与高浓度的NaOH溶液反应,生成了TiO2纳米管,并对其形成机理进行了初步研究。 利用这种简单的技术,可以制备出管径均匀(8~10 nm)、比表面积较高(380~400 m2/g)、长度约为50~200 nm的TiO2纳米管[14,15]。但近年来,关于这种纳米管的晶体结构一直存在争议[16-18],其可能的化学式如下:
(1) 锐钛矿型TiO2
(2) 纤铁矿HxTi2-x/4□x/4O4(x~0.7,□:空穴)
(3) H2Ti3O7/Na2Ti3O7/NaxH2-xTi3O7
(4) H2Ti2O4(OH)2/Na2Ti2O4(OH)2/NaxH2-xTi2O5(H2O)
(5) H2Ti4O9(H2O)
也有研究者认为,形成的Na2Ti2O4(OH)2在pH=1的HCl溶液处理过程中,Na+与H+会发生交换, 转变为H2Ti2O4(OH)2[19],在温度≥400 ℃的空气中脱水后,转变为锐钛矿晶型的TiO2纳米管[20]。 由于水热合成的TiO2纳米管结构稳定性较差, 高温焙烧会破坏其结构,很少被用于催化高温反应。 本课题组提出的CH4-CO2两步梯阶转化只需要在150 ℃反应便可以发生, 因此利用水热法制备的TiO2纳米管作为载体是可行的。
但是影响TiO2纳米管形成的因素有很多,包括:原料,超声波预处理,水热温度,处理时间以及后处理洗涤过程[21]。 这就使得同样由水热法制备的TiO2纳米管其组成和结构存在巨大差异。
因此, 本实验首先采用水热法制备了TiO2纳米管,并确定其晶型;又将不同水热时间制备的TiO2纳米管作为载体,制备了一系列的Co-Pd/TNTs催化剂,并且在自主设计的双管固定床步阶反应器[21]上研究了其催化性能。
1 实验部分
1.1 试剂
P25型二氧化钛:德国德固赛公司,武汉格奥科教仪器有限公司分装;Co(NO3)2·6H2O:AR,上海阿拉丁生化科技股份有限公司;PdCl2:AR, 上海麦克林生化科技有限公司;NaOH、无水乙醇:AR,天津市科密欧化学试剂有限公司;盐酸:36%~38%,太化集团公司化工三厂;CH4、H2、N2、CO2均为99.99%,太原钢铁公司。
1.2 TiO2纳米管的制备
将P25在700 ℃下焙烧1 h后, 取1.0 g白色粉末分散于40 mL、10 mol/L NaOH的水溶液中, 搅拌1 h后,放入水热釜中,在130 ℃下分别水热反应24 h、36 h、48 h、60 h。 取出水热釜迅速冷却至室温后,经离心分离取白色沉淀物, 再用0.1 mol/L的HCl酸洗至pH=1, 之后再用蒸馏水洗至中性。 在80 ℃下干燥, 得到钛酸纳米管。 在空气气氛下400 ℃焙烧10 h,得到TiO2纳米管。
1.3 催化剂的制备
Co-Pd/TNTs催化剂采用等体积分步浸渍法制备。称取不同水热时间所制备的TiO2纳米管,分别浸渍于一定量的Co(NO3)2·6H2O的水溶液中,超声1 h后,充分浸渍搅拌12 h,110 ℃下干燥2 h,然后在空气气氛下400 ℃焙烧2 h(升温速率为2 ℃/min)得到Co/TNTs固体。 将制备好的Co/TNTs磨成粉后,浸渍到PdCl2的溶液中,超声1 h后,浸渍搅拌12 h,而后在110 ℃的烘箱中干燥2 h, 在空气气氛下400 ℃焙烧2 h得到Co-Pd/TNTs催化剂, 其中Co的质量分数为7%,Pd的质量分数为3.5%。 造粒并取40~60目备用。将TiO2纳米管水热时间为24 h、36 h、48 h、60 h所制备的催化剂分别记作CAT1、CAT2、CAT3、CAT4。
1.4 催化剂的活性评价
催化剂评价装置采用课题组自主研发设计的双管固定床步阶反应器[22]。 反应器由内径6 mm的两个反应管组成,首先在两个反应管中分别装填0.5 g催化剂,反应前先通入体积分数30%H2-70%N2混合气体对催化剂进行程序升温还原, 以2 ℃/min的升温速率升至400 ℃,保持400 ℃还原2 h后,再通入N2吹扫,待反应管温度降温至150 ℃后,通入原料气进行反应。 原料气CH4和CO2减压后经质量流量计分别进入预热器与一定量的H2和H2O(g)混合。
首先经过预热的CH4、H2和H2O(g)混合气进入A反应器,第一步反应经过200 s后,电磁阀换向,混合气体进入B反应器,与此同时,经过预热的CO2、H2和H2O(g)混合气进入A反应器,与第一步反应生成的CHx进行插入反应,即生成目标产物乙酸。 当第二步反应经过200 s后, 电磁阀再次换向,CH4、H2和H2O(g)混合气又一次进入A反应器,同时CO2、H2和H2O(g)混合气进入B反应器, 与B反应器中的CHx进行插入反应,如此往复循环[22]。 得到的产物经冷凝收集后,采用手动液相进样,使用上海海欣GC-950气相色谱仪的氢焰检测器进行检测分析。
1.5 催化剂表征
样品的形貌通过采用JEM-2100F型透射电子显微镜获得,加速电压为200 kV。
样品的XRD表征在Rigaku D/max-2500型X-射线衍射仪上进行。Ni滤片,Cu Kα辐射,管电压40 kV,电流30 mA。 采用连续扫描法, 扫描范围2θ=10°~80°,扫描速度8 (°)/min。
样品的NH3-TPD-MS表征采用天津先权应用技术研究所生产的TP-5000吸附仪进行。 催化剂用量为100 mg。首先,通入H2/N2混合气,在400 ℃下还原30 min后,切换为He吹扫,降温至50 ℃后再切换为NH3, 恒温脉冲吸附30 min至饱和, 最后通入He吹扫,除去物理吸附的NH3,待基线稳定后,以10 ℃/min的升温速率,程序升温至700 ℃进行NH3脱附,并使用TCD检测记录脱附曲线。
样品的比表面积和孔径分布采用美国生产的Quantachrome SI系列吸附仪,进行N2吸附测定,吸附温度为-196 ℃。 测试前首先将样品在200 ℃下真空脱气预处理3 h。 比表面积采用BET方程计算,孔径分布利用BJH法计算。
2 结果与讨论
2.1 钛酸纳米管和TiO2纳米管的表征
2.1.1 钛酸纳米管和TiO2纳米管的形貌

图1 钛酸纳米管(a)和TiO2纳米管(b)的TEM图Fig. 1 TEM images of Titanate nanotubes (a) and TiO2 nanotubes (b)
图1(a)为水热时间24 h的钛酸纳米管TEM图,管长大约在31~462 nm之间,150 nm左右的居多;图1(b)为TiO2纳米管的TEM图, 管长大约在21~371 nm之间,100 nm左右的居多, 并且可以观察到纳米管的分散性变差。 钛酸纳米管在400 ℃焙烧10 h之后变为了短管的TiO2纳米管,大约减少了50 nm,但焙烧前后都保持了较好的管状结构。
2.1.2 焙烧前后TiO2纳米管的XRD谱图

图2 钛酸纳米管和TiO2纳米管的XRD谱图Fig.2 XRD spectra of Titanate nanotubes and TiO2 nanotube
图2是钛酸纳米管和TiO2纳米管的XRD谱图。从图中可以清楚看到水热合成得到的钛酸纳米管结晶度不高,组成较为复杂,经400 ℃焙烧处理后,随着钛酸纳米管逐步脱水, 样品结晶度明显提高,有五个明显的衍射峰出现在25.3°、37.5°、47.6°、55.1°和63.1°的位置,该特征衍射峰属于锐钛矿晶型。 说明经过400 ℃焙烧10 h后, 可以得到纯的锐钛矿型的TiO2纳米管。
表1为不同水热时间制备的TiO2纳米管作载体所制得催化剂的产物时空收率。从表中可以看出,随着水热时间的不断增加, 乙酸的时空收率呈逐渐减小的趋势,CAT1所生成的乙酸时空收率最高,CAT3生成的乙醇时空收率最高;四个催化剂中,CAT3催化剂的总时空收率最高,达到了8.78 mg/(gcat·h)。 以上结果表明, 采用不同水热时间制备的TiO2纳米管作载体时,对催化剂的催化活性有显著影响。
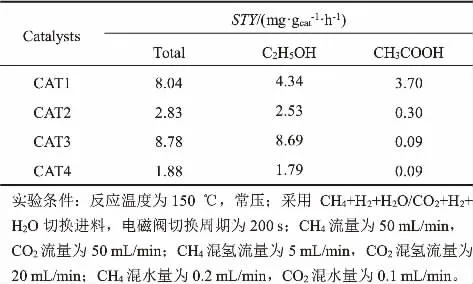
表1 催化反应产物时空收率Table 1 Formation rate of products over different catalysts
2.2 活性评价结果
图3为催化反应产物选择性分布图, 从图中可以看出,当TiO2为载体时,催化剂对乙醇的选择性较高,水热时间为48 h乙醇的选择性最高,达到98.9%,表明适当延长TiO2纳米管的水热时间对乙醇的生成有促进作用。
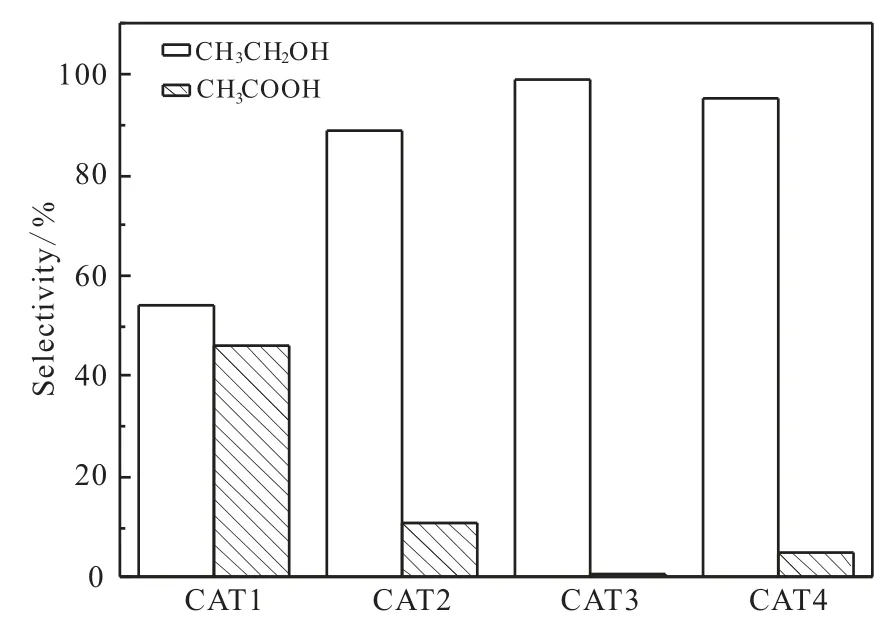
图3 催化反应产物选择性分布图Fig. 3 Distribution of products over different catalysts
2.3 催化剂XRD表征
图4为催化剂反应前后的XRD谱图。 从反应前的XRD图可以看出,四个催化剂有五个相同的特征衍射峰,分别出现在25.3°、37.5°、47.6°、55.1°和63.1°的位置,与上述TiO2纳米管的特征衍射峰相同,都属于锐钛矿晶型的衍射峰。 通过对比发现,CAT2、CAT4的锐钛矿型衍射峰较为尖锐,说明载体水热时间不同会引起催化剂的锐钛矿晶型有所转变;在四个催化剂中,只有在CAT3催化剂上观察到PdO的衍射峰,其他三个催化剂上都没有观察到与钯和钴相关的衍射峰出现, 说明活性组分在TiO2纳米管上均匀分散。 然而CAT3是时空收率最高的催化剂,因此活性组分的分散性,不是获得高收率的关键因素。

图4 催化剂反应前后的XRD 谱图Fig. 4 XRD patterns of different catalysts before and after reaction
从催化剂反应后的XRD图中可以看到,各催化剂的衍射峰均归属为锐钛矿晶型,与反应前的催化剂进行对比,可以发现载体经过反应后,仍然保持了锐钛矿晶型,并没有向其他晶型转变。 所有催化剂中都没有观察到与钯和钴相关的衍射峰, 并且CAT3催化剂在反应前出现的PdO物种也随之消失,推测是由于活性组分在反应过程中发生流失,导致钯和钴物种的含量降低,使得仪器无法检测出相关的衍射峰。 因此,根据以上XRD谱图分析,推测催化剂的失活与活性组分大量流失有关。
2.4 催化剂NH3-TPD-MS表征
催化剂的表面酸性主要取决于其载体的性质[23]。钛酸纳米管中存在着线性的Ti-OH和桥接的Ti-OHTi,在400 ℃下焙烧时,钛酸纳米管表面的-OH基团会丢失,导致其表面酸量浓度较低[24]。本实验发现制备TiO2纳米管的水热时间也会影响其酸性。
图5为催化剂反应前的NH3-TPD-MS谱图。从图5可以看出,CAT1催化剂分别在170 ℃和281 ℃附近有两个脱附峰,对应一个弱酸中心和一个中强酸中心;CAT2催化剂分别在170 ℃和281 ℃附近出现两个脱附峰,与CAT1脱附峰相同,对应一个弱酸中心和一个中强酸中心;CAT3催化剂有三个脱附峰,出峰位置在186 ℃、247 ℃和440 ℃, 分别对应一个弱酸位、 一个中强酸位和一个强酸位;CAT4催化剂在188 ℃和269 ℃附近有两个脱附峰, 分别对应一个弱酸中心和一个中强酸中心。
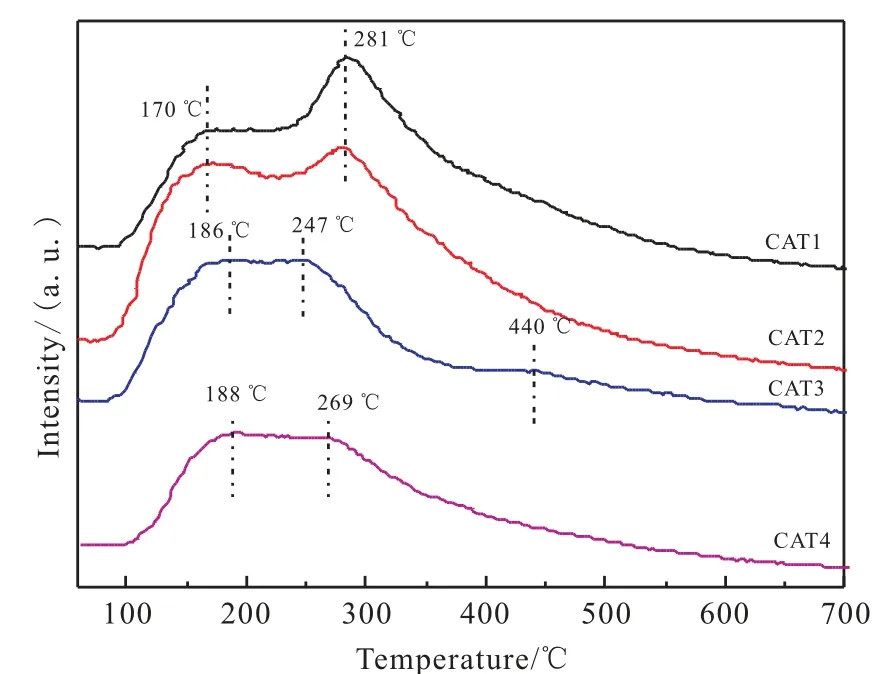
图5 催化剂反应前的NH3-TPD-MS 谱图Fig. 5 NH3-TPD-MS profiles of different catalysts before reaction
对比四个催化剂的NH3-TPD-MS谱图可以发现,CAT2的中强酸量最高,但乙酸的时空收率并不是最高的; 在四个催化剂中CAT1与CAT2的中强酸量较高, 结合活性评价数据CAT1与CAT2生成的乙酸量也相对较高,而CAT3与CAT4催化剂中强酸量相近,且均较低,乙酸的时空收率也较低。
从上述NH3-TPD-MS表征分析结果可以发现,催化剂的中强酸量对乙酸的生成有促进作用。
2.5 催化剂N2-吸附表征
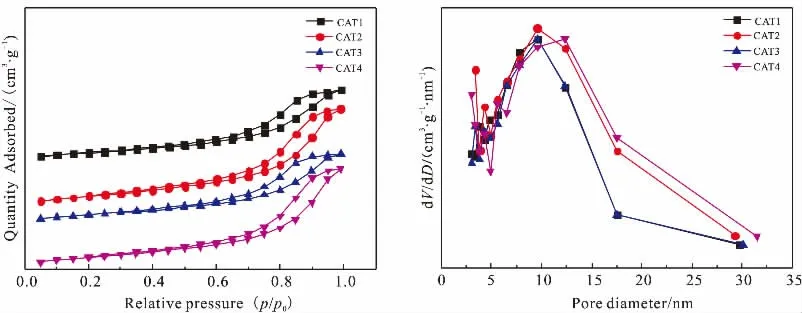
图6 催化剂N2吸附-脱附等温线及BJH孔径分布图Fig. 6 N2 adsorption-desorption isotherms and pore size distributions of catalysts
图6为催化剂的N2吸附-脱附等温线及BJH 孔径分布图。从图6可以观察到,四个催化剂的吸附-脱附等温线属于IV型,表明存在介孔结构。 从催化剂的孔径分布图可以发现,所有催化剂的孔径范围分布较广, 说明所制备的催化剂管径大小不均一,在5~31 nm之间都有分布;CAT1与CAT3的孔径分布图基本重合,结合活性评价结果发现两个催化剂的时空收率较高, 说明该孔道类型有利于促进该反应进行;CAT1、CAT2和CAT3, 最可几孔径基本重合,在9.57 nm附近。 而CAT4的最可几孔径在12.36 nm,说明延长水热时间,可以获得管状产品,而水热时间较短时,获得的是细管状产品,这与之前的相关研究一致[25]。
表2为各催化剂反应前后织构参数。 从表中可以看出,当载体的水热时间为36 h时,所制备的催化剂CAT2的比表面积最大。 因此,催化剂的比表面积与水热时间的增加不是线性关系。 比表面积相对较大的CAT2和CAT4的时空收率较低, 说明过大的比表面积不利于催化该反应。
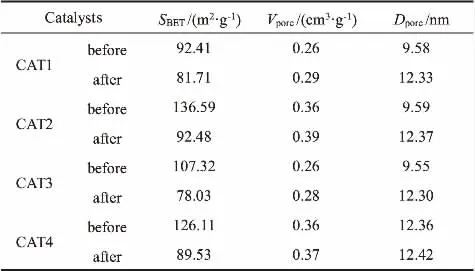
表2 催化剂反应前后的织构参数Table 2 Textural properties of different catalysts before and after reaction
水热法制备的TiO2纳米管是一种多层卷曲而成的管状结构,在一定的水热时间范围内,比表面积和管长都会随水热时间的延长而增加[25]。因此,可以推断出过大的比表面积不利于催化该反应的根本原因是过长的TiO2纳米管不利于气体的流动。
章日光等[4]采用量子化学密度泛函理论证明,在适合的双金属催化剂上, 在等温条件下CH4-CO2两步反应直接合成乙酸为热力学允许的过程,并且能实现高效转化。 其反应过程为:第一步,CH4吸附在金属Co表面生成表面碳物种, 然后溢流到金属Pd 表面形成新的表面碳物种; 第二步,CO2插入新的表面碳物种生成乙酸,其中CHx可以有效地在Co、Pd双金属之间转移决定了乙酸的产量。
TiO2纳米管作为一种多层卷曲而成的管状结构,当负载活性组分时,Co、Pd双金属在管内和管外都有分布,当该催化剂进行催化反应时,CHx在比表面积较高、 管长较长的TiO2纳米管中扩散困难,在Co、Pd双金属之间不能迅速地转移。 因此,比表面积较低的催化剂时空收率较高。
从CAT2的活性评价数据可以看出, 即使CAT2有较高的中强酸量,乙酸选择性也较低,这是由于管状结构使乙酸分子扩散到体相较困难,因而被H2还原的几率增加,易形成乙醇。这一结果解释了TiO2纳米管作为载体时乙醇选择性整体较高的现象。
综上所述, 在CH4-CO2两步梯阶转化合成乙醇和乙酸的反应中,催化剂的中强酸量和比表面积的协同作用是影响催化活性的关键因素[12],这与之前的研究结果一致。
3 结论
(1)使用水热时间为48 h的TiO2纳米管作为载体所制备的Co-Pd/TNTs催化剂在CH4-CO2两步梯阶转化过程中可以得到高选择性的乙醇, 在常压、150 ℃反应条件下,总时空收率最高为8.78 mg/(gcat·h),催化剂对乙醇的选择性高达98.9%。
(2)影响催化活性的关键因素是催化剂的比表面积和中强酸量的协同作用。 较小比表面积有利于提高总的时空收率, 其一是由于过长的TiO2纳米管不利于气体的流动,其二是由于CHx在Co、Pd双金属之间不能迅速地转移。
(3)产物的选择性也是由催化剂的中强酸量和比表面积共同作用的,中强酸量高有利于乙酸的生成。比表面积较高、管长较长的TiO2纳米管作为载体时,可以提高乙醇的选择性。
综上所述,TiO2纳米管是一种可以催化CH4-CO2两步梯阶转化促进乙醇生成的催化剂的优良载体。
