利拉鲁肽和甘精胰岛素对男性2型糖尿病患者骨代谢的影响
2021-01-22杨迪赵瑜冯法博沈洁朱丹杰李晓林
杨迪 赵瑜 冯法博 沈洁 朱丹杰 李晓林
糖尿病(diabetes mellitus,DM)[1]及肥胖[2-3]均可诱导晚期糖基化终末产物(advanced glycation end products,AGEs)堆积,进而促进成骨细胞凋亡[4]、骨骼生物力学改变[5],并增加骨折风险[6]。新型降糖药物胰高血糖素样肽-1受体(glucagon like peptide-1 receptor,GLP-1R)激动剂具有降糖、抑制食欲、延缓胃排空、减重、改善心血管代谢功能等多项功能[7-9],目前广泛应用于临床。近期研究亦发现骨组织中存在GLP-1R,因此GLP-1R激动剂与骨代谢的关系越来越受到关注[4]。利拉鲁肽(liraglutide,LIR)是GLP-1R激动剂中的一种,其和甘精胰岛素(insulin glargine,GLA)作为注射类降糖药物目前均广泛应用于临床,本研究旨在探讨LIR和GLA对男性2型糖尿病(type 2 diabetes mellitus,T2DM)患者骨代谢的影响,并通过观察患者血糖、BMI、骨转换指标、骨密度(bone mineral density,BMD)的变化趋势探讨LIR是否具有骨保护作用,为口服降糖药物治疗不达标的T2DM患者选择更为合理的降糖方案提供理论依据。
1 对象和方法
1.1 对象 选取2018年1至6月浙江省人民医院收治的男性T2DM患者99例,采用随机数字表法分为LIR治疗组(LIR组)、GLA治疗组(GLA组)和口服降糖药物治疗组(OAD组),每组 33例,随访 48周。纳入标准:(1)年龄30~50 岁男性;(2)DM 病程≤5 年;(3)BMI:20~27 kg/m2;(4)BMD Z 值>-2.0 SD;(5) 既往磺脲类促泌剂(SU)、α-糖苷酶抑制剂(AGI)单用或联用的T2DM患者,治疗前7.0 mmol/L<FPG<15.0 mmol/L,并且7%<糖化血红蛋白(HbA1C)<10%,空腹胰岛素水平>17.8 pmol/L,体重在筛选前至少3个月稳定,波动<10%。排除标准:(1)使用维生素D、钙片、激素、阿仑膦酸钠、唑来膦酸等影响骨代谢药物;(2)入组前半年使用罗格列酮、二甲双胍、二肽基肽酶-4抑制剂、钠-葡萄糖协同转运蛋白-2抑制剂、胰岛素或GLP-1受体激动剂患者;(3)既往有脆性骨折史;(4)DM合并急性并发症、3种及以上慢性并发症;(5)嗜酒或吸烟量>10 支/d;(6)合并严重消化道疾病和肝功能不全(ALT及AST≥3倍正常参考值),肾功能减退(肌酐≥1.5 mg/dl);(7)Z 值≤-2.0 SD;(8)影响骨代谢的疾病如慢性肾功能不全、风湿及类风湿性关节炎、甲状腺功能亢进症、甲状旁腺功能亢进症和各种癌症等继发性骨质疏松。随访过程中有9例患者脱落(LIR、GLA、OAD组各3例),其中因血糖控制不佳6例,胃肠道反应1例,维持剂量仍出现低血糖1例,失访1例。LIR组、GLA组、OAD组各30例患者完成48周随访。其中 LIR 组患者年龄30.9~49.1(39.88±5.77)岁,DM 病程 1.4~4.9(3.16±1.10)年;LIR 组原始方案中 18 例采用SU联合AGI,10例单用AGI,2例单用SU;GLA组年龄 31.2~48.7(40.33±5.90)岁,DM 病程 0.7~5.0(3.19±1.23)年;GLA组原始方案中21例采用SU联合AGI,9例单用 AGI;OAD 组年龄 31.2~48.2(39.84±5.40)岁,DM病程 1.1~4.9(3.10±1.08)年;OAD 组原始方案中 12 例采用SU联合AGI,10例单用AGI,8例单用SU。3组患者年龄和DM病程比较差异均无统计学意义(均P>0.05)。本研究经浙江省人民医院医学伦理委员会批准,所有患者均知情同意。
1.2 方法
1.2.1 用药方法 LIR组患者在原治疗方案上加用LIR,LIR初始剂量0.6 mg/d;GLA组在原治疗方案上加用GLA,GLA初始剂量0.2 U/(kg·d);OAD组选择SU格列吡嗪控释片及AGI阿卡波糖联用,格列吡嗪控释片初始剂量5 mg/d,阿卡波糖初始剂量50 mg/d;若半月内FPG及餐后2 h血糖(2 h postprandial plasma glucose,2h-PBG)控制不如预期,LIR组可考虑将LIR剂量加至1.2 mg/d;GLA组可调整GLA剂量(FPG<4.4 mmol/L,-2 U;4.4 mol/L≤FPG≤7.0 mmol/L,不调整;7.0 mol/L<FPG≤7.8 mmol/L,+2 U;7.8 mol/L<FPG≤10.0 mmol/L,+4 U;FPG>10.0 mmol/L,+6 U);OAD 组先行调整阿卡波糖剂量后再调整格列吡嗪控释片剂量;LIR最大剂量1.8 mg/d,GLA无最大剂量,OAD最大剂量格列吡嗪控释片10 mg/d,阿卡波糖300 mg/d。若LIR组出现低血糖,先行减量格列吡嗪控释片或阿卡波糖,后减量LIR;若GLA组出现低血糖,先行减量GLA,后减量格列吡嗪控释片或阿卡波糖;若OAD组出现低血糖,先行减量格列吡嗪控释片或阿卡波糖。达标标准:3个月内使患者FPG≤7.0 mmol/L,2h-PBG≤10.0 mmol/L,6个月内HbA1C<7.0%。退出标准:(1)3个月,LIR 加至最大剂量,GLA使用剂量>1 U/(kg·d),OAD加至最大剂量血糖仍不达标(FPG>7.0 mmol/L,2h-PBG>10 mmol/L),退出该研究。(2)若LIR、GLA和OAD最小维持剂量(LIR 0.6 mg/d、GLA 4 U/d、OAD最低剂量格列吡嗪控释片5 mg/d或阿卡波糖50 mg/d)仍出现低血糖(血糖≤3.9 mmol/L)则退出该研究。
1.2.2 观察指标 记录年龄、DM病程,测量身高、体重并计算BMI。观察3组患者不良反应情况。所有研究对象分别于治疗的 0、24、48周禁食8 h后于次日清晨采集肘静脉血,分离血清,置于-20℃冰箱储存。采用贝克曼己糖激酶法检测FPG及2h-PBG、利德曼直接法检测LDL-C及TG、采用高效液相层析法检测HbA1C,采用罗氏电化学发光法检测骨转换指标:骨钙素(OC)、Ⅰ型前胶原氨基端原肽(P1NP)、Ⅰ型胶原羧基端肽β特殊序列(β-CTX)、25羟-维生素D3(25-OH-D3),采用美国GE Lunar公司的Prodigy双能X线骨密度仪测定治疗0、48周的腰椎、股骨颈和髋关节BMD。
1.3 统计学处理 采用SPSS 20.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;组内治疗前后比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组患者治疗前后一般生化指标比较 3组患者治疗前 FPG、2h-PBG、HbA1C、BMI、TG、LDL-C 比较差异均无统计学意义(均P>0.05)。3组患者治疗24、48周 FPG、2h-PBG、HbA1C、TG 均较治疗前显著下降(均 P<0.01)。3 组患者治疗 24 周 2h-PBG、HbA1C、BMI、LDL-C比较差异均有统计学意义(均P<0.05),而FPG、TG比较差异均无统计学意义(均P>0.05)。3组患者治疗48周2h-PBG、BMI、LDL-C比较差异均有统计学意义(均 P<0.05),而 FPG、HbA1C、TG 比较差异均无统计学意义(均P>0.05)。LIR组治疗48周后LDLC与治疗24周比较差异有统计学意义(P<0.05)。治疗24周及 48周 LIR组 BMI、2h-PBG、LDL-C均低于GLA组及OAD组,差异均有统计学意义(均P<0.05)。见表1。
2.2 3组患者治疗前后骨转换指标比较 3组患者治疗前、治疗 24 周 OC、P1NP、β-CTX、25-OH-D3比较差异均无统计学意义(均P>0.05)。3组患者治疗48周OC、25-OH-D3比较差异均有统计学意义(均P<0.05)。LIR组治疗48周OC较治疗前升高(P<0.01),治疗24、48周25-OH-D3均较治疗前升高,差异均有统计学意义(均P<0.05);治疗48周OAD组OC较治疗前下降,差异有统计学意义(P<0.01)。与治疗24周比较,LIR组治疗48周25-OH-D3明显升高,差异有统计学意义(P<0.05)。治疗48周,与GLA组、OAD组相比,LIR组OC、25-OH-D3均升高,差异均有统计学意义(均P<0.05)。见表 2。
2.3 3组患者不良反应情况 LIR组23例(76.7%)患者出现了胃肠道反应,大多数反应轻微,主要出现在用药的前4周,其中1例因出现难以遏制的恶心、呕吐而退出研究;OAD组12例(40%)患者出现胃肠道反应。对此LIR组5例减少了LIR的剂量,OAD组1例减少了阿卡波糖的剂量。GLA组1例患者因发生低血糖事件(随机血糖<3.9 mmol/L),逐步减少GLA剂量后停用GLA并退出研究。总体而言,整个研究过程中3组患者依从性较高。
2.4 3组患者治疗前后BMD比较 3组患者治疗前后腰椎、股骨颈和髋关节BMD比较差异均无统计学意义(均P>0.05)。见表3。

表1 3组患者治疗前后一般生化指标比较
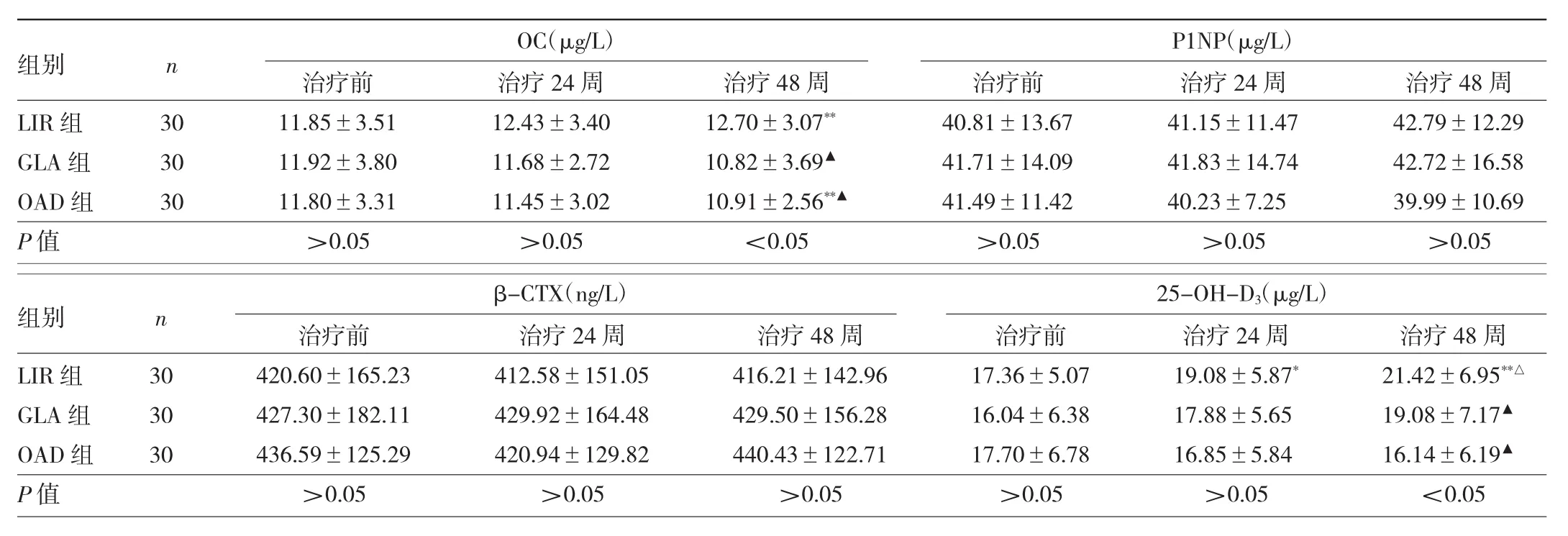
表2 3组患者治疗前后骨转换指标比较
3 讨论
DM是一种以高血糖为特征的复杂代谢性疾病,高血糖导致的骨强度下降、骨骼成分变化及异常骨矿化均会引起DM患者骨折风险增加。针对DM的治疗策略不仅需强效控制血糖,而且还应最大程度预防或延缓骨量丢失及骨微结构的破坏。GLP-1R激动剂是一个兼具胰腺内、外作用的新型降糖药物,不但能迅速、有效降低血糖及HbA1C,而且能较好的控制血压、血脂及体重在内的多种心血管危险因素,并可兼顾降糖与心血管结局获益。近年来研究发现GLP-1R激动剂还参与骨代谢调节,对骨微结构、骨组织形态学均有正面影响,其可通过直接或间接作用促进骨形成、抑制骨吸收,对骨组织具有保护作用。因此GLP-1R激动剂是近年来内分泌领域的研究热点。

表3 3组患者治疗前后腰椎、股骨颈和髋关节BMD比较(g/cm2)
目前GLP-1R激动剂对骨代谢影响的相关研究较少,尚无统一结论。体外试验发现小鼠骨细胞、成骨细胞、破骨细胞表面均表达GLP-1R[10-12],此外研究者还在骨髓基质干细胞(BMSCs)中检测到了GLP-1R,并证实GLP-1R激动剂Exendin-4(EX-4)可通过激活GLP-1R调控 PKA/β-catenin和 PKA/PI3K/AKT/GSK3β信号通路促进BMSCs成骨化,抑制BMSCs成脂化[13],增加大鼠骨质疏松模型中成骨细胞活性,促进骨形成;但在许多其他类型骨细胞如鼠类MC3T3-E1成骨细胞、原代成骨、破骨细胞的研究中未检测到GLP-1R表达,尽管未鉴定出GLP-1R,但使用GLP-1R激动剂可诱导小鼠前成骨样MC3T3-E1细胞增殖及分化[14],推测可能通过未知的糖基化磷脂酰肌醇-偶联受体发挥影响成骨细胞分化及活性的作用;体外研究中发现LIR可抑制PPARγ基因表达、促进成骨细胞特异性转录因子Runx2基因表达,促进大鼠BMSCs成骨化并抑制其成脂化,推测LIR可促进骨形成[15]。这些发现为GLP-1R激动剂治疗骨质疏松症提供了分子基础。动物实验中,去卵巢骨质疏松大鼠使用EX-4治疗后,股骨及椎骨BMD呈剂量依赖性增加[16];另分别使用EX-4及LIR干预去卵巢骨质疏松小鼠,可显著改善其骨小梁数目、连接及结构参数,但对皮质骨无影响[17];亦有研究证实LIR治疗不但可增加去卵巢大鼠的小梁骨体积、厚度和数量,而且可增加皮质骨的厚度和密度,预防骨质疏松发生[15]。在DM动物模型中也开展了GLP-1R激动剂对骨代谢影响的研究,一项对链脲佐菌素(STZ)诱导T1DM小鼠的研究发现,短期GLP-1R激动剂治疗虽对骨强度、皮质骨微结构无显著影响,但能显著改善骨组织力学性能[18];另一项对STZ诱导T2DM大鼠的研究发现,GLP-1R激动剂可通过减少骨吸收、促进骨形成来改善股骨及腰椎骨微结构[19];在对去卵巢DM大鼠的研究中发现,LIR可通过激活Wnt信号通路促进去卵巢DM大鼠成骨细胞的分化、骨基质的形成及矿化进而发挥骨保护作用[20]。综上所述,体外研究及动物实验均提示GLP-1R激动剂具有保护骨代谢的潜能。
临床研究中关于GLP-1R激动剂对骨代谢的影响存在争议。在一项开放性、随机、对照试验中[21],将围绝经期非DM女性分别纳入LIR组(1.2 mg)及安慰剂组,治疗后安慰剂组的骨矿物质含量显著降低,LIR组骨形成标志物P1NP水平增加,骨吸收标志物CTX水平无显著改变,BMD无统计学差异;另一项针对T2DM患者的24周研究结果显示,治疗后未观察到GLP-1R激动剂艾塞那肽对骨转换指标或BMD的影响[22];LIR对糖尿病的疗效与作用研究比较了T2DM患者采用不同剂量LIR(分别为1.2 mg/d及1.8 mg/d)或格列美脲(8 mg/d)干预2年,各组治疗后BMD无统计学差异[23];Harper等[24]在最新发表的荟萃分析中探讨LIR对超重或肥胖患者骨折发生风险及骨转换指标的影响,发现LIR对超重或肥胖患者的BMD无影响,但可增加骨矿物质含量并减少骨折风险;Su等[25]发表的荟萃分析中同样得出LIR治疗显著减少骨折风险的结论,而艾塞那肽治疗后存在增加骨折风险的趋势。总之,上述临床研究提示GLP-1R激动剂具有部分成骨作用,但对骨吸收及BMD无显著影响,且不同类型GLP-1R激动剂骨折风险存在差异。
国内外指南均推荐二甲双胍作为T2DM的一线用药,但体外实验中发现二甲双胍能促进成骨细胞增殖及分化,为避免对研究结果的干扰,故本研究中将二甲双胍使用纳入排除标准。SU及AGI为中国T2DM患者降糖治疗的一线备选用药,但单纯关于SU骨骼安全性方面的研究甚少,多数为混合型研究,并且涉及磺脲类药物对骨转换指标及骨折风险研究结果多数是中性的[26]。AGI在国外应用较少,国内外尚未发现其对骨代谢影响的相关报道。胰岛素具有多种生物学效应,不但能促进机体合成代谢而且可与成骨细胞表面胰岛素受体结合,促进OC合成,减少尿钙排泄,维持骨代谢稳定;临床研究发现胰岛素治疗对骨转换指标无显著影响[27],但部分研究提示其可能增加T2DM患者骨折风险,推断与胰岛素治疗过程中低血糖发作引起的跌倒相关。
尽管在细胞及动物试验中均有证据表明GLP-1R激动剂对骨代谢有积极影响,但临床研究中GLP-1R激动剂对骨代谢影响的相关数据仍较为缺乏,因此,本研究就LIR对男性T2DM患者骨代谢的影响进行研究与探讨。研究结果显示,治疗24及48周LIR组FPG与GLA组及OAD组相比差异均无统计学意义。治疗24及48周LIR组BMI较GLA组及OAD组显著下降,考虑与LIR能调节摄食中枢抑制食欲降低体重相关;治疗24及48周LIR组2h-PBG较GLA组及OAD组均显著下降,考虑与LIR不但能血糖依赖性刺激胰岛素分泌、而且能延缓胃排空以及抑制餐后胰高血糖素不适当分泌相关。本研究中监测骨转换标志物分别为骨形成标志物P1NP、OC和骨吸收标志物β-CTX,另监测25-OHD3水平变化。治疗48周LIR组OC水平较基线及治疗48周GLA组及OAD组均显著升高,推测LIR具有部分促进成骨作用;既往研究表明T2DM患者易发生25-OH-D3水平缺乏[28],血清25-OH-D3分别与TG及LDLC、内脏脂肪水平负相关[29-30],维生素D缺乏不但会加快骨转换、增加骨质疏松风险,而且可减少胰岛素合成及分泌、降低胰岛素敏感性、增加血糖血脂控制达标难度;本研究中3组治疗48周FPG及HbA1C水平无显著差异情况下,LIR组25-OH-D3水平较基线及治疗后GLA组及OAD组显著升高,推测此结果与LIR能更好的降低LDL-C,降低内脏脂肪相关[31]。
BMI是影响BMD的重要因素之一,研究显示BMI与BMD呈正相关,体重对髋部及腰椎BMD均存在保护作用,具体机制考虑为多因素综合作用结果,其中机械负荷因素为最主要的原因之一,BMI数值高的患者承受的负荷更大,骨骼负重可直接转化为机械应力作用于成骨和破骨细胞表面的机械应力感受器,机械应力进而刺激骨形成,抑制骨吸收,从而提高骨强度和骨矿含量,延缓骨质疏松的发生并降低其程度。本研究中治疗后LIR组BMI水平较GLA组及OAD组均显著下降,但腰椎、股骨及髋部BMD较GLA组及OAD组无统计学差异,进一步推断LIR对骨代谢具有积极影响。但该研究LIR 组纳入患者基线 BMI:(24.21±1.81)kg/m2,治疗 48周后BMI下降幅度偏小,在评估LIR对骨代谢影响有一定的局限性。
综上,本研究团队发现GLP-1R激动剂LIR能持续发挥控制血糖并降低体重的临床疗效。GLP-1R激动剂不但可以持久平稳降糖,而且在降低体重、血压、血脂等心血管风险、保护骨代谢方面也发挥着重要作用,是T2DM患者降糖的优先用药选择。但鉴于本试验样本量较少,纳入患者BMI水平较为局限,未来需要进行长期更大样本量的临床研究探讨GLP-1R激动剂对骨代谢的影响。
