抑制miR-93-5p表达对人卵巢癌细胞增殖和迁移的影响
2021-01-22赵灵琴于爱军刘文洪高雯方晨燕张平
赵灵琴 于爱军 刘文洪 高雯 方晨燕 张平
卵巢癌是常见的女性恶性肿瘤之一,其发病率仅次于宫颈癌及子宫内膜癌,位居第3,而其病死率则高居妇科肿瘤之首[1],约有45%~60%的病理确诊的患者最终将死于卵巢癌[2-3]。目前卵巢癌的治疗主要以手术切除为主,术后化疗为辅,从而提高患者的临床缓解率及延长中位生存时间,但由于化疗耐药的存在影响治疗疗效,肿瘤复发和转移也是影响患者预后的关键因素[4-5]。尽管卵巢癌治疗在现代技术的发展中已经取得了诸多成就,但卵巢癌背后的分子机制仍是癌症研究领域的焦点。
miRNA生物学效应广泛,对个体发育、细胞分化、增殖和凋亡等生理活动均起重要调控作用[6]。研究表明,超过50%的编码基因位于与肿瘤相关的基因位点,这说明miRNA可能在肿瘤的发生、发展中扮演重要角色[7]。基因变异导致相关功能因子表达紊乱在卵巢癌的发生、发展中的作用相关研究是目前肿瘤研究热点[8]。有研究指出在肝癌[9]及胃癌[10]中miR-93作为癌基因直接靶向程序性细胞死亡因子4从而促进癌症的形成。然而,miR-93-5p在卵巢癌当中的作用及机制却少有报道。本研究旨在探讨miR-93-5p对卵巢癌细胞增殖和转移的影响,并初步探究可能的下游调控机制。
1 材料和方法
1.1 细胞 正常卵巢上皮细胞(IOSE80)与卵巢癌细胞(SKOV3、A2780、ES2)均购自中国科学院上海细胞库。
1.2 试剂 DMEM/F-12(1∶1)、FBS均购自美国Hyclone公司;青霉素-链霉素购自杭州吉诺生物医药技术有限公司;四甲基亚唑蓝(MTT)、二甲基亚砜(DMSO)均购自美国Sigma公司;RIPA裂解液、BCA蛋白浓度测定试剂盒、荧光素酶报告基因检测试剂盒均购自上海碧云天公司;Trizol、反转录试剂盒Prime Script RT Reagent Kit和SYBR PrimeScript miRNA RT-PCR Kit均购自日本Takara公司;miR-93-5p抑制物(miR-93-5p inhibitor)、空载体阴性对照物、miR-93-5p模拟物(miR-93-5p imimics)、对照物(miR-NC)、转染试剂 Lipofectamine 2000 Transfection均购自山东维真生物科技有限公司;一抗(RBM24、GAPDH)、辣根过氧化物酶标记山羊抗兔二抗均购自美国CST公司;ECL显影液购自美国Bio-Rad公司。
1.3 仪器 3110型二氧化碳培养箱购自美国Thermo公司;Ti-U型荧光倒置显微镜购自日本尼康公司;ME155DU型电子天平购自瑞士梅特勒公司;GT10-2型台式离心机购自北京金洋万达科技有限公司;J-HH-6A型恒温水浴箱购自上海梓桂仪器有限公司;MDFU3386S型超低温冰箱购自日本Sanyo公司;TS-1型转移脱色摇床购自上海亚荣生化仪器厂;1658001型电泳仪购自美国Bio-Rad公司;JS-1070Mini化学发光成像系统购自上海培清科技有限公司;Synergy2型多功能酶标仪购自美国BioTek公司;7500型荧光定量PCR仪购自美国ABI公司。
1.4 细胞培养 正常卵巢上皮细胞(IOSE80)与卵巢癌细胞(SKOV3、A2780、ES2)培养于含 10% FBS、青霉素200 U/ml、链霉素200 U/ml的DMEM完全培养液中,置于37℃、5% CO2培养箱中培养。每2 d换液1次,待细胞达到80%~90%融合度后,经胰蛋白酶消化,按1∶3传代,置于37℃、5% CO2培养箱内继续培养,取对数期细胞用于实验。
1.5 miR-93-5p相对表达量检测 采用qRT-PCR法。使用 Trizol试剂从 IOSE80、SKOV3、A2780、ES2 细胞株中提取总RNA。按照反转录试剂盒Prime Script RT Reagent Kit和 SYBR PrimeScript miRNA RT-PCR Ki试剂盒进行逆转录和qRT-PCR。miR-93-5p上游引物序列:5′-AGCAGTAGGTTGGGTAATC-3′,下游引物序列:5′-GCTGTTCGTGCAGGTAGT-3′。miR-93-5p 以 U6 为内参,U6 上游引物序列:5′-CTCGCTTCGGCAGCACA-3′,下游引物序列:5′-AACGCTTCACGAATTTGCGT-3′。PCR 反应条件:50 ℃,2 min;95 ℃,10 min;(95 ℃,30 s;60 ℃,1 min)×40;60 ℃,5 min。
1.6 基因转染 将miR-93-5p inhibitor和空载体阴性对照物干粉用RNase-free水配制成20 μmol/L的母液后分装、冻存备用。将SKOV3细胞分成inhibitor组和阴性对照组(NC组),两组细胞消化后铺在6 cm的培养皿中,过夜至细胞密度达70%左右。弃去培养基后加入无血清MEM培养基,按照Lipofectamine 2000 Transfection试剂盒说明书要求进行转染,其中inhibitor组转染miR-93-5p inhibitor,NC组转染阴性对照物。孵育6~8 h后,弃去原培养基,换成完全培养基后继续培养48 h。
1.7 细胞相对存活率检测 采用MTT法。收集对数期inhibitor组和NC组细胞,调整细胞密度为3 000个/孔,每个实验组设置4个复孔,每孔100 μl加入到96孔板,置37℃含有5% CO2培养箱培养。细胞经转染后,继续培养 12、24、48、72 h,每孔加入 20 μl浓度为 5 mg/ml的MTT溶液,培养箱中继续孵育4 h,弃去上清液,每孔加入100 μl DMSO后震荡10 min,用酶标仪在570 nm处测定吸光度(OD值)。重复实验3次,以平均值统计结果,计算各浓度下细胞相对存活率。相对存活率(%)=(各实验组OD/0 h OD)×100%
1.8 细胞相对迁移率检测 采用细胞划痕实验。取对数期inhibitor组和NC组细胞,接种于6孔板中培养,调整细胞密度为6×105个/孔。于培养箱中培养24 h且单层细胞铺满6孔板板底时(细胞融合度约为90%),将灭菌尺固定于孔的正上方中央位置,用装有200 μl枪头的移液枪沿着灭菌尺滑动,划痕横穿过孔。每孔划3条长直划痕,作为每组细胞平行组。小心吸掉培养基,用PBS小心地清洗3遍,洗去划痕产生的漂浮细胞。然后换上新的培养基。分别于划痕后0、12、24 h后,用显微镜拍照并记录划痕愈合程度。然后用Image J软件分析,并计算细胞相对迁移率。
1.9 RBM24蛋白相对表达量检测 采用Western blot法。裂解并提取inhibitor组和NC组细胞的蛋白,根据碧云天BCA蛋白浓度测定试剂盒说明书进行标准曲线的制备,根据标准曲线计算出各个样品的蛋白含量,调整样品浓度后进行上样,经SDS聚丙烯酰胺凝胶电泳分离后转印,5%脱脂奶粉封闭,封闭后加入相应一抗4℃摇床过夜,第2天加入相应二抗,室温孵育2 h后TBST洗膜3次。ECL浸泡后用化学发光荧光成像系统对图像进行扫描和分析。
1.10 荧光素酶报告基因检测 收集对数期的SKOV3细胞,将细胞分为对照组(miR-NC组)和过表达组(miR-93-5p mimics组),胰酶消化离心,重悬后调整细胞悬液浓度为1×106个/ml,并接种至6孔板,在细胞融合度约50%时使用LipofectamineTM2000转染试剂,将miR-NC转染至miR-NC组,将miR-93-5p mimics转染至miR-93-5p mimics组,另外将pGL3空白质粒、RBM24 3′-UTR 突变型质粒、RBM24 3′-UTR 野生型质粒共转染至两组细胞,常规培养48 h。加入细胞裂解液裂解细胞,4℃、12 000 r/min离心10 min,取上清液进行荧光素酶活性检测。通过比较荧光强度判断miR-93-5p对RBM24的调控作用。
1.11 统计学处理 采用SPSS 22.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;两组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同细胞中miR-93-5p相对表达量比较 miR-93-5p 在卵巢癌细胞(SKOV3、A2780、ES2)中的表达水平均明显高于正常卵巢上皮细胞(IOSE80),差异均有统计学意义(均P<0.05),见表1。根据此结果,本研究团队选取miR-93-5p表达量最高的SKOV3细胞株进行后续实验。

表1 不同细胞中miR-93-5p相对表达量比较
2.2 两组细胞相对存活率比较 与NC组相比,inhibitor组细胞在48和72 h时的相对存活率均显著降低,差异均有统计学意义(均P<0.05),见图1。

图1 两组细胞相对存活率比较(与NC组比较,*P<0.05)
2.3 两组细胞相对迁移率比较 Inhibitor组细胞在12 h时的相对迁移率为(40.67±4.21)%,在24 h时的相对迁移率为(33.76±3.42)%,与NC组比较差异均有统计学意义(均P<0.01)。见图2和表2。
2.4 两组细胞RBM24蛋白相对表达量比较 与NC组比较,inhibitor组细胞中RBM24蛋白相对表达量明显升高,差异有统计学意义(P<0.05),见图3和表3。
2.5 miR-93-5p靶基因预测及验证 通过TargetScan靶点预测软件预测到RBM24是miR-93-5p潜在的靶基因,见图4。荧光素酶报告基因实验结果显示,与miR-NC组比较,miR-93-5p mimics组中RBM24-MUT表达差异无统计学意义(P>0.05),而RBM24-WT表达则显著下调,差异有统计学意义(P<0.05),见表4。
3 讨论
卵巢癌是临床上常见的妇科生殖系统恶性肿瘤疾病之一,其发病率位于三大妇科恶性肿瘤之末,但病死率却高居首位,由于卵巢组织具有解剖部位隐蔽性及内分泌功能复杂性,导致卵巢癌早期症状不明显,不易被发现,严重威胁女性的生命健康[11]。因此,寻找有效的卵巢癌分子标志物是当下的研究热点。
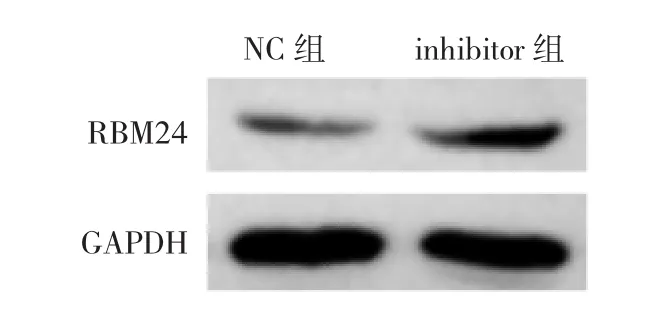
图3 两组细胞RBM24蛋白表达的电泳图

表3 两组细胞RBM24蛋白相对表达量比较

图4 TargetScan靶点预测结果
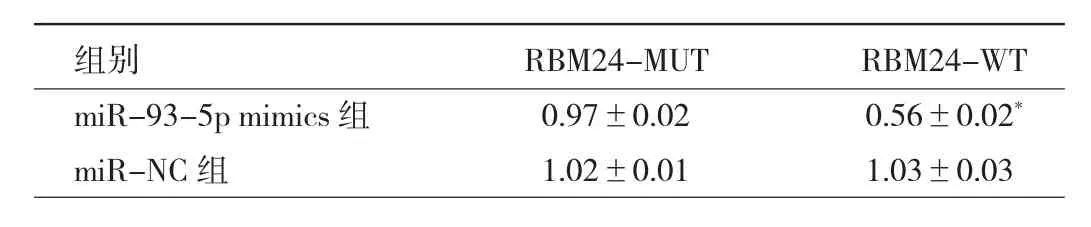
表4 荧光素酶报告基因检测结果
miRNA是近年来发现的一类长度较短的单链非编码RNA,与靶基因的3′非翻译区互补结合,能够通过诱导靶基因mRNA降解或者抑制其翻译,从而实现对靶基因的调控作用[12]。近几年研究发现miRNA与恶性肿瘤的发生、发展密切相关,许多miRNA在肿瘤中呈现异常表达。miRNA根据其在癌症发生中的作用分为两类:一类为致癌miRNA,另一类为抑癌miRNA。致癌miRNA通过抑制抑癌基因的靶mRNA,发挥其致癌作用,例如miR-448能够通过下调SPACRL1的表达进而促进口腔鳞癌增殖及迁移的能力[13];miR-182通过抑制FOXO1的表达,从而促进乳腺癌细胞的侵袭和迁移[14]。而抑癌miRNA通过抑制癌基因的靶mRNA的表达,发挥抑癌作用,例如miR-363能够通过靶向作用于CTHRC1,进而抑制结直肠癌细胞的增殖和迁移[15];miR-126通过下调NCoA7的表达,进而抑制ARNT介导的肺鳞癌细胞增殖[16]。miR-93-5p位于染色体11q22.1,属于miR-106b-25家族。研究发现miR-93-5p在胃癌中表达上调,并能够通过靶向调控Hippo信号通路从而促进胃癌细胞的增殖和转移[17]。有研究发现miR-93在结肠癌病灶中表达显著下调,其表达降低与结肠癌转移、分化和预后不良密切相关,并且上调miR-93的表达能够通过抑制Wnt/β-catenin信号通路进而抑制结肠的侵袭和转移[18]。同时,也有研究显示miR-93-5p与结直肠癌[19]、食管癌[20]和肺癌[21]的发生、发展密切相关。虽然目前关于miR-93-5p的报道已有很多,但主要集中在胃癌、结直肠癌的研究中。
本研究结果显示,相对于正常卵巢上皮细胞,miR-93-5p在卵巢癌细胞中显著高表达,表明miR-93-5p可能参与卵巢癌的发生和发展过程。因此,本研究通过转染miR-93-5p inhibitor,实现抑制卵巢癌细胞SKOV3中miR-93-5p的相对表达量。MTT结果显示,转染miR-93-5p inhibitor的细胞相对存活率受到抑制,同时细胞划痕实验结果显示,转染miR-93-5p inhibitor的细胞相对迁移率也受到抑制,较NC组均有统计学差异。这表明在卵巢癌的发生、发展过程中,miR-93-5p可能起到促进癌细胞生长和转移的作用。
卵巢癌的发生和发展受到多种基因和蛋白的调控,而研究关于这些相关基因和蛋白对了解卵巢癌的发病机制具有重要意义。RBM24在肌原性的分化和心脏发育中起着重要的作用。有研究表明,RBM24可以在转录水平上调节p21和p63的稳定性[22]。目前已有文献指出RBM24在乳腺癌中呈现低表达[23],并且在鼻咽癌中起到抑癌的作用[24]。在本研究中,生物信息学软件分析表明RBM24是miR-93-5p直接作用的靶基因,荧光素酶报告基因实验验证了该结果,并且在卵巢癌细胞SKOV3中抑制miR-93-5p后,RBM24蛋白的表达量显著升高,进一步说明miR-93-5p能够抑制卵巢癌细胞中的RBM24的表达量。以上结果均提示,miR-93-5p在卵巢癌细胞中高表达,可以通过负调控靶基因RBM24促进卵巢癌细胞的增殖和转移。因此,miR-93-5p可能是卵巢癌肿瘤发展过程中的重要因子,可能成为卵巢癌诊断或治疗的新靶点。
