下调lncRNA SNHG3表达对人胃癌细胞增殖、侵袭、凋亡的影响及机制
2021-01-22谷建斌张景承薛菲耿蕴峰王冬冬
谷建斌 张景承 薛菲 耿蕴峰 王冬冬
胃癌是常见的消化道恶性肿瘤,尽管诊断技术在不断提高,以手术治疗为主的综合治疗(包括化疗、靶向治疗等)也越来越丰富,但胃癌患者的病死率仍位居肿瘤相关死亡的第3位[1]。为了提高胃癌患者的生存期,探索胃癌发生、发展的分子机制,寻找可靠的生物标志物作早期诊断依据和可靠的治疗靶点显得尤为迫切,因此在基因组中大量转录的长链非编码RNA(long non-coding RNA,lncRNA)成为胃癌研究的新热点。lncRNA指长度超过200个核苷酸的非编码RNA,近年来研究结果发现,在恶性肿瘤组织和正常组织中存在差异表达的lncRNA[2-3],在多种肿瘤如胃癌、结肠癌、肝癌的发生、发展、转移以及复发过程中的重要作用也得到了证实[4-6]。核仁小分子RNA宿主基因3(SNHG3)是一种位于1p35.3的lncRNA。研究发现lncRNA SNHG3在胃腺癌组织中异常高表达[7],但目前关于lncRNA SNHG3在胃癌中发挥的作用及机制研究较少。因此,本研究主要探讨下调lncRNA SNHG3的表达对人胃癌细胞增殖、侵袭、凋亡的影响及可能的机制,为胃癌的诊断和治疗提供新的方向。
1 材料和方法
1.1 细胞株 人胃癌细胞株SGC-7901、正常胃黏膜上皮GES1均为河北医科大学第四医院科研中心惠赠;人胃癌细胞MGC-803购自中国医学科学院基础医学研究所基础医学细胞中心;人胃腺癌细胞BGC-823购自上海赛百慷生物技术股份有限公司。
1.2 主要试剂与仪器 SNHG3-siRNA由上海吉玛制药技术有限公司设计合成。lncRNA SNHG3、β-Actin引物使用primer 5软件设计,由上海生工公司合成。M-MLV反转录试剂盒购自美国promega公司;SYBR Green PCR Master Mix试剂盒购自北京全式金公司;Lipofectamin2000购自美国 Invitrogen 公司;goat anti rabbit IgG(H+L)、辣根过氧化物酶购自美国Jackson公司;Western blot增强化学发光试剂(ECL)购自美国Millipore公司。Roter gene 3000购自澳大利亚Corbett公司;NanoDrop ND-2000分光光度计购自美国NanoDrop公司;Transwell小室购自美国Corning公司;BD Accuri C6流式细胞仪购自美国BD公司。
1.3 方法
1.3.1 细胞培养 将人胃癌细胞BGC-823、SGC-7901、MGC-803及正常胃黏膜上皮细胞GES1均接种于RPMI 1640培养基,于37℃、5% CO2培养箱中培养,48 h后消化传代。
1.3.2 lncRNA SNHG3相对表达量检测 采用qRTPCR法。取对数生长期胃癌细胞BGC-823、SGC-7901、MGC-803及正常胃黏膜上皮细胞GES1,采用 qRTPCR试剂盒检测lncRNA SNHG3的相对表达量。lncRNA SNHG3 引物:上游:5′AGACA GATTCGCAGTGGTCG3′,下游:5′GTCTCCATGGCCCACTTCTG3′;β-Actin 上游引物 5′-CACCCCAGCCATGTACGTTG-3′,下游引物 5′-AATGTCACGCACGATTTCCC-3′。采用2-ΔΔCt表示胃癌细胞 lncRNA SNHG3 相对表达量。
1.3.3 细胞分组及转染 将对数生长期的人胃癌细胞BGC-823随机分为SNHG3-siRNA组、阴性对照组和空白对照组,每组设3个复孔。各组常规培养24 h,SNHG3-siRNA组加入lncRNA SNHG3-siRNA(正义链:5′-GCAUUUAGCUAGGAAUGCATT-3′,反义链:5′-UGCAUUCCUAGCUAAAUGCTT-3′)转染,阴性对照组加入无关序列 NC-siRNA(正义链:5′-ACUGCGACUGCUUCACUUGTT-3′,反义链:5′-CAAGUGAAGCAGUCGCAGUTT-3′)转染,空白对照组不予转染。所有操作严格按Lipofectamine 2000说明书进行。转染24 h,提取细胞总RNA,NanoDrop 2000分光光度计和琼脂糖凝胶电泳检测,提取的总RNA纯度和完整性符合实验要求。按照M-MLV反转录试剂盒说明书方法逆转录为cDNA,以cDNA为模板进行PCR扩增。根据SYBR Green PCR Master Mix试剂盒说明配制反应体系20 μl。反应条件:95℃预变性 30 s,95℃ 变性10 s,60℃退火 10 s,72℃延伸20 s共40个循环。
1.3.4 细胞增殖能力检测 采用CCK-8法。将转染24 h的3组细胞消化制成单细胞悬液,以5×103个/孔种植于 96孔板(100 μl/孔),在培养 24 h时每孔加入CCK-8 溶液 10 μl,继续培养 1 h,在 450 nm 波长下,用酶标仪测定各孔光密度(OD)值。
1.3.5 细胞克隆形成能力检测 克隆形成实验:将细胞接种于 6孔板(1.5×104个/孔),置于培养箱中培养 1~2周,观察克隆细胞形成至合适大小时用磷酸盐缓冲液(PBS)洗涤2次,4%多聚甲醛固定15 min,加适量0.1%结晶紫染色液染色10 min,倒置显微镜下观察5个视野,计数细胞的克隆数。克隆形成率(%)=(克隆数目/接种细胞数)×100%。
1.3.6 细胞迁移能力检测 采用Transwell小室试验。取各组细胞,均计数5×104个细胞加入 Transwell小室上室中,用无血清培养液正常培养,小室下加入含10%血清的DMEM培养液。培养48 h,将小室取出用PBS冲洗,4%多聚甲醛固定20 min,0.1%结晶紫染液染色20 min。显微镜下观察并拍照,随机选取5个视野计数穿膜细胞数,每组设3个复孔,取平均值。
1.3.7 细胞侵袭能力检测 采用Transwell小室试验。Transwell小室上室用50 μl Matrigel胶包被,在37℃中放置3~5 h。各组分别取200 μl(密度为2.5×105个/ml)细胞接种于Transwell小室上室,在下室加入DMEM培养基。培养48 h后擦去上室的Matrigel胶和多余细胞,4%多聚甲醛固定20 min,0.1%结晶紫染色,随机选取5个视野计数穿膜细胞数,每组设3个复孔,取平均值。
1.3.8 细胞各周期百分比及凋亡率检测 采用流式细胞术(FCM)进行细胞周期分析,通过标准胰蛋白酶消化程序收获生长对数期的转染和对照细胞,用PBS洗涤,加入500 μl PI染液和5 μl破膜剂,室温避光孵育30 min,收集培养物并使用BD Accuri C6流式细胞仪分析细胞周期。数据表示为在细胞周期的G1、S和G2期细胞的百分比分布。按照细胞凋亡检测试剂盒说明,将细胞每管加入 5 μl Annexin V-FITC 和 10 μl 20 μg/ml碘化丙啶溶液,室温避光孵育15 min,使用流式细胞仪测定并获取凋亡比例数据。
1.3.9 信号传导与活化转录因子3(STAT3)、p-STAT3和基质金属蛋白酶-2(MMP-2)蛋白的表达水平检测 采用Western blot法。使用RIPA缓冲液提取总细胞裂解物,通过配置12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS.PAGE,恒压80 V,2 h)分离蛋白质,并转移到PVDF膜,用5%脱脂奶粉封闭,并在4℃下与一抗孵育过夜。缓冲液洗膜(15 min×3次),将膜与二抗孵育,最后用ECL底物试剂盒检测,实验重复3次。采用Bio-Rad Image Lab 5.2.1软件进行灰度分析。
1.4 统计学处理 采用SAS 9.1统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 lncRNA SNHG3在人胃癌细胞与胃正常黏膜上皮细胞GES1中相对表达量的比较 qRT-PCR结果显示,与胃正常黏膜上皮细胞GES1相比,BGC-823、MGC-803细胞的lncRNA SNHG3相对表达量均明显增高,差异均有统计学意义(均P<0.05),见表1。选取lncRNA SNHG3相对表达量最高的胃癌BGC-823细胞系进行下一步的细胞功能试验。BGC-823细胞中,SNHG3-siRNA组lncRNA SNHG3相对表达量均明显低于阴性对照组、空白对照组,差异均有统计学意义(均P<0.05),见表2。

表1 lncRNA SNHG3在人胃癌细胞与胃正常黏膜上皮细胞GES1中相对表达量的比较

表2 3组BGC-823细胞中lncRNA SNHG3相对表达量比较
2.2 3组BGC-823细胞增殖能力比较 结果显示SNHG3-siRNA组的OD值均明显低于阴性对照组、空白对照组,差异均有统计学意义(均P<0.05),见表3。
2.3 3组BGC-823细胞克隆形成率比较 SNHG3-siRNA组、阴性对照组、空白对照组细胞的克隆形成实验结果见图1(插页)。SNHG3-siRNA组克隆形成率均明显低于阴性对照组、空白对照组,差异均有统计学意义(均 P<0.05),见表 4。

图1 3组细胞克隆形成能力的比较
2.4 3组BGC-823细胞迁移和侵袭能力比较 在Tran-swell迁移实验中,SNHG3-siRNA组细胞迁移数均明显低于阴性对照组、空白对照组,差异均有统计学意义(均P<0.05);Transwell侵袭实验中,SNHG3-siRNA 组细胞侵袭数均明显低于阴性对照组、空白对照组,差异均有统计学意义(均 P<0.05),见图 2(插页)、表 5。

表3 3组BGC-823细胞增殖能力比较

表4 3组BGC-823细胞克隆形成率比较(%)
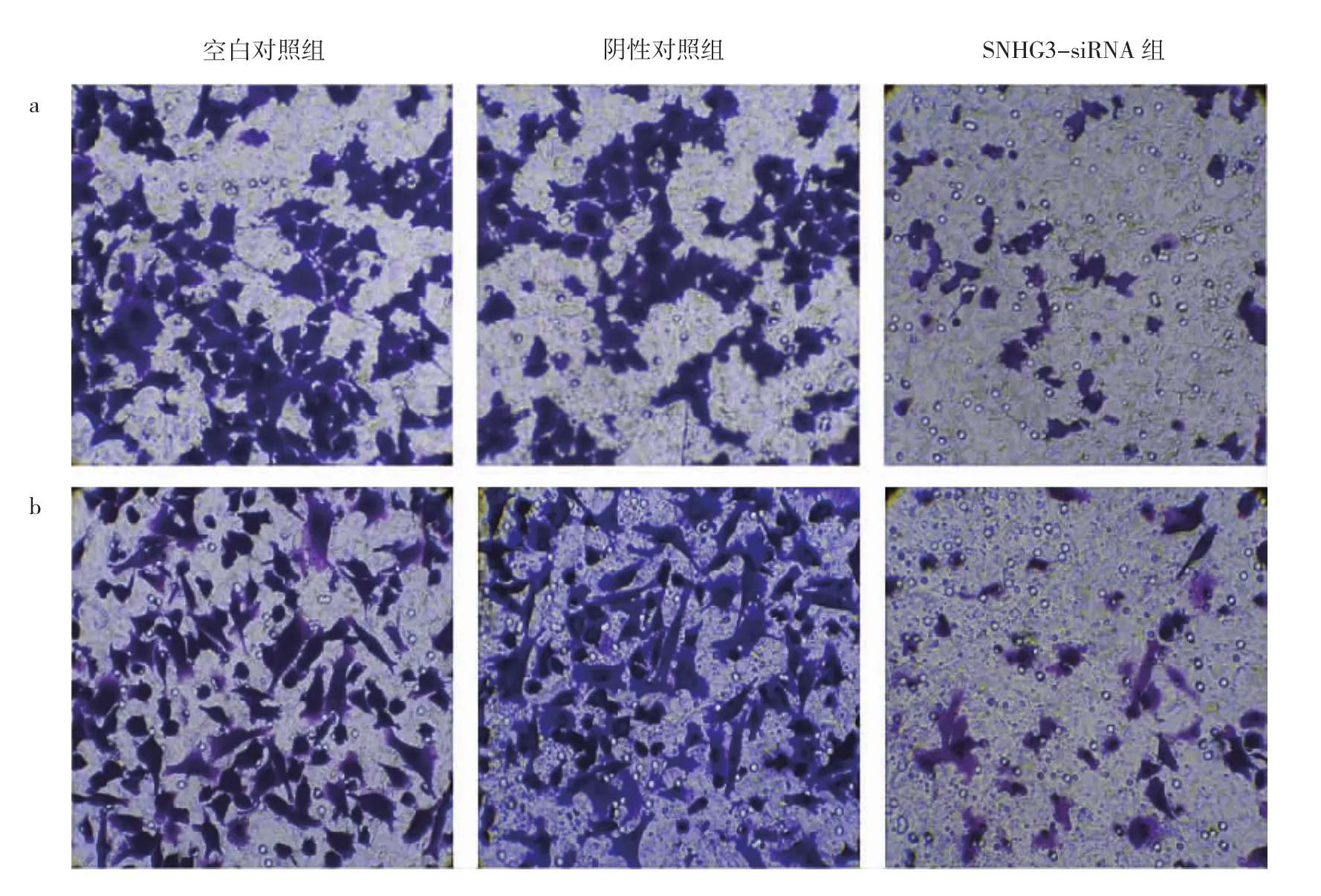
图2 3组BGC-823细胞的迁移、侵袭能力的比较(a:迁移实验;b:侵袭实验;结晶紫染色,×200)
2.5 3组BGC-823细胞各周期细胞百分比和凋亡率比较 BGC-823细胞转染SNHG3 siRNA 24 h后,SNHG3-siRNA组细胞G1期百分比均明显高于空白对照组、阴性对照组,差异均有统计学意义(均P<0.05),3组细胞S期百分比比较差异则无统计学意义(P>0.05);SNHG3-siRNA组细胞G2期百分比均明显低于空白对照组、阴性对照组,差异均有统计学意义(均P<0.05),见图3、表6。下调lncRNA SNHG3的表达后,SNHG3-siRNA组细胞凋亡率均明显高于空白对照组、阴性对照组,差异均有统计学意义(均P<0.05),见图4。
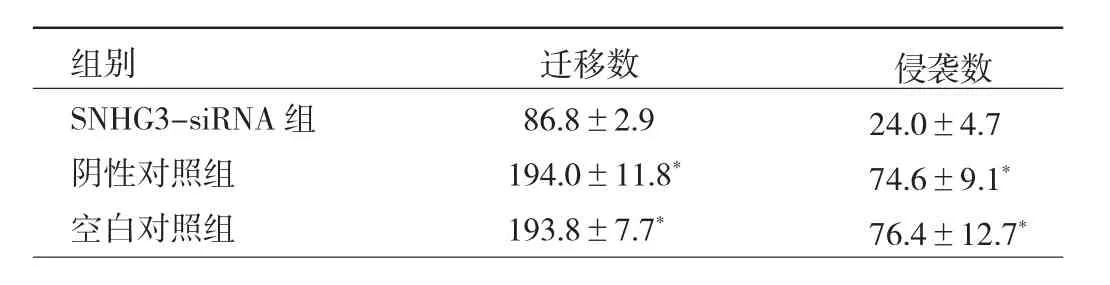
表5 3组BGC-823细胞迁移、侵袭数比较(个/视野)
2.6 3组BGC-823细胞STAT3、p-STAT3和MMP-2蛋白表达水平比较 Western blot结果显示,与阴性对照组和空白对照组比较,SNHG3-siRNA组的STAT3、p-STAT3和 MMP-2蛋白的表达水平均明显下降,p-STAT3/STAT3的比值明显降低,差异均有统计学意义(均 P<0.05),见图 5、表 7。
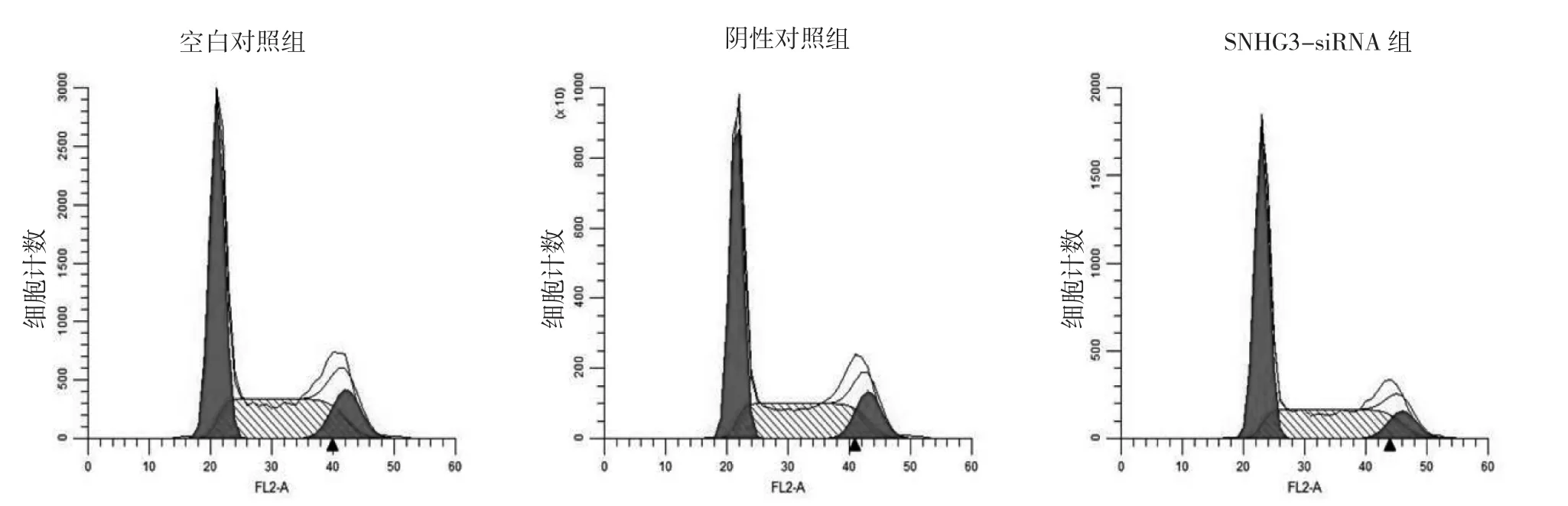
图3 3组BGC-823细胞各周期细胞百分比的比较
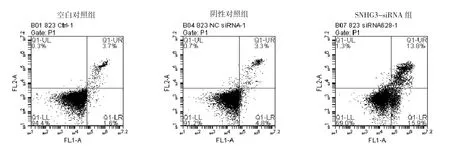
图4 3组BGC-823细胞凋亡情况的比较
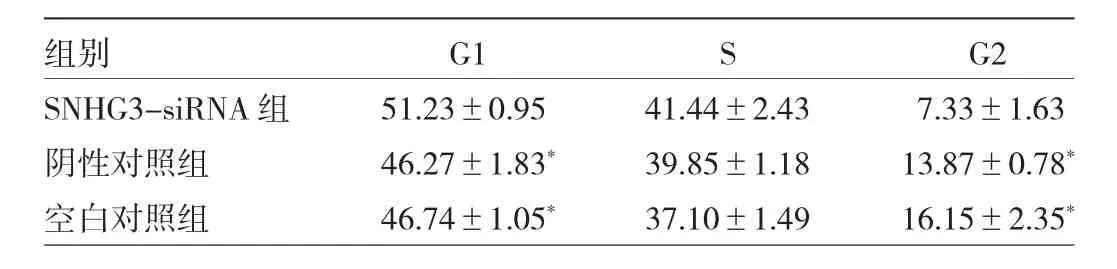
表6 3组BGC-823细胞各周期细胞百分比的比较(%)

图5 3组BGC-823细胞STAT3、p-STAT3、MMP-2蛋白表达水平的比较(STAT3为信号传导与活化转录因子3;MMP-2为基质金属蛋白酶-2)
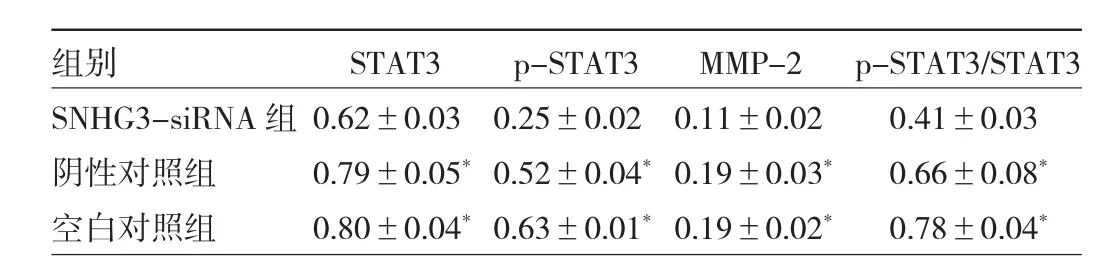
表7 3组 BGC-823细胞 STAT3、p-STAT3、MMP-2蛋白表达水平的比较
3 讨论
目前大量研究表明,lncRNA在肿瘤的发生、发展中起到重要的调控作用[8-9]。lncRNA SNHG3作为一种lncRNA,最初由Pelczar等[9]发现。近期研究发现,lncRNA SNHG3在肝癌、结直肠癌中均表达增高[10-11],是肝癌、结直肠癌不良预后的重要指标。Huang等[11]发现,在结直肠癌中,SNHG3作为内源性竞争性RNA与miR-182-5p相互竞争,导致c-Myc过表达并作用于c-Myc的目的基因,从而促进了结直肠癌进展。而在胃癌的研究中,lncRNA SNHG3在胃癌组织中高表达[7],并且高表达的胃癌患者的生存时间显著低于低表达的胃癌患者[12]。为了进一步探讨lncRNA SNHG3在胃癌中发挥的作用及机制,本研究以胃癌细胞为研究对象,qRT-PCR结果显示,胃癌细胞BGC-823、MGC-803中lncRNA SNHG3的相对表达量均明显高于胃正常黏膜上皮细胞系GES1,提示lncRNA SNHG3高表达与胃癌的发生相关。
应用siRNA技术转染BGC-823下调lncRNA SNHG3表达后,CCK-8实验和克隆形成实验结果显示细胞增殖能力、克隆形成能力均受到显著抑制,提示lncRNA SNHG3在胃癌发展及克隆性增殖过程中发挥了一定作用。进一步研究发现,下调lncRNA SNHG3表达后,G1期细胞百分比上升,G2期细胞百分比下降,提示下调lncRNA SNHG3的表达,使细胞周期阻滞于G1期,抑制胃癌细胞BGC-823进入G2期,从而抑制胃癌细胞BGC-823的分裂增殖。下调lncRNA SNHG3的表达后,BGC-823细胞凋亡率显著上升,这些结果表明lncRNA SNHG3下调所引起的分裂增殖抑制、凋亡增加可能是胃癌细胞增殖能力下降的部分原因。Transwell迁移、侵袭实验表明,胃癌细胞BGC-823在lncRNA SNHG3下调后的迁移及侵袭能力均显著降低,说明在侵袭和转移的过程中lncRNA SNHG3可能也扮演了重要的角色。
信号传导与活化转录因子(signal transducer andactivator of transcription,STATs)家族成员具有信号转导和转录调控双重功能[13]。酪氨酸激酶相关受体、STATs、JAK酪氨酸激酶(Janus kinase)构成了JAK-STAT信号通路。生理状态下,JAK-STAT通路的激活快速而短暂,而在人类肿瘤细胞中该通路则持续激活[14],JAK-STAT信号的异常激活可促进肿瘤细胞增殖、迁移、侵袭及上皮间质转化[15]。STAT3作为IL-6R、表皮生长因子受体、JAK、Src等多个致癌性酪氨酸激酶信号通路的会聚点,其持续性激活能上调 Bcl-xl、Mcl-1、CyclinsD1/D2、C-myc 和survivin基因的表达,下调p53基因的表达,缩短细胞在G1期的停滞时间,使其快速进入S期,干扰正常细胞的增殖、分化、凋亡[16]。磷酸化后的STAT3是STAT3的活性形式,其形成二聚体后进入细胞核内调控相关基因的转录[17],诱导多种参与细胞存活、增殖、迁移、侵袭、血管生成及免疫逃逸等基因的表达,促进致癌性转化。抑制STAT3磷酸化及p-STAT3介导的DNA转录和复制,可促进肿瘤细胞凋亡[18]。近期研究发现,p-STAT3蛋白与胃癌患者不良预后及胃癌分化程度、TNM分期、淋巴结转移、远处转移及肿瘤浸润深度密切相关,提示其对胃癌的发展起调控作用,可能作为预测胃癌的一个分子标志物[19]。本研究中,下调lncRNA SNHG3表达后,STAT3、p-STAT3的表达水平显著下降。p-STAT3/STAT3的比值显著降低,细胞周期阻滞于G1期,细胞凋亡比例显著上升,提示lncRNA SNHG3表达下调,可能与抑制STAT3的表达和STAT3的磷酸化水平有关,进而抑制了BGC-823细胞增殖,诱导了凋亡。MMP-2是MMPs家族中的重要一员,其能够降解细胞基底膜及细胞外基质成分Ⅳ型胶原,从而促进肿瘤侵袭和转移。研究发现,STAT3可通过MMP-2启动子上的结合位点,上调MMP-2基因表达水平,进而显著提高胃癌细胞的转移能力[20]。阻断STAT3能明显下调MMP-2蛋白的表达水平,抑制肿瘤细胞的生长和侵袭。本研究中,在下调lncRNA SNHG3表达后,STAT3、p-STAT3、MMP2 的表达水平均显著下降,BGC-823细胞迁移及侵袭能力均显著降低,提示可能与抑制MMP-2的表达从而抑制了BGC-823细胞的侵袭有关。这在一定程度上解释了下调lncRNA SNHG3后细胞增殖、克隆、Transwell侵袭实验和细胞凋亡实验的结果,抑制lncRNA SNHG3基因有望应用于胃癌的靶向治疗。
综上所述,本研究从细胞水平证实了lncRNA SNHG3在胃癌细胞中高表达,同时其是胃癌细胞增殖、抗凋亡、侵袭以及转移的必要因素,对其进行干扰可以有效破坏胃癌细胞的这些生物学行为,这可能与抑制STAT3、MMP-2的表达和STAT3的磷酸化水平有关。下调lncRNA SNHG3 表达后,调控 STAT3、p-STAT3、MMP-2 表达水平的具体分子机制尚待进一步研究。
