HDAC抑制剂Quisinostat对肝癌Huh7细胞增殖和凋亡的影响及作用机制
2021-01-22胡霄朱明辉蒲青凡周瑞耀
胡霄 朱明辉 蒲青凡 周瑞耀
原发性肝癌(90%以上是肝细胞性肝癌)是全球范围内的常见恶性肿瘤,具有高病死率和高发病率的特点,而中国的肝癌发病数占全球肝癌总发病数的50%[1]。目前,手术切除是肝癌最主要的治疗方式,放化疗对肝癌的治疗效果比较有限。显然,研究和开发新型的抗肝癌药物以提高中晚期肝癌患者的治疗效果和延长其生存期具有重要的临床意义。组蛋白去乙酰化酶(histone deacetylase,HDAC)具有催化组蛋白去乙酰化,维持染色体中组蛋白乙酰化/去乙酰化平衡的功能。组蛋白乙酰化与基因转录、细胞周期进展、基因沉默、DNA复制、DNA损伤修复和细胞分化等现象有关[2]。Quisinostat是新型氧肟酸盐类HDAC抑制剂,其主要抑制靶点为I类和Ⅱ类HDAC家族蛋白[3]。体外研究证实Quisinostat在肺癌、结肠癌、乳腺癌、前列腺癌、卵巢癌等多个肿瘤细胞株中有明显的抑癌效果[3],但对其具体抗肿瘤机制尚未完全阐明。目前国内鲜见报道Quisinostat对肝癌抑制作用的研究。因此,本研究通过观察HDAC抑制剂Quisinostat对肝癌细胞株Huh7细胞增殖和凋亡的影响,以评价Quisinostat的抗肝癌效果,并进一步探讨其可能的作用机制。
1 材料和方法
1.1 材料
1.1.1 细胞株 肝癌细胞株 Huh7购自中国科学院上海细胞生物学研究所。由本实验室培养冻存。
1.1.2 药品HDAC抑制剂Quisinostat(规格:5 mg/支)购自美国Selleck公司;Caspase抑制剂Z-VAD-FMK(规格:1 mg/支)购自美国Selleck公司。上述药物均用二甲基亚砜(DMSO)溶解、分装,-20℃避光保存。实验前用MEM培养液稀释成工作浓度。控制DMSO终浓度≤0.1%。
1.1.3 实验试剂RIPA细胞裂解液、BeyoECL Plus(P0018)试剂盒、细胞周期试剂盒均购自南京碧云天生物技术公司;CCK-8试剂盒购自日本同仁化学研究所;凋亡试剂盒(Annexin-V FITC/PI)购自日本同仁化学研究所;B淋巴细胞瘤-2蛋白(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,BAX)、剪切型半胱胺酸天冬氨酸蛋白酶-9(Cleaved Caspase-9)、剪切型半胱胺酸天冬氨酸蛋白酶-3(Cleaved Caspase-3)等兔单克隆抗体均购自美国CST公司;β-肌动蛋白(β-Actin)、p53蛋白、细胞周期蛋白 D1(Cyclin D1)、p21 和 p27 等兔单克隆抗体以及辣根过氧化物酶标记山羊抗兔第二抗体均购自美国Abcam公司。
1.1.4 主要仪器 IX71倒置相差显微镜购自日本OLYMPUS公司;高速冷冻离心机(micro21R型)购自美国Thermo Fisher公司;蛋白凝胶电泳系统购自美国Bio-rad公司(ChemiDoc MP化学发光成像系统);DYNEX MUM型酶标仪购自美国DYNEX Technologies公司;BD LSRII数字化分析型流式细胞仪购自美国BD公司。
1.2 方法
1.2.1 不同浓度Quisinostat处理组细胞增殖抑制率检测 采用CCK-8法。取处对数生长期的Huh7细胞,接种细胞密度为3×104/ml。将细胞种于96孔板,细胞数为3 000个/孔。细胞贴壁后,实验组加入不同浓度的Quisinostat,使其终浓度分别 12.5、25、50、100、200 nM,对照组则加等量不含Quisinostat的培养液。每种浓度5个平行孔。分别于24、48、72 h取1块96孔培养板测定吸光度(OD值)以计算细胞增殖抑制率。计算公式:细胞增殖抑制率=1-OD(药物)/OD(对照)。
1.2.2 不同浓度Quisinostat处理组细胞周期占比检测采用流式细胞术。取处对数生长期的Huh7细胞,接种于6孔板中,Huh7细胞种板数为15×104个。细胞贴壁后加入0、25、50 nM Quisinostat处理48 h。实验重复3次,取平均值。48 h后消化收集0、25、50 nM处理的肝癌细胞,制成细胞悬液。应用含有0.2 mg RNase A的1 ml PI/Triton X-100 染色液(20 μg PI/0.1% Triton X-100)37℃染色15 min。流式细胞仪测定细胞周期,用Modfit LT软件分析流式周期结果,统计不同浓度组G0/G1期、S期、G2/M期、S期+G2/M期所占百分比。
1.2.3 不同浓度Quisinostat处理组细胞凋亡率检测采用Annexin-V FITC/PI双染法。取处对数生长期的Huh7细胞接种于6孔板中。Huh7细胞种板数为15×104个。细胞贴壁后加入 0、25、50、100 nM Quisinostat处理48 h。实验重复3次,取平均值。培养48 h后收集细胞,采用Annexin-V FITC/PI凋亡试剂盒对细胞进行染色,用流式细胞仪分析细胞凋亡率。
1.2.4 单用Quisinostat和联合Z-VAD-FMK处理Huh7细胞的凋亡率检测 采用Annexin-V FITC/PI双染法检测。取处对数生长期的Huh7细胞接种于6孔板。细胞贴壁后加药。实验分组:0 nM Quisinostat组、50 nM Quisinostat组、50 nM Quisinostat+50 μm Z-VAD-FMK组(作为实验组)。药物处理48 h后,收集细胞,用Annexin-V FITC/PI凋亡试剂盒对细胞染色,流式细胞仪检测细胞凋亡率。
1.2.5 不同浓度Quisinostat处理组细胞凋亡和周期相关蛋白表达水平的检测 采用Western blot法。取对数生长期细胞接种于6 cm平皿,待细胞贴壁后加入0、25、50、100 nM Quisinostat。48 h 后提取总蛋白,用 BCA法测定蛋白浓度。等量加样,蛋白质电泳转膜后,封闭液室温封闭2 h。用1∶1 000稀释的目的蛋白一抗于4℃孵育过夜。洗膜后用1∶2 000稀释的二抗孵育2 h。用BeyoECL Plus(P0018)试剂使目的蛋白发光。用Bio-rad ChemiDoc MP化学发光成像系统拍照,分析测定各条带面积灰度值。实验重复3次,取平均值。以β-Actin为内参,用上述方法分析目的蛋白(BAX、Bcl-2、Cleaved Caspase-9、Cleaved Caspase-3、p53、Cyclin D1、p21 和p27蛋白)的表达水平。
1.3 统计学处理 采用GraphPad Prism 5.01统计软件。计量资料用表示。多组间比较采用单因素方差分析或双因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度Quisinostat处理组Huh7细胞增殖抑制率比较 随着Quisinostat浓度增加,Huh7细胞增殖抑制率逐渐增加(P<0.05);同一浓度Quisinostat下Huh7细胞增殖抑制率随着时间延长也逐渐增强(P<0.05)。见图1。
2.2 不同浓度Quisinostat处理组Huh7细胞各细胞周期占比的比较 与0 nM组相比,25、50 nM组G0/G1期细胞明显增加,S期细胞明显减少,S期+G2/M期细胞明显下降,差异均有统计学意义(均P<0.05),而3组比较G2/M期差异无统计学意义(P>0.05)。见表1。

图1 不同浓度Quisinostat处理组Huh7细胞增殖抑制率比较
2.3 不同浓度Quisinostat处理组Huh7细胞凋亡率比较 3组间Huh7细胞晚期、早期凋亡率比较差异均有统计学意义(均 P<0.05),且与 0 nM 比较,25、50、100 nM组Huh7细胞晚期、早期凋亡率均更高,差异均有统计学意义(均P<0.05)。见表2。

表1 不同浓度Quisinostat处理组Huh7细胞各细胞周期占比的比较
2.4 单用Quisinostat与联合Z-VAD-FMK处理Huh7细胞的凋亡率比较 3组间Huh7细胞晚期、早期凋亡率比较差异均有统计学意义(均P<0.05);且与0 nM Q组比较,50 nM Q 组、50 nM Q+50 μm Z 组 Huh7细胞晚期、早期凋亡率均更高,差异均有统计学意义(均P<0.05);与 50 nM Q 组比较,50 nM Q+50 μm Z 组 Huh7细胞晚期、早期凋亡率均更低,差异均有统计学意义(均P<0.05)。见表 3。
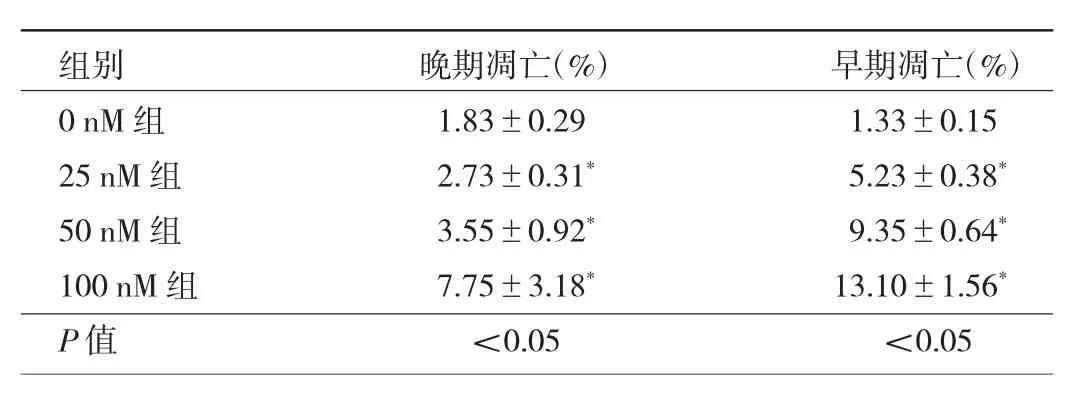
表2 不同浓度Quisinostat作用下肝癌Huh7细胞凋亡率比较
2.5 不同浓度Quisinostat组Huh7细胞凋亡、细胞周期相关蛋白表达水平比较 Western blot结果显示,随着Quisinostat浓度升高,BAX、Cleaved Caspase-3、Cleaved Caspase-9、p53、p21、p27 蛋白表达水平均逐渐增高,Bcl-2、Cyclin D1蛋白表达水平均逐渐降低,差异均有统计学意义(均 P<0.05)。见图 2、3,表 4、5。

表3 单用Quisinostat与联合Z-VAD-FMK处理Huh7细胞的凋亡率比较
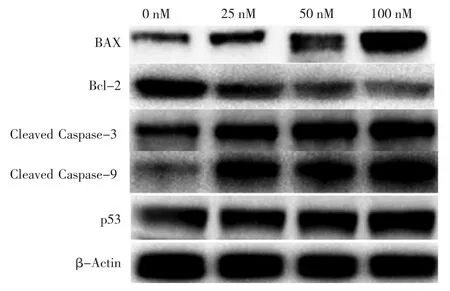
图2 不同浓度Quisinostat组Huh7细胞凋亡相关蛋白表达的电泳图(Bcl-2为B淋巴细胞瘤-2蛋白;BAX为Bcl-2相关X蛋白;Cleaved Caspase-3为剪切型半胱胺酸天冬氨酸蛋白酶-3;Cleaved Caspase-9为剪切型半胱胺酸天冬氨酸蛋白酶-9)
3 讨论

图3 不同浓度Quisinostat组Huh7细胞周期相关蛋白表达的电泳图(Cyclin D1为细胞周期蛋白D1)
Quisinostat是一种新型的HDAC抑制剂。一项基于啮齿类动物模型的研究证实Quisinostat能有效的抑制多发骨髓瘤,明显减轻实验动物的肿瘤负荷,并减少肿瘤血管新生[4]。有临床Ⅰ期研究用Quisinostat+硼替佐米+地塞米松的联合方案治疗复发的多发性骨髓瘤患者,其中约88.2%的患者可取得较好的治疗效果[5]。此外,有临床Ⅰ期研究用Quisinostat治疗实体瘤患者,该研究总共纳入了92例患者,其中9.8%的患者病情经治疗后能得到有效控制[6]。另有临床Ⅱ期研究评价了Quisinostat治疗复发或难治性皮肤T细胞淋巴瘤的疗效,结果显示总皮肤反应率为24%,其中1例患者经Quisinostat治疗150 d,皮肤肿瘤完全缓解,5例患者的皮肤肿瘤部分缓解[7]。本研究表明Quisinostat能有效将肝癌Huh7细胞周期阻滞在G0/G1期,抑制细胞增殖,并且诱导肝癌细胞发生凋亡,从而导致肝癌细胞的生长抑制。
细胞周期转化由周期蛋白依赖激酶(CDK)和其对应的活化亚单位周期蛋白所控制。Cyclin D1是G1/S期更换的重要周期蛋白。Cyclin D1表达下降,则细胞阻滞于G1期[8]。p21和p27则是与G1/S期转换相关的上游调控蛋白,起抑制周期蛋白/CDK复合物功能的作用[9]。在本实验中,不同浓度的Quisinostat作用后,Huh7细胞的周期蛋白Cyclin D1表达下降,而p21和p27蛋白表达明显上调。因此,笔者认为Quisinostat可通过诱导p21和p27蛋白的表达,抑制Cyclin D1蛋白,达到周期阻滞。
为明确Quisinostat诱导凋亡机制,笔者检测了凋亡效应蛋白的改变。在不同浓度的Quisinostat的作用下,随着凋亡程度的提高,活化形式的Cleaved Caspase-9和Cleaved Caspase-3表达水平也明显增加,这些数据从分子水平证实Quisinostat激活了Cleaved Caspase-9为代表的线粒体途径。Caspase抑制剂Z-VAD-FMK抑制了Quisinostat的促凋亡作用,进一步证实了Quisinostat促凋亡作用对Caspase途径的依赖性。线粒体异常是激活Caspase效应蛋白的上游机制之一。Bcl-2家族蛋白的失衡、Bcl-2家族成员形成的线粒体跨膜通道是导致线粒体膜通透性改变及线粒体途径凋亡的重要原因[10]。本研究结果证实在Quisinostat处理肝癌细胞后,Bcl-2/BAX比率明显下降。p53蛋白是线粒体途径凋亡上游重要调控因子,笔者发现Quisinostat处理肝癌细胞后,p53蛋白表达明显增加。p53过度表达能抑制Bcl-2,且活化BAX,导致凋亡。因此,笔者认为p53信号通路激活,线粒体凋亡相关蛋白失衡,是Quisinostat诱导肝癌细胞凋亡的重要机制。

表4 不同浓度Quisinostat组Huh7细胞凋亡相关蛋白表达水平比较
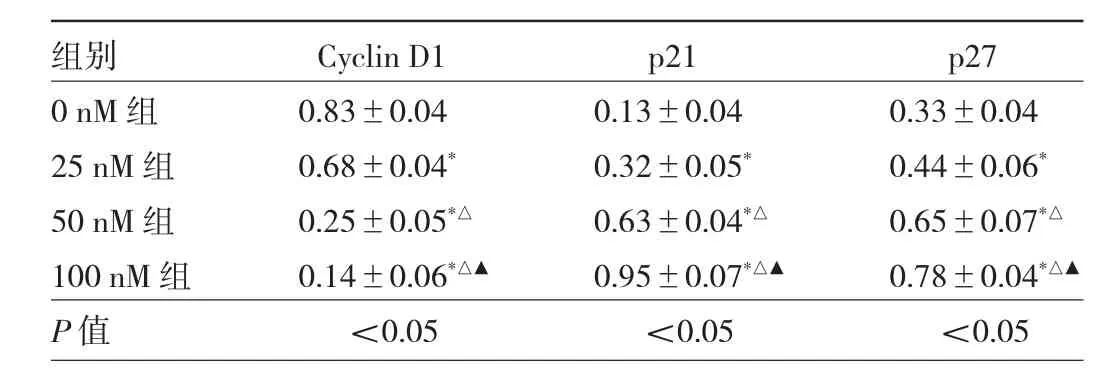
表5 不同浓度Quisinostat组Huh7细胞周期相关蛋白表达水平比较
综上所述,Quisinostat在体外能有效抑制肝癌细胞生长,它有潜力成为治疗肝癌的药物。但目前还有较多未知问题需要进一步研究。首先,Quisinostat对其他信号分子的作用需深入明确;其次,Quisinostat对肝癌细胞侵袭、迁移和血管新生的作用需进一步阐明。相信对Quisinostat的深入研究,将为肝癌治疗提供新的药物选择。
