平均血小板体积/淋巴细胞比值与冠心病经皮冠状动脉介入治疗术后长期死亡率的关系:一项队列研究
2021-01-22宋风华郑颖颖唐俊楠郭倩倩张建朝程梦蝶蒋丽珠王凯刘志煜柏岩张金盈
宋风华 郑颖颖 唐俊楠 郭倩倩 张建朝 程梦蝶 蒋丽珠王凯 刘志煜 柏岩 张金盈
1郑州大学第一附属医院心血管内科(郑州450052);2河南省心脏损伤修复重点实验室(郑州450052)
冠状动脉粥样硬化性心脏病(coronary heart disease,CHD)是以冠状动脉发生粥样硬化导致血管狭窄或闭塞,心肌缺血缺氧或坏死而引起的心脏病。冠状动脉粥样硬化既往多见于40 岁以上中老年人,近年来患者有呈年轻化的趋势。中国心血管病死亡率居首位[1],高于肿瘤及其他疾病。经皮冠状动脉介入治疗(percutaneous coronary interven⁃tion,PCI)是冠心病的重要治疗手段之一,随着PCI 手术量日益增加,医护人员需要更多廉价、易得、有效的预测因子,用于冠心病PCI 术后患者的管理。冠状动脉粥样硬化的发病机制十分复杂,目前已知的粥样斑块破裂、炎症反应及血栓形成起着重要作用[2]。近年来已有研究表明血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)与冠心病的诊断、严重性及预后具有显著的相关性[3-4]。平均血小板体积(mean platelet volume,MPV)代表单个血小板的平均容积,既能反映骨髓中巨核细胞增生、代谢以及血小板的生成状况,又能够显示循环中血小板寿命,较血小板计数更能代表血小板活性[5]。本研究通过单中心、大样本的队列研究,探讨平均血小板体积与淋巴细胞比值(mean platelet volume to lymphocyte ratio,MPVLR)与冠心病PCI 术后长期死亡率的相关性,以便发现更多廉价、易得、可靠的冠心病PCI 术后长期预后的预测因子。
1 资料与方法
1.1 研究对象本研究为单中心、大样本的回顾性队列 研究,选择2013年1月至2017年12月就诊于郑州大学第一附属医院心内科行PCI 术的冠心病患者3 561 例。纳入标准:于我院行冠脉造影(CAG)证实至少有一支冠脉血管狭窄> 50%,并成功植入1 枚及以上药物洗脱支架的患者。排除标准:合并严重的心脏瓣膜性疾病,甲亢性心脏病、慢性肺源性心脏病、梗阻性肥厚性心肌病、肝肾功能不全、风湿免疫性疾病、肿瘤、血液系统疾病、严重的血栓及出血倾向,既往心功能不全、PCI 术、冠脉旁路移植术(CABG)病史,以及临床资料和随访资料不全者。最终有3 472例患者纳入研究。本研究已在中国临床试验注册中心注册(ChiCTR1800019699),符合《赫尔辛基宣言》,并经郑州大学第一附属医院伦理委员会批准。
1.2 资料收集记录患者年龄、性别、心率、吸烟饮酒史、高血压、糖尿病病史,所有患者均于入院次日采集清晨空腹血,收集患者血糖、高密度脂蛋白(high density lipoprotein HDL⁃C)、低密度脂蛋白(low density lipoprotein LDL⁃C)、甘油三酯(triglycer⁃ide TG)、总胆固醇(total cholesterol TC)、尿素、尿酸、肌酐、MPV、淋巴细胞计数等血清生物学指标,所有检验均由我院检验科完成。
1.3 随访电话随访截止到2019年6月,最长至PCI 术后7年,观察的主要终点为长期死亡率包括全因死亡和心源性死亡,次要终点为主要心血管不良事件(major adverse cardiac events,MACE)、主要心脑血管不良事件(major adverse cardiovascular and cerebrovascular events,MACCE)。MACE 定义为心血管死亡、再发心肌梗死和靶血管重建,MACCE定义为MACE 加卒中。
1.4 统计学方法采用SPSS 22.0统计软件进行分析,符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验。计数资料以百分率表示,组间比较采用χ2检验,采用ROC 曲线评价MPVLR 预测PCI 术后死亡率价值,通过Kaplan⁃Meier 法估测并绘制生存曲线,并通过Log⁃rank 法比较两组曲线之间的差异。采用多因素Cox 比例风险回归模型检测终点事件的预测因子。Cox 多因素回归模型纳入的协变量包括患者年龄、性别、肌酐、甘油三酯、总胆固醇、低密度脂蛋白,以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料特征本研究共纳入3 472例冠心病PCI 术后的患者,平均随访时间:(37.59±22.24)个月。根据ROC 曲线确定MPVLR 预测冠心病PCI术后患者长期死亡率的最佳临界值为5.69,根据临界值水平将分为低MPVLR(淋巴细胞< 5.69,n=2 433)和高MPVLR(淋巴细胞≥5.69,n=1 039)。两组一般临床资料比较,高血压、糖尿病史、平均心率、吸烟、饮酒史、尿素、尿酸、HDL⁃C 水平比较,差异均无统计学意义(P> 0.05)。两组之间在年龄、性别、肌酐、TG、TC 和LDL⁃C 指标之间差异有统计学意义(P<0.05)。见表1。
表1 低MPVLV 和高MPVLV 一般临床特征的比较Tab.1 Characteristics of participants in two groups±s
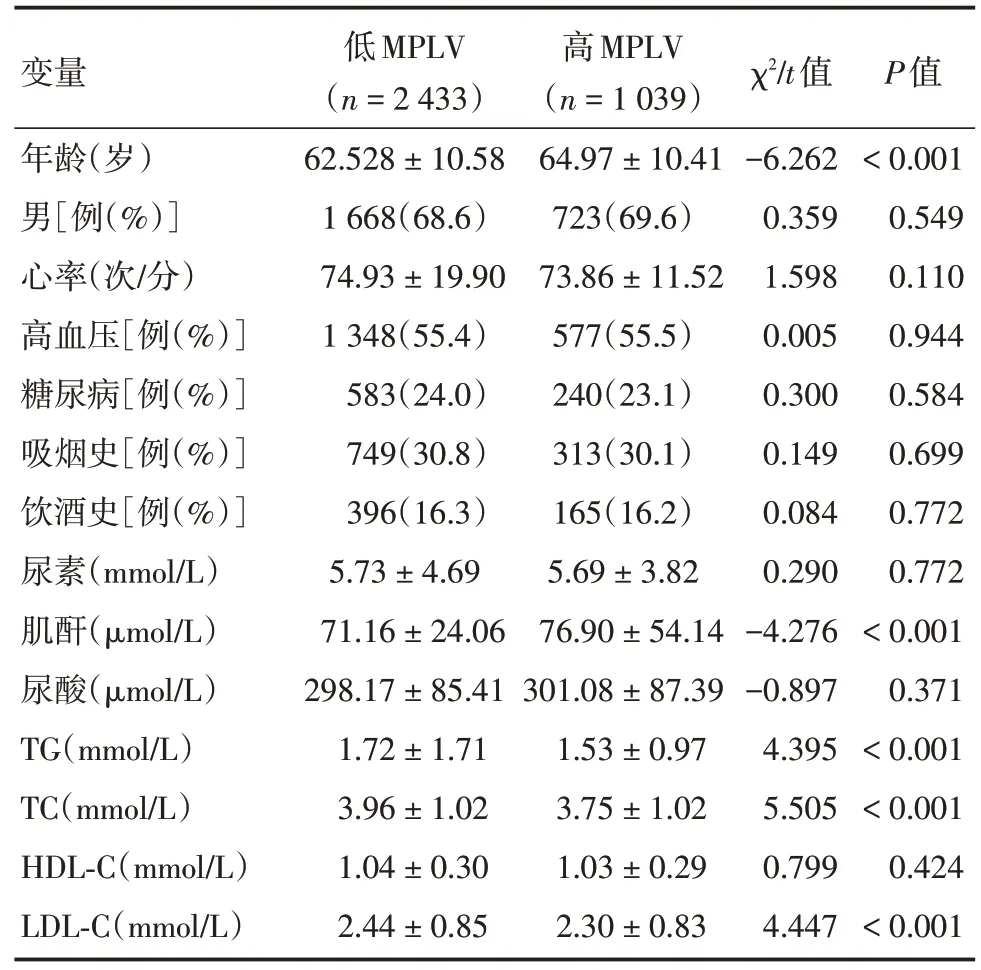
表1 低MPVLV 和高MPVLV 一般临床特征的比较Tab.1 Characteristics of participants in two groups±s
注:HDL⁃C 为高密度脂蛋白;LDL⁃C 为低密度脂蛋白;TG 为甘油三酯;TC 为总胆固醇
变量年龄(岁)男[例(%)]心率(次/分)高血压[例(%)]糖尿病[例(%)]吸烟史[例(%)]饮酒史[例(%)]尿素(mmol/L)肌酐(μmol/L)尿酸(μmol/L)TG(mmol/L)TC(mmol/L)HDL⁃C(mmol/L)LDL⁃C(mmol/L)低MPLV(n=2 433)62.528±10.58 1 668(68.6)74.93±19.90 1 348(55.4)583(24.0)749(30.8)396(16.3)5.73±4.69 71.16±24.06 298.17±85.41 1.72±1.71 3.96±1.02 1.04±0.30 2.44±0.85高MPLV(n=1 039)64.97±10.41 723(69.6)73.86±11.52 577(55.5)240(23.1)313(30.1)165(16.2)5.69±3.82 76.90±54.14 301.08±87.39 1.53±0.97 3.75±1.02 1.03±0.29 2.30±0.83 χ2/t值-6.262 0.359 1.598 0.005 0.300 0.149 0.084 0.290-4.276-0.897 4.395 5.505 0.799 4.447 P值<0.001 0.549 0.110 0.944 0.584 0.699 0.772 0.772<0.001 0.371<0.001<0.001 0.424<0.001
2.2 低MPVLR 和高MPVLR 临床预后的比较高MPVLR 组全因死亡率、心源性死亡率均明显高于低MPVLR 组,差异具有统计学意义(P< 0.01)。高MPVLR 组与低MPVLR 组相比PCI 术后MACE、MACCE 无明显差异(P> 0.05),见表2。Kaplan⁃Meier 生存分析也显示随着随访时间的增加,高MPVLR 组的心源性死亡率及全因死亡率均高于低MPVLR 组,见图1。

图1 心源性死亡及全因死亡累积发生率Kaplan⁃Meier曲线Fig.1 Cumulative Kaplan⁃Meier estimates of the time to the first adjudicated occurrence of CM and ACM
2.3 多因素Cox 回归分析Cox 多因素回归分析模型纳入的协变量包括患者年龄、性别、肌酐、TG、TC、LDL⁃C,显示:高MPVLR 仍然是冠心病患者PCI 术后长期心源性死亡(HR= 1.630,95%CI:1.020 ~2.640,P< 0.05)及全因死亡(HR= 1.579,95%CI:1.093 ~2.281,P<0.05)的独立危险因素,见表3、4。
3 讨论
本研究是一项单中心、大样本的队列研究,探讨MPVLR 与冠心病患者PCI 术后长期死亡率的关系。结果发现高MPVLR 组患者心源性死亡率(3.7%vs. 1.8%,P= 0.001)及全因死亡率(5.6%vs.3.0%,P<0.001)较低MPVLR 组患者明显升高,但MACE(10.8%vs. 11.5%,P= 0.512)及MCAAE(13.8%vs.15.2%,P=0.272)未见差异。
许多生物学标志物都被证实对于冠心病患者预后具有一定的预测价值,如PLR、中性粒细胞与淋巴细胞比值(neutrophil to lymphocytes ratio,NLR)单核细胞与淋巴细胞比值(monocyte to lymphocytes ratio,MLR)等[3,6-7]。血小板作为炎症反应与血栓形成的重要枢纽之一,可促进动脉粥样硬化和血栓形成[8-9]。MPV代表外周血中平均血小板体积,比血小板计数更能代表血小板的活性。既往研究[10]已证实MPV 升高与冠心病患者狭窄程度成正相关。荟萃分析[11]也表明,在PCI患者中高MPV与MACCE事件具有显著的相关性。HUDZIK 等[12]在2016年首次使用MPV 代替血小板计数,发现MPVLR 对于急性心肌梗死患者短期及长期死亡率有一定的预测价值,并且在长期死亡率的预测上要更优于PLR。目前的研究仅限于MPVLR 对ACS 患者预后或PCI 术后无复流的相关性[13-14],缺乏MPVLR 与经PCI 治疗的冠心病患者长期预后相关性的研究。本研究首次发现高MPVLR 组患者的心源性死亡与全因死亡均较低MPVLR 组明显升高。冠心病患者出现预后不良事件的原因主要是炎症和血栓形成[15]。该过程主要淋巴细胞等多种炎症细胞以及血小板的参与[16]。高MPVLR 组患者全因死亡及心源性死亡率升高的原因可能是大体积的血小板可以产生更多的血管活性因子及凝血因子,释放更多的血栓素,缩血管物质及黏附因子等,同时减少抑制血小板聚集及释放的物质,促进了冠脉血栓形成及动脉的粥样硬化[17-18]。同时淋巴细胞降低也会增加动脉粥样硬化斑块的不稳定性,斑块破裂风险会随之增加[19-20]。低淋巴细胞早已被证实可作为冠心病患者入院时冠脉粥样硬化严重程度的独立预测指标,并且在冠心病患者的临床随访中与MACE 有关[21-23]。既往有研究[12,14]发现,MPVLR 与急性ST 段抬高型心肌梗死(acute ST⁃segment elevation myocardial infarction STEMI)患者短期死亡率以及随访12个月的MACCE有关。但也有研究表明MPV 与稳定性冠心病患者2年的MACCE 无关[24]。本研究对于经PCI 治疗的冠心病患者后进行了更长时间的随访,最长至术后7年,并未发现高MPVLR 组与低MPVLR 组患者长期MACE 及MACCE 具有明显差异。有关MPV及MPVLR 对冠心病患者预后的预测价值,未来仍需大规模前瞻性研究进一步论证。
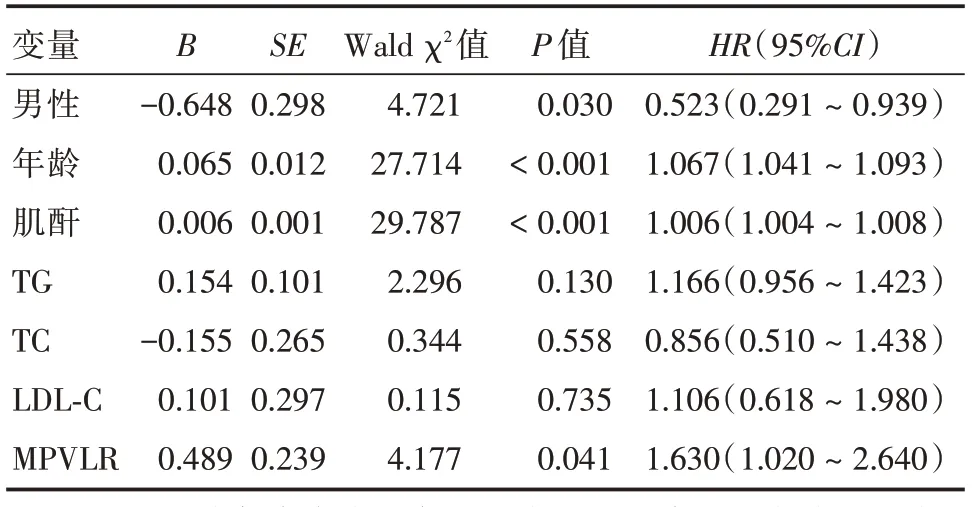
表3 冠心病PCI 术后心源性死亡预测因素的Cox 多因素回归分析Tab.3 Multivariable Cox regression analysis for cardiac mortality
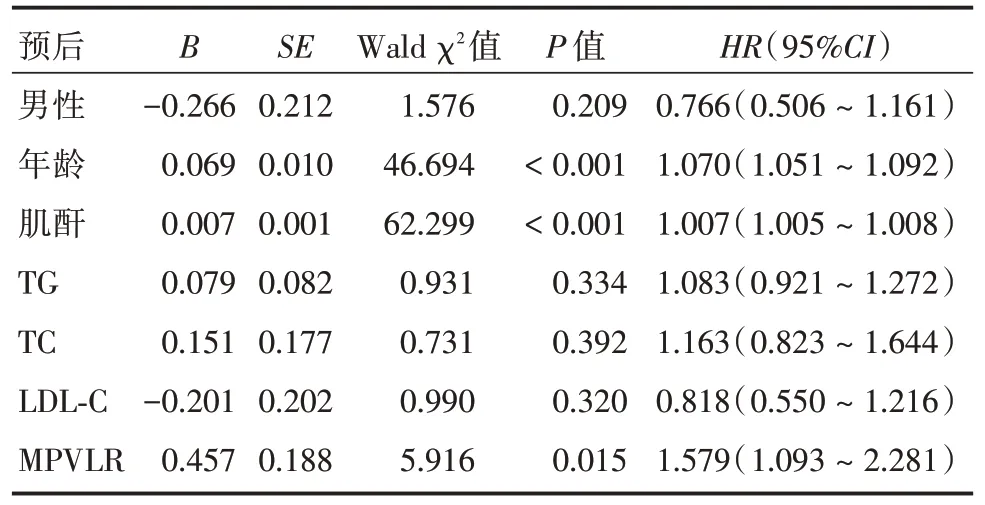
表4 冠心病PCI 术后全因死亡预测因素的Cox 多因素回归分析Tab.4 Multivariable Cox regression analysis for all⁃cause mortality
在本研究中,高MPVLR 组患者年龄更大,且差异具有统计学意义,这与年龄与MPV 成正相关的研究结论是一致的[25]。体积较大的血小板较正常形态的血小板聚集和黏附的作用更强,血栓形成的风险更大[26]。同时高龄患者本身就存在较高的血小板聚集倾向,即使PCI 术后接受P2Y12 受体拮抗剂治疗,也不能降低患者的MPV[27],血小板聚集率仍然较高[28]。有研究[29]表明肾功能不全可能加重冠心病的严重程度,但此类患者的MPV升高并不能解释冠心病严重程度增加的原因。本研究排除了肾功能不全的患者,发现在肾功能正常患者中,高MPVLR 组患者肌酐水平更高。由此肌酐水平可能是肾功能正常的冠心病患者预后又一重要预测因素。但在冠心病患者的肌酐水平与MPVLR 的关系仍需进更多的研究进一步论证。在Cox 多因素回归分析纳入了两组患者具有明显差异的协变量后,高MPVLR 与PCI 治疗后患者的长期心源性死亡及全因死亡率仍具有显著的相关性。
本研究仍具有一定的局限性,首先这是一项单中心的回顾性研究,可能产生选择偏倚。其次缺乏对血小板功能的检测。且本研究只探讨入院首次MPVLR 的数值,对于随访期间患者MPVLR 的波动与长期死亡率的关系需要进一步的探究。
综上,本研究首次发现平均血小板体积与淋巴细胞比值对于冠心病患者PCI 术后的长期死亡率有重要的预测价值,这有望成为冠心病患者PCI术后长期预后的又一简单、易得、有效、便捷的预测指标。
