灯盏花素通过调节PINK1/Parkin信号通路介导的线粒体功能诱导人宫颈癌HeLa 细胞凋亡
2021-01-22王婧杨雯涂琦江坚青
王婧 杨雯 涂琦 江坚青
华中科技大学同济医学院附属武汉儿童医院,武汉市妇幼保健院产科(武汉430040)
宫颈癌的耐药性导致临床治疗效果差,成为发展中国家宫颈癌发病率高、病死率高的主要原因[1-2]。因此,寻找有效的宫颈癌治疗方法迫在眉睫。灯盏花素是首次从石胡荽中提取的倍半萜内酯,具有抑制多种肿瘤细胞增殖的作用[3-5]。以往的研究表明,灯盏花素的抗肿瘤活性与破坏线粒体氧化还原状态的稳态有关[6]。然而,灯盏花素在宫颈癌中的详细机制仍需进一步研究。最近研究[7]表明,PTEN 诱导假定激酶1(PTEN⁃induced putative kinase 1,PINK1)/E3 泛素连接酶(E3 ubiq⁃uitin protein ligase,Parkin)介导的有丝分裂在线粒体功能障碍和细胞凋亡中起重要作用,并且已有研究阐明了PINK1 在多种癌细胞中的作用。因此,本研究探讨了灯盏花素对HeLa 细胞增殖、凋亡、ROS 产生和线粒体功能障碍的作用及其潜在的分子机制是否与PINK1/Parkin 信号通路有关。
1 材料与方法
1.1 细胞培养与试剂人宫颈癌细胞系HeLa购自美国ATCC 公司和人正常宫颈上皮细胞(HcerEpic)购自广州莱德尔生物科技有限公司。将这些细胞接种在含有10%胎牛血清和1%青霉素链霉素的Dulbecco 改良的Eagle′s 培养基(DMEM,均购自美国Gibco 公司)中培养。灯盏花素(纯度> 98%)购自美国Sigma Aldrich 公司。
1.2 MTT试验将HeLa细胞接种于96孔板(3 000个/孔)中。经过各种处理后,用含有MTT(0.5 mg/mL)的培养基代替细胞培养基。培养4 h 后,取上清液,加入150 μL 二甲基亚砜。测定570 nm 处的吸光度。
1.3 细胞凋亡分析收集HeLa 细胞,用70%乙醇在4 ℃下固定2 h,然后照细胞周期和凋亡分析试剂盒(上海碧云天生物技术有限公司)说明进行染色。用流式细胞术分析染色细胞。
1.4 乳酸脱氢酶(lactate dehydrogenase,LDH)释放测定为了进行LDH 测定,将每个样品的上清液与NADH 和丙酮酸盐在37 ℃孵育15 min,然后加入0.4 mol/L NaOH 终止反应。测定490 nm 处的吸光度计算LDH 活性。
1.5 ROS 生成的测定使用DCFH⁃DA 荧光探针(上海凯根生物科技有限公司)检测细胞内ROS的产生。将细胞与DCFH⁃DA 在37 ℃黑暗中染色30 min。通过共焦显微镜检测绿色荧光强度。
1.6 ATP 合成的测量通过MAK190 ATP 检测试剂盒(美国Sigma⁃Aldrich 公司)测定HeLa 细胞中的ATP 合成。将HeLa 细胞进行裂变,离心5 min,将100 μL 上清液与100 μL 的ATP 工作稀释液混合。测定340 nm 处的吸光度。
1.7 线粒体肿胀的测定用线粒体分离试剂盒(美国Thermo Scientific 公司)分离线粒体。首先,用胰蛋白酶处理细胞,离心,将分离的线粒体悬浮在新鲜的溶胀缓冲液中,浓度为0.5 mg/mL。加入CaCl2(200 μmol/L),并通过监测540 nm 处的吸光度在20 min 内变化计算线粒体的肿胀。
1.8 短干扰RNA(siRNA)和转染靶向特异PINK1⁃siRNA 慢病毒(Si⁃PINK1,序列:5′⁃ACATAACGAA⁃TCACTCGTTAT GA⁃3′)和对照siRNA(Si⁃NC,序列:5′⁃GACGTGGAACGTTCTTCATTTTT⁃3′)购自美国Santa Cruz 公司。使用Lipofectamine 2000(美国Invitrogen 公司)在6 孔板中进行瞬时转染。转染48 h 后,收集细胞用于实验。
1.9 Western blot分析用RIPA裂解缓冲液从HeLa细胞中提取总蛋白,然后通过电泳分离转移到聚偏二氟乙烯膜上。用5%脱脂牛奶封闭1 h后,将膜与一抗Parkin(1∶500),Bax(1∶500),Bcl⁃2(1∶1 000),PINK1(1∶800),Cleaved caspase⁃3(1∶1 000),Cyt C、Cyto Cyt C、Mito Cyt C(1∶1 000)或β⁃actin(1∶2 000,均购自美国Cell Signaling 公司)在4 ℃下孵育过夜。然后,将膜洗涤并与抗小鼠或抗兔二抗在室温下孵育1 h。用ECL Plus 可视化蛋白质条带。
1.10 统计学方法使用GraphPad Prism 5.0 软件进行统计分析。组间比较采用单因素方差分析和t检验进行。当P< 0.05 时,认为差异有统计学意义。
2 结果
2.1 灯盏花素抑制宫颈癌细胞的存活并诱导其凋亡如图1A 和B 所示,灯盏花素以时间和剂量依赖性方式显示出对细胞活力的显著抑制作用(P<0.001),并且处理24 h 的抑制效果好于12 h。然而,灯盏花素对正常人细胞HcerEpic 的细胞毒性很小,低于HeLa(IC50=112.1 nmol/L)细胞(图1C)。LDH 测定表明,在相同处理条件下,HeLa 细胞的LDH 泄漏量显著增加(P<0.01)(图1D)。此外,用灯盏花素治疗24 h后,凋亡细胞数量明显增加,呈剂量依赖性(图1E)。与对照组相比,用120 nmol/L 灯盏花素治疗可显著提高凋亡细胞百分率(16.8 倍)(P<0.001)。
2.2 灯盏花素诱导宫颈癌细胞氧化应激和线粒体功能障碍如图2A 和B 所示,与对照组相比,随着灯盏花素浓度的增加,绿色荧光强度逐渐增强(增加百分率分别为145%、184%和231%)。在灯盏花素处理的细胞中观察到ATP 生成减少(减少百分率分别为85%、62%和41%)(图2C)。此外,随着灯盏花素浓度的增加,HeLa 细胞线粒体肿胀逐渐增加,表现为吸光度降低。
2.3 灯盏花素对线粒体功能障碍的特异性蛋白表达影响在HeLa 细胞中,Bax/Bcl⁃2 的比例、Cyt C和Cleaved caspase⁃3 随灯盏花素浓度的增加而上调。同时,灯盏花素处理后,Cyto Cyt C 的释放显著增强(P< 0.01),而Mito Cyt C 的水平明显降低(P<0.01)(表1)。
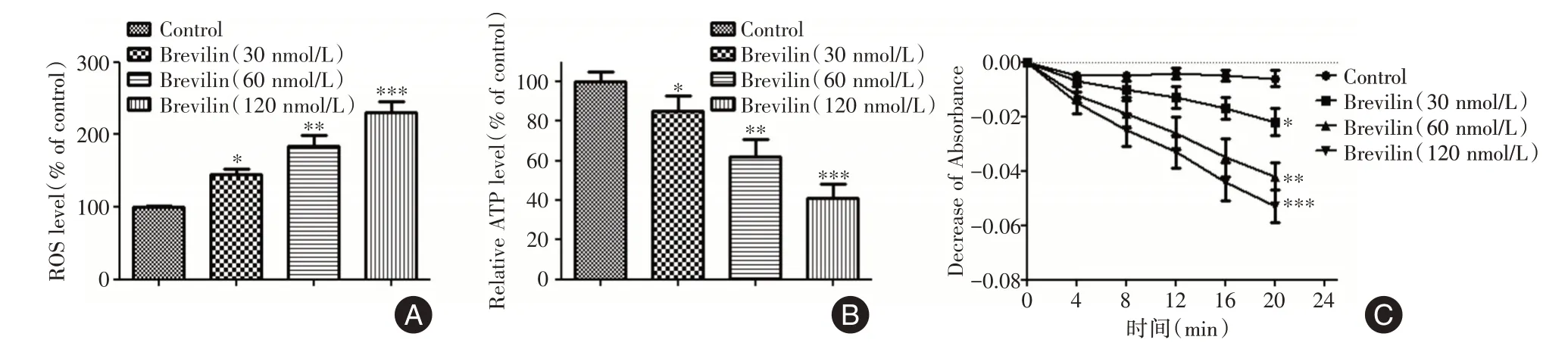
图2 灯盏花素诱导宫颈癌细胞氧化应激和线粒体功能障碍Fig.2 Brevilin induces oxidative stress and mitochondrial dysfunction in cervical cancer cells
2.4 灯盏花素抑制宫颈癌细胞中的PINK1/Parkin途径Western blot 分析(图3A⁃B)显示,与对照组相比,灯盏花素治疗后PINK1(减少百分率分别为84%、61%和38%)和Parkin(减少百分率分别为80%、54%和31%)蛋白表达水平显著降低(P<0.01)。进一步研究发现,通过PINK1 敲低上调了HeLa 细胞 中Bax/Bcl⁃2 比 例、Cleaved caspase⁃3、Cyt C 和Cyto Cyt C 蛋白表达,并下调了Mito Cyt C蛋白表达,表明抑制PINK1 表达有助于Cyt C 从线粒体释放到细胞质中(图3C)。此外,功能学评价显示,PINK1 敲低显示出对HeLa 细胞活力的显著抑制作用(降低百分率为49%),并提高凋亡细胞百分率和ROS(增加百分率为221%)的产生(图3D⁃F)。
表1 灯盏花素对线粒体功能障碍的特异性蛋白表达影响Tab.1 Effect of brevilin on specific protein expression of mitochondrial dysfunction±s
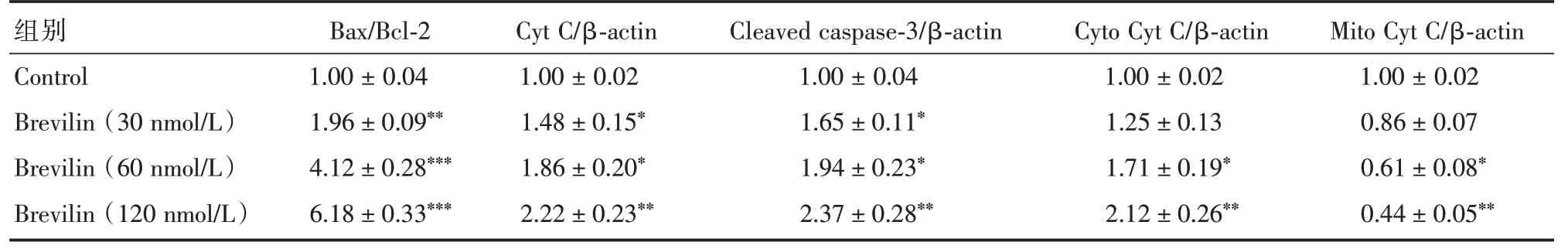
表1 灯盏花素对线粒体功能障碍的特异性蛋白表达影响Tab.1 Effect of brevilin on specific protein expression of mitochondrial dysfunction±s
注:与对照组相比,*P<0.05,**P<0.01,***P<0.001
Bax/Bcl⁃2Cyt C/β⁃actin Cleaved caspase⁃3/β⁃actin Cyto Cyt C/β⁃actin Mito Cyt C/β⁃actin 组别Control Brevilin(30 nmol/L)Brevilin(60 nmol/L)Brevilin(120 nmol/L)1.00±0.04 1.96±0.09**4.12±0.28***6.18±0.33***1.00±0.02 1.48±0.15*1.86±0.20*2.22±0.23**1.00±0.04 1.65±0.11*1.94±0.23*2.37±0.28**1.00±0.02 1.25±0.13 1.71±0.19*2.12±0.26**1.00±0.02 0.86±0.07 0.61±0.08*0.44±0.05**

图3 灯盏花素抑制宫颈癌细胞中的PINK1/Parkin 途径Fig.3 Brevilin inhibits PINK1/Parkin pathway in cervical cancer cells
3 讨论
本研究发现,灯盏花素在正常HcerEpic 细胞中具有低细胞毒性,而在Hela 细胞中具有时间和剂量依赖性的抗癌作用。先前的研究[8-9]报道,灯盏花素对三阴性乳腺癌细胞的细胞毒性高于对正常细胞系的细胞毒性。据报道[10],天然化合物对癌细胞的抑制作用与细胞凋亡有关。本研究中,灯盏花素有效促进了Hela 细胞凋亡。在大多数癌细胞中,ROS 的过度产生是典型的凋亡现象[11-12]。HeLa 细胞暴露于灯盏花素后,ROS 水平升高并呈剂量依赖性,这导致LDH 的高释放速率和脂质过氧化程度。此外,细胞凋亡是由多种凋亡相关基因调控的细胞程序性死亡,越来越多的证据支持线粒体信号通路在天然化合物触发的细胞凋亡中起关键作用[13-14]。Bax、Bcl⁃2 等凋亡蛋白改变了线粒体膜通透性,释放Cyt C,激活Caspase⁃3,导致细胞凋亡[9]。本研究中,HeLa 细胞暴露于灯盏花素会导致Bax/Bcl⁃2 比例上调,并且Cyt C 从线粒体到细胞质的释放量增加以及Caspase⁃3 级联被激活,进而诱导HeLa 细胞凋亡。这些结果表明线粒体信号通路介导了灯盏花素诱导的HeLa 细胞凋亡。
最近的研究[15-19]证实,PINK1/Parkin 信号通路在线粒体功能障碍和细胞凋亡中起枢轴作用。YAO 等[16]证明,敲低PINK1 可以显著抑制宫颈癌细胞的癌相关表型并阻断细胞周期进程。此外,在宫颈癌中,PINK1 表达增加,促进癌细胞恶性增殖和化疗耐药[20]。本研究中,灯盏花素治疗后PINK1 和Parkin 蛋白表达水平较对照组显著降低。此外,PINK1 基因敲除与灯盏花素治疗产生了类似的体外活性结果。所有这些数据表明灯盏花素介导的线粒体功能诱导人宫颈癌HeLa 细胞凋亡至少部分归因于PINK1/Parkin 途径抑制。
综上所述,灯盏花素治疗抑制了PINK1/Parkin通路,从而抑制HeLa 细胞活力,提高凋亡细胞百分率和促进ROS 产生。这些数据支持灯盏花素成为一种新的抗宫颈癌药物。
