miR⁃17⁃5p通过下调肌球蛋白调节轻链相互作用蛋白促进结直肠癌细胞增殖和转移的机制研究
2021-01-22凌旭坤谢文鸿张喆胡琛
凌旭坤 谢文鸿 张喆 胡琛
惠州市中心人民医院胃肠外科(广东惠州516200)
结直肠癌(colorectal cancer,CRC)是严重威胁全球人群健康的主要公共卫生问题之一,在男女性高发肿瘤中常年位居前3 位,且男性的发病率明显高于女性[1]。许多研究表明[2-3],CRC 的发展与肿瘤细胞的恶性增殖和转移有关。因此,探讨CRC增殖和转移的分子机制对其临床治疗十分关键。
miRNA 的异常表达被证明与肿瘤细胞的增殖和转移密切相关,其可靶向下游mRNA,调控肿瘤的发展进程[4-6]。研究表明,miR⁃17⁃5p 与肿瘤的发生发展相关[7-9]。但miR⁃17⁃5p 在CRC 中的作用机制仍有待探讨。肌球蛋白调节轻链相互作用蛋白(myosin regulatory light chain interacting protein,MYLIP)参与细胞运动和迁移的调节[10-11]。通过生物信息学网站预测得知MYLIP 是miR⁃17⁃5p 的潜在靶基因,然而,目前还没有关于MYLIP 在CRC 发展过程中的重要作用的研究,因此,本文将探讨miR⁃17⁃5p 调控MYLIP 表达的潜在机制及其在CRC 增殖及转移中的作用,为寻找CRC 的有效治疗靶点探索新的道路。
1 材料与方法
1.1 组织标本、细胞系及主要试剂收集2017年12月至2018年1月在惠州市中心人民医院切除的60 例CRC 患者的癌及癌旁组织标本。研究方案征得医院伦理委员会批准。CRC 细胞系SW620(货号:ATCC CCL⁃227),Caco⁃2(货号:ATCC HTB⁃37),HT29(货号:ATCC HTB⁃38),Lovo细胞(货号:ATCC CCL⁃229)及结肠上皮细胞FHC(货号:ATCC CRL⁃1831)均购买自美国ATCC 公司。胎牛血清、RPMI⁃1640培养基购自美国Gibco公司,miR⁃17⁃5p抑制剂(miR⁃17⁃5p inhibitor)及其阴性对照(NC)和siRNAs购自上海吉玛制药技术公司,TRIzol RNA 提取试剂盒及SYBR PCR Master Mix 购自Thermo Fisher Scientific 公 司,LipofectamineTM2000转染质粒和siRNA 购自日本TaKaRa 公司,Transwell 小室购自Corning 公司,ECL 化学发光液购于美国BioRad 公司,逆转录试剂盒和双荧光素酶报告基因购自Pro⁃mega 公司,RIPA 细胞裂解液及BCA 试剂盒购于北京碧云天公司,一抗购于美国Abcam公司。
1.2 细胞培养与转染CRC细胞系SW620、Caco⁃2、HT29、Lovo 细胞和FHC 细胞分别培养在含10%胎牛血清和双抗的RPMI⁃1640 培养基中。培养条件5%CO2、37 ℃恒温箱。参照LipofectamineTM2000 转染试剂盒的说明书将培养好的miR⁃17⁃5p inhibitor及阴性对照进行瞬时转染,培养48 h 后检测其转染效率。混合转染HEK⁃293 和Lovo 细胞48 h 后进行试验。实验前期分为2 组:对照组(NC)和转染miR⁃17⁃5p 的敲降组(miR⁃17⁃5p inhibitor),实验后期分为3 组:对照组(NC),敲降MYLIP 组(si⁃MYLIP)和回复组(si⁃MYILP+miR⁃17⁃5p inhibitor)。
1.3 RT⁃qPCR检测miR⁃17⁃5p的表达TRIzol提取CRC组织和各组细胞中总RNA,测定其浓度和纯度,逆转录试剂盒合成cDNA。根据SYBR PCR Master Mix 的说明进行PCR 反应,条件为:95 ℃10 min、95 ℃15 s、58 ℃30 s,72 ℃30 s,进行30 个循环,72 ℃延伸7 min。U6为内参,2⁃ΔΔCt法计算miR⁃17⁃5p的表达(表1)。

表1 引物序列Tab.1 Primer sequence
1.4 生物信息学预测、双荧光素酶报告基因实验检测MYLIP 与miR⁃17⁃5p 的靶向关系使用生物信息学网站starBase 预测miR⁃17⁃5p 的靶基因,将miR⁃17⁃5p 的种子序列与所预测的靶基因3′⁃UTR区域进行碱基互补比对。将与miR⁃17⁃5p 具有靶向结合位点的MYLIP 片段进行PCR 扩增,构建野生型MYLIP 载体,对MYLIP 与miR⁃17⁃5p 的结合位点进行突变构建MYLIP 突变型载体。将miR⁃17⁃5p mimics 和野生或突变型MYLIP 载体转染至293T 细胞中,48 h 后,以海肾荧光素酶活性为内参,检测萤火虫荧光素酶活性。
1.5 MTT 法检测Lovo 细胞增殖活力将对数生长期CRCLovo 细胞用胰蛋白酶消化后,加入MTT液混合均匀,在37 ℃下孵育4 ~6 h 后吸出上清液,每孔加入150 μL 二甲基亚砜(DMSO)形成单细胞悬浮液并以1 × 103细胞/孔的密度接种到24 孔板中。培养7 d 后,加入20 μL DMSO,在室温下搅拌10 min 使晶体充分溶解。分别在0、24、48、72 和96 h 测定490 nm 处的OD值。
1.6 Transwell小室法检测Lovo细胞侵袭和迁移将50 mg/L 的基质胶按1∶8 的比例稀释,平铺于Transwell 小室上室,静置30 min。迁移实验不需要基质胶。收集培养的Lovo 细胞饥饿培养1 d,消化后离心,PBS 洗涤,重悬细胞并计数,按每室2 ×104个细胞的密度接种到Transwell 小室上室,将含20%胎牛血清的RPMI 1640 培养基加入下室,在37 ℃的恒温培养箱中培养24 h 后,取出小室,用棉签轻轻擦去上室表面未穿过膜的细胞,并用95%乙醇固定渗透膜,结晶紫染色,在光学显微镜下观察并计数。
1.7 Western blot检测蛋白的表达水平用PBS清洗样本组织和细胞,RIPA 裂解组织和细胞提取总蛋白,BCA 试剂盒检测蛋白纯度和浓度,用SDS⁃PAGE凝胶电泳分离蛋白,PVDF进行转膜,含5%脱脂奶粉的TBST室温封闭2 h,在4 ℃条件下加入一抗(MYLIP,1∶1 000;E⁃cadherin,1∶2 000;N⁃cadherin,1∶1 000;vimentin,1∶1 000;GAPDH,1∶1 000)孵育。次日,TBST 洗涤。加入二抗(1∶1 000),在室温环境中孵育1 h,洗膜,ECL 发光,凝胶成像系统,采集图像并对蛋白条带进行定量分析,GAPDH 作为内参,Image J 分析蛋白相对表达量。
1.8 统计学方法SPSS 16.0 和GraphPad Prism 7软件分析数据并作图,多组间比较采用单因素方差分析(ANOVA),两组间比较采用t检验,数据以表示。P<0.05或P<0.01表示差异有统计学意义。所有实验均设置3 个实验组。
2 结果
2.1 CRC组织和细胞中miR⁃17⁃5p表达上调RT⁃qPCR 结果表明,miR⁃17⁃5p 在CRC 组织中的表达水平明显高于与其相邻的癌旁组织(P< 0.05,图1A);miR⁃17⁃5p 在CRCSW620,Lovo,Caco⁃2 和HT29 细胞中的表达水平明显高于结肠上皮细胞FHC(P< 0.05,图1B),其中,miR⁃17⁃5p 在CRC Lovo 细胞中的表达水平最高,后续选取Lovo 细胞进行实验。
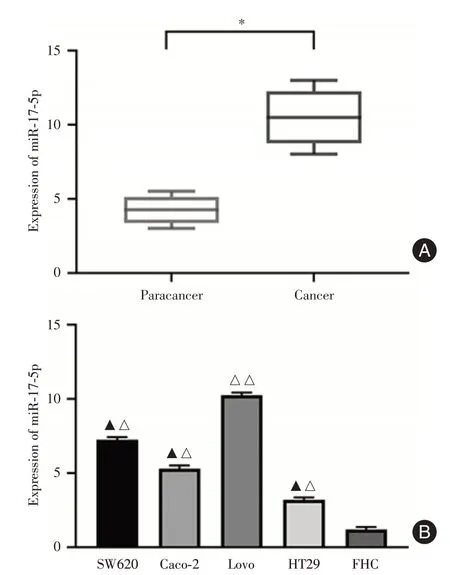
图1 CRC 组织及其细胞中miR⁃17⁃5p 的表达水平Fig.1 The expression of miR⁃17⁃5p in CRC tissues and cells
2.2 敲降miR⁃17⁃5p 抑制Lovo 细胞的增殖和转移RT⁃qPCR 检测表明,转染miR⁃17⁃5p inhibitor组中miR⁃17⁃5p的表达低于NC组(P<0.05,图2A),表明miR⁃17⁃5p inhibitor 成功转染。MTT 法检测结果显示,与NC相比,敲降miR⁃17⁃5p对Lovo细胞的增殖能力有明显的抑制(P< 0.05,图2B)。Transwell小室法检测结果显示,与NC 相比,敲降miR⁃17⁃5p明显抑制Lovo 细胞的侵袭和迁移能力(P< 0.05,图2C,D)。此外,Western blotting 检测结果表明,E⁃cadherin 表达显著高于NC 组(P< 0.05),Vimentin和N⁃cadherin 蛋白的表达则低于NC 组(P< 0.05,图2E)。由此可知,敲降miR⁃17⁃5p 抑制Lovo 细胞的增殖和转移。

图2 敲降miR⁃17⁃5p 对Lovo 细胞增殖和转移能力的影响Fig.2 The effect of knockdown of miR⁃17⁃5p on proliferation and metastasis of Lovo cells
2.3 MYLIP与miR⁃17⁃5p的靶向关系及其在CRC组织中的表达水平通过生物信息学网站starBase的预测显示(图3A),MYLIP 与miR⁃17⁃5p 存在靶向结合位点。双荧光素酶报告基因检测表明,与NC 组相比,转染miR⁃17⁃5p mimics 进入HEK293 细胞后,MYLIP 3′⁃UTR⁃WT 报告基因的相对荧光素酶活性显著下调(P<0.05),而MYLIP 3′⁃UTR⁃MUT报告基因的荧光素酶活性与NC 组相比无明显变化(P>0.05)(图3B)。Western blot 检测结果显示,与NC组相比,过表达miR⁃17⁃5p显著下调MYLIP 的表达水平(P<0.05,图3C),由此可知miR⁃17⁃5p 可以靶向调控MYLIP 的表达水平。
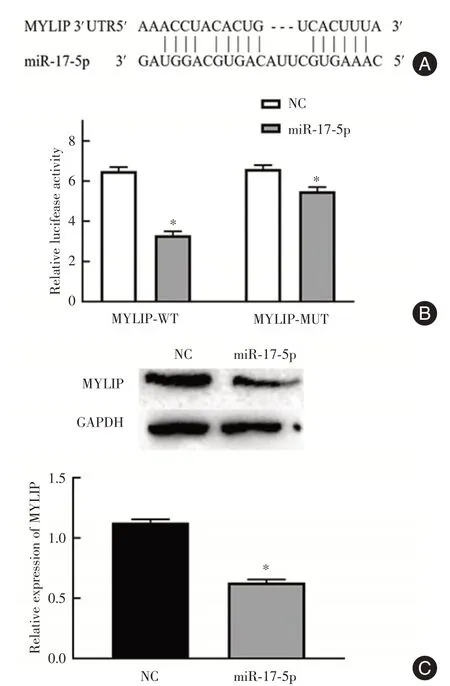
图3 miR⁃17⁃5p 靶向调控MYLIP 的蛋白表达水平Fig.3 miR⁃17⁃5p targeted regulation of MYLIP protein expression level
2.4 miR⁃17⁃5p下调MYLIP的表达促进Lovo细胞的增殖和转移Western blot结果显示,相比较于NC组,敲降MYLIP后Lovo细胞中MYLIP、N⁃cadherin 及Vimentin 蛋白水平显著下调(P< 0.05),E⁃cadherin表达显著上调(P<0.05),同时转染si⁃MYLIP+miR⁃17⁃5p inhibitor 组中MYLIP、N⁃cadherin、Vimentin 和E⁃cadherin 蛋白的表达水平与NC 组无显著差异(图4A)。MTT 法检测结果显示,与NC 相比,敲降MYLIP 对Lovo 细胞的增殖能力有明显的促进作用(P< 0.05),而同时在Lovo 细胞中转染si⁃MYLIP+miR⁃17⁃5p inhibitor 后Lovo 细胞的增殖能力与NC差异无统计学意义(图4B)。Transwell 小室法检测结果显示,与NC 相比,敲降MYLIP 显著促进Lovo细胞的侵袭和迁移能力(P< 0.01),而同时敲降MYLIP+ miR⁃17⁃5p 后Lovo 细胞侵袭和迁移能力与NC 差异无统计学意义(图4C,D)。由此可知,miR⁃17⁃5p 通过靶向下调MYLIP 来促进CRC 细胞增殖和转移。
3 讨论
CRC 是预后极差的恶性肿瘤,在世界范围内死亡率较高,每年有数百万人罹患CRC[12]。CRC主要影响直肠、乙状结肠和降结肠远端[13]。结直肠肿瘤的发生始于上皮细胞的进行性转变[14]。CRC的危险因素包括老龄化、不健康的饮食习惯、吸烟、肥胖、体育锻炼不足、胆囊溶解链球菌血症、炎症性肠病和遗传因素等。目前,CRC 的临床治疗包括手术、放疗、化疗和消融[15]。然而,由于对CRC 发展的详细机制尚不完全了解,CRC 的5年生存率较低,特别是晚期[16]。因此,更好的了解CRC发病机制对于为CRC 患者提供有效的诊断和预后策略具有重要意义。
研究[17-20]表明,异常表达miRNA 的可能是肿瘤发生和进展的重要调节因子,参与调控肿瘤的发展进程。因此,研究miRNA 在CRC 肿瘤发生中的细胞和分子机制,有助于开发新的诊断和预后生物标志物。本研究发现,miR⁃17⁃5p 在CRC 中表达升高,敲降miR⁃17⁃5p可显著抑制Lovo细胞增殖、侵袭、迁移和EMT。近来,SONG 等[21]研究发现,miR⁃17⁃5p 在胃癌患者的血浆组织中表达上调,过表达miR⁃17⁃5p可抑制细胞凋亡促进细胞增殖和侵袭,miR⁃17⁃5p可通过靶向负调控RUNX3,促进胃癌肿瘤生长;WANG 等[22]报道,miR⁃17⁃5p 在喉鳞状细胞癌组织和细胞系中异常高表达,敲降miR⁃17⁃5p 可抑制喉鳞状细胞癌细胞增殖和Bcl⁃2 表达,促进Bax 和Caspase 蛋白表达,诱导细胞凋亡。此外,miR⁃17⁃5p 也被报道作为抑癌基因调控肿瘤的发展进程,如:LIU 等[9]发现,miR⁃17⁃5p 在甲状腺癌组织和细胞中下调,可逆转Lnc HOTAIR 的敲低对甲状腺癌细胞活力、侵袭和迁移的抑制作用。
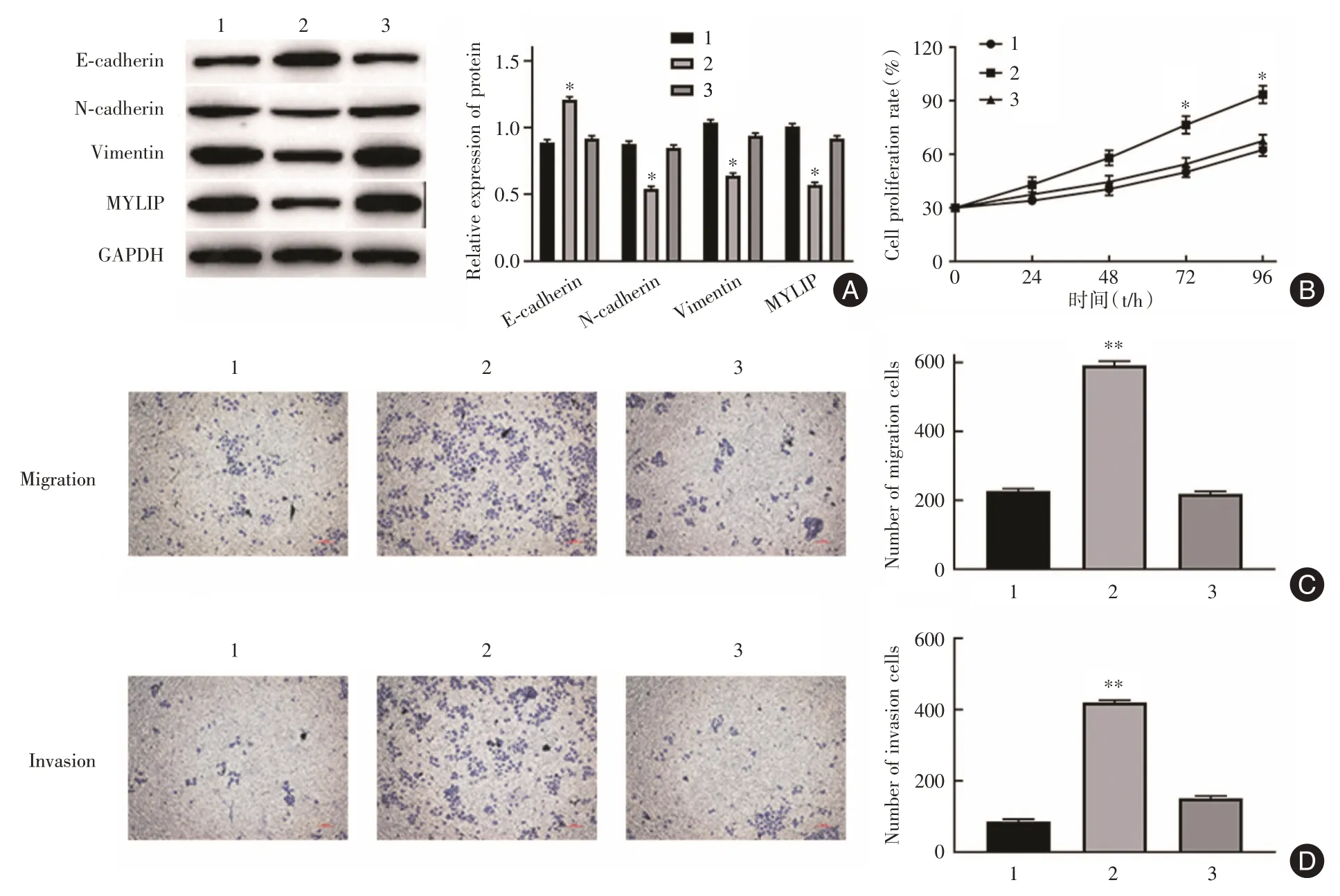
图4 miR⁃17⁃5p 靶向下调MYLIP 对Lovo 细胞增殖和转移的影响Fig.4 The effect of miR⁃17⁃5p on proliferation and metastasis of Lovo cells by targeting down⁃regulation of MYLIP
MYLIP 通过细胞膜蛋白与肌球蛋白细胞骨架的相互作用,在维持细胞形态、调节细胞运动、重塑细胞骨架蛋白以及细胞与细胞外基质的粘附中起着关键作用[11]。此外,MYLIP可以通过与细胞粘附分子的密切相互作用,对细胞的扩展、生长、分化和迁移具有重要影响[23]。一旦这些细胞粘附分子中出现蛋白表达水平或基因突变,细胞间的接触和连接就会发生改变,细胞会变得更松散而分散,从而促进肿瘤细胞的迁移、侵袭和转移[24]。笔者通过生物信息学网站预测发现,MYLIP 是miR⁃17⁃5p 的潜在靶基因,敲降miR⁃17⁃5p 靶向上调MYLIP,抑制CRC细胞的增殖和转移。此外,ZHAO等[25]发现,MYLIP 在乳腺癌患者中表达降低,过表达miR⁃19b 靶向下调MYLIP 的表达,促进乳腺癌生长和转移;在前列腺癌中,CNPY2 通过抑制通过MYLIP 介导的AR 泛素化作用的雄激素受体(AR)蛋白降解,促进前列腺癌的细胞生长[10]。然而,本研究结果并不能排除其他下游目标也可能受到miR⁃17⁃5p 影响的可能性。此外,MYLIP 在抑制增殖机制中的作用还有待进一步探索。
综上可知,miR⁃17⁃5p 在CRC 中表达升高,敲降miR⁃17⁃5p 可靶向上调MYLIP 的表达,抑制Lovo细胞增殖和转移。
