万古霉素/PLGA/TCP多孔复合材料修复羊感染性骨缺损
2021-01-22许刚何纯青张飞克里木尹东峰吾木尔刘剑贾勇
许刚 何纯青 张飞 克里木 尹东峰 吾木尔 刘剑 贾勇
新疆军区总医院1全军骨科中心创伤骨科(关节组),2药剂科(乌鲁木齐830000)
近年来,随着工业的发展,越来越多的工伤、车祸伤以及术后继发感染导致的感染性骨缺损愈发常见,尤其以合并慢性骨髓炎的感染性骨缺损的治疗一直是骨科领域中的一大难题[1]。针对慢性骨髓炎的治疗,目前临床上在一期清创后会植入混合抗生素的骨水泥(polymethyl methacrylate,PMMA)珠链作为间置器,其在填充死腔及骨缺损的同时可通过释放抗生素来控制感染。但因其无法降解,2~3月后如感染得到完全控制,则需行二期手术取出骨水泥珠链,安装外固定架进行骨搬运治疗骨缺损[2]。但该方案将导致患者面临治疗周期长、手术次数多、医药花费高等情况,这将对患者造成沉重的负担。因此,是否能研制出一种既具有抗感染效果,又具有良好生物降解性的骨移植材料,在有效控制感染的同时又可不断降解,为同时进行的骨修复提供充足的空间,这已成为当前骨科领域的研究热点之一。研究表明,利用聚乳酸⁃羟基乙酸[poly(lactic⁃co⁃glycolic acid),PLGA]与磷酸三钙(tricalcium phosphate,TCP)构建的复合多孔支架材料具有良好的生物相容性和降解性,并且还具有一定的生物力学支撑性[3-4]。但因传统的增材制造打印法工作温度高,无法将抗生素添加进材料中,导致该类材料不具有抗感染效果,无法应用于感染性骨缺损的治疗中[5]。
然而,低温3D 打印技术的出现,使得抗生素在打印墨水中的添加成为了可能。3D 打印技术是利用计算机辅助设计(computer aided design,CAD)和计算机辅助制造(computer aided manufacturing,CAM)技术,在低温(零下30 至40 摄氏度)条件下将复合高分子材料层层堆积得到的个性化三维实体。本次研究结合临床实际,利用低温3D 打印技术首次将广泛用于治疗甲氧西林耐药金葡菌引起的慢性骨髓炎的万古霉素[6-7]复合进PLGA 与TCP的支架材料中,成功打印出复合万古霉素/PLGA/TCP 的多孔支架,并在前期已通过体外实验证实其具有良好的生物相容性及万古霉素缓释效应。所以,本次研究采用山羊股骨感染性骨缺损为模型,进一步通过动物实验证实复合万古霉素/PLGA/TCP 的多孔支架的抗感染效果和生物降解效应,为其后期的临床运用提供可靠的实验数据。
1 资料与方法
1.1 主要仪器设备和材料主要仪器设备:(1)低温沉积生物3D 打印机(型号SUNP BP11 上普博源生物科技有限公司,北京);(2)真空冷冻干燥机(型号LGJ⁃12 松源华兴,北京);(3)X 射线机(Faxitron X⁃ray 公司,美国);(4)HP1100 高效液相色谱仪(惠普,美国)。主要试剂:(1)聚乳酸⁃羟基乙酸,PLGA75/25(山东省药学科学院中试厂,特性粘度:1.0 ± 0.1 dL/g);(2)β⁃磷酸三钙TCP(Sigma公司,美国);(3)1,4⁃二氧六环(Sigma 公司,美国);(4)苏木素伊红(HE)染色试剂盒(碧云天,中国上海)。
1.2 新型复合万古霉素/PLGA/TCP支架的制备低温快速成型3D 打印PLGA/TCP 基本支架可参考既往文献[9-11]。本次实验用支架打印具体步骤及参数如下:(l)用Mimics 软件MEDCAD 模块创建CAD 模型,支架规格:长×宽×高为20 mm × 20 mm× 15 mm;(2)材料配制比例:15%PLGA+1.5%TCP+1.5% 万古霉素;有机溶剂(1,4⁃二氧六环)占比80%;(3)打印机参数:喷头温度35 ℃,口部直径0.6 mm,打印速度9 mm/s,平台温度-25 ℃,填充图案为锯齿状,走线距离1.8 mm,孔隙率设置为80%;(4)固化方式:将低温3D 打印材料于-40 ℃静置24 min,转移至冷冻干燥机,设置真空度10 Pa 冷冻干燥48 h,以1 ℃/h 速度升温至20 ℃,此过程有机溶剂(1,4⁃二氧六环)可被完全移除。
1.3 万古霉素骨水泥珠链制备将聚甲基丙烯酸甲酯粉体与万古霉素粉(重量比10∶1)混合后,加入聚甲基丙烯酸甲酯单体,混合后注入模具,用手术缝线串起,制备成万古霉素骨水泥珠链,骨水泥珠直径5 mm,备用。
1.4 山羊股骨感染性骨缺损建模新疆军区总医院动物实验伦理委员会批准了此项研究计划。苏博美利奴羊12只,不分雌雄,体质量(51.2±3.5)kg,建立股骨感染性骨缺损模型。具体方法如下:采用氯胺酮(2 mg/kg 体质量)和盐酸赛拉嗪(50 mg/kg 体质量)(体积比为1∶1)进行全身麻醉,以维持动物在整个手术过程中的麻醉状态;剔除右侧髋部及右下肢羊毛,肥皂水和清水依次冲洗后将羊固定在手术台,常规聚维酮碘溶液消毒右下肢,铺无菌单,贴隔离膜。大腿表面纵向切开并剥离皮下软组织,暴露股骨,使用摆锯(Synthes 公司,瑞士)截除股骨中段皮质骨,长15 mm,用生理盐水充分冲洗切口。在骨缺损位置滴入1 mL 金黄色葡萄球菌液(1.0 ~1.25)×109CFU/mL,继续圈养4周,观察到手术伤口有脓性分泌物,确立以骨髓组织的细菌培养阳性及有死骨、或窦道形成的临床表现为标准,则为建模成功,可进行材料移植实验。
1.5 复合万古霉素/PLGA/TCP 的多孔支架材料的植入手术麻醉及切开同上一步骤。对感染股骨进行截骨清创,摆锯股骨截除残端,去除炎性肉芽直至正常组织显露,碘伏消毒创面后,用生理盐水充分冲洗切口。选取合适长度的支架,末端接触残留的骨断端以压配的方式放入缺损区,股骨骨缺损处植入修复材料,实验组1(3D 多孔支架组)植入复合万古霉素/PLGA/TCP 的多孔支架材料,实验组2(骨水泥珠链组)植入万古霉素骨水泥珠链,空白对照组不植入任何材料,每组设立4 只实验动物,术后放置引流管,逐层缝合伤口。
1.6 术区万古霉素浓度测定及杀菌活性分析术后1、4、6 周在利多卡因局部麻醉下,采用骨活检针钻取植入区组织或组织液,组织粉碎后采用生理盐水500 μL 洗提,采用高效液相色谱仪测量洗提液中万古霉素含量。将8 μL 组织洗提液滴加至直径7 mm 的圆纸片上,风干后在长满金黄色葡萄球菌标准株(ATCC25923)的血琼脂平板上进行抑菌环实验,35 ℃后培养18 h 后测量杀菌圈直径。
1.7 不同时间点的血液分析术后1、4、8、12 周分别抽取血液行血常规、血沉、C⁃反应蛋白的检测。
1.8 术区X⁃Ray 及组织学检测术后12 周行X⁃Ray 检测,观察骨缺损愈合及支架吸收情况。同时术后12 周过量麻醉处死实验动物术区行手术取材,移植区样品在4%多聚甲醛(pH 7.2)固定24 h,取出并用磷酸盐缓冲液(PBS)清洗后,在37 ℃恒温摇床里放入脱钙液乙二胺四乙酸(EDTA)2月,大约每7 d 更换脱钙液,脱钙完全后,沿股骨冠状平面方向切开缺损部位,观察面朝向底面放入一次性包埋盒,进入制作组织切片程序。自动组织脱水机(Leica⁃ASP200S,德国)按骨组织标准程序进行脱水,然后将脱水处理后的组织用石蜡包埋机(BMJ⁃1,天津天力航空机电,中国)进行包埋。下一步,用切片机(Leitz⁃1516,德国),制备了5 mm厚的组织切片,HE 染色。
1.9 统计学方法数据统计分析以及制图运用GraphPad Prism version 5(GraphPad software,San Diego,CA)软件,计量资料以均数±标准差表示,不同组间比较采用方差分析(ANOVA),P< 0.05为差异有统计学意义。
2 结果
2.1 总体情况所有实验动物均存活。对照组2只动物跛行,创面破溃,表面肉芽组织形成。3D 多孔支架组和骨水泥珠链组伤口愈合良好,无跛行。
2.2 不同时间点各组血液中白细胞、血沉、C⁃反应蛋白的变化术后1、4、8、12 周各组血液检测结果提示空白对照组各时间段的白细胞、血沉及C⁃反应蛋白均维持在较高水平,而3D 多孔支架组和骨水泥珠链组在第一周时三种指标均显著低于对照组,第4、8、12 周时数值均逐渐下降,相比空白对照组具有统计学意义(P<0.05,表1 ~3)。该结果证实骨水泥珠链组和3D 多孔支架组均有着良好的抗感染效果。
2.3 不同时间点术区万古霉素浓度测定术后第1 周骨水泥珠链组和3D 多孔支架组感染性骨缺损区的组织液中均能检测到万古霉素,其浓度都在20 mg/L 之上,但骨水泥珠链组显著高于3D 多孔支架组(P<0.05),而术后4、6 周时3D 多孔支架组的万古霉素浓度显著高于骨水泥珠链组(P< 0.05),证明骨水泥珠链组和3D 多孔支架组均能有效释放万古霉素,3D 多孔支架组的长期释放效果更好(图1)。
表1 各组实验羊血液中白细胞的动态变化Tab.1 The dynamic changes of white blood cells counts in the three groups ±s,×109/L

表1 各组实验羊血液中白细胞的动态变化Tab.1 The dynamic changes of white blood cells counts in the three groups ±s,×109/L
注:3D 多孔支架组与对照组相比,*P<0.05
指标对照组骨水泥珠链组3D 多孔支架组1 周24.04±3.6 14.45±2.3*13.58±3.1*4 周20.24±1.6 9.04±2.8*8.71±3.2*8 周16.34±1.7 8.04±2.3*8.53±1.3*12 周15.32±4.7 7.64±1.3*7.13±1.1*
表2 各组实验羊血液中CRP 的动态变化Tab.2 The dynamic changes of C⁃reactive protein in the three groups ±s,mg/L

表2 各组实验羊血液中CRP 的动态变化Tab.2 The dynamic changes of C⁃reactive protein in the three groups ±s,mg/L
注:3D 多孔支架组与对照组相比,*P<0.05
指标对照组骨水泥珠链组3D多孔支架组1周286.40±23.1 167.50±25.3*147.580±21.1*4周207.40±17.6 46.40±12.8*43.10±14.2*8周180.30±16.7 18.40±3.3*15.53±3.9*12周150.30±14.7 8.64±3.3*7.13±2.1*
表3 各组实验羊血液中血沉的动态变化Tab.3 The dynamic changes of erythrocyte sedimentation rate in the three groups ±s,mm/h

表3 各组实验羊血液中血沉的动态变化Tab.3 The dynamic changes of erythrocyte sedimentation rate in the three groups ±s,mm/h
注:3D 多孔支架组与对照组相比,*P<0.05
指标对照组骨水泥珠链组3D 多孔支架组1 周68±7 54±6*56±4*4 周57±6 33±5*36±7*8 周47±6 18±4*16±7*12 周38±5 10±2*9±3*

图1 不同时间段万古霉素浓度测定Fig.1 The concentration of Vancomycin in different time periods
2.4 不同时间点术区万古霉素活性测定术后第1 周骨水泥珠链组和3D 多孔支架组感染性骨缺损区的组织液均有抗菌活性,两者抗菌效果相当,但术后4、6 周时3D 多孔支架组的抗菌效果显著优于骨水泥珠链组(P< 0.05),证明3D 多孔支架组的长期抗菌效果更优(图2)。
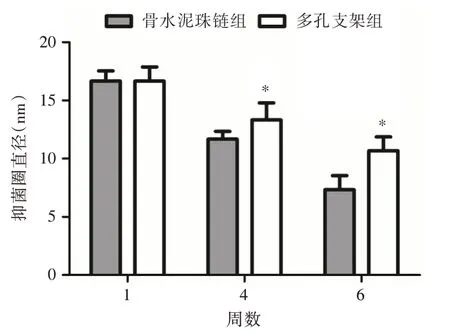
图2 不同时间段万古霉素活性测定Fig.2 The determination of Vancomycin activity in different time periods
2.5 术后12 周时X⁃Ray 评估对照组无支架植入的缺损区,新生骨组织结构分散,大约在4 周截骨末端逐渐闭合。3D 多孔支架组植入缺损部位之后,观察到新生骨沿股骨长轴生长,并在缺损区内向中间部分延伸,最后与缺损远端骨组织桥接(图2 ~5)。术后12 周时3D 多孔支架组X⁃Ray 影像显示骨缺损处支架信号模糊,可见明显吸收迹象。骨水泥珠链组也可以见到不同程度的骨生长,受珠链占位影响,其新生骨的面积显著低于3D 多孔支架组和对照组。缺损区骨量分析结果显示,3D 多孔支架组的缺损区骨量明显高于骨水泥珠链组和对照组,新生骨占缺损区面积的93%、42%和64%(P<0.05)。
2.6 组织学结果分析HE 染色结果发现:没有植入支架的空白组的缺损区见大量结缔组织填充,骨缺损近端和远端可见新生骨质向缺损中心延伸,但没有形成骨桥连接。3D 多孔支架组可见板层骨位于两端,中间是骨髓组织,断端与正常板层骨连接在一起。3D 打印支架表面可见新生骨组织直接沉积在支架小梁表面。成骨细胞样细胞排列在新形成的骨组织表面,在支架小梁表面类骨质覆盖,可见新生骨桥连接骨缺损的两个断端。骨水泥珠链组亦可见到新生骨组织,但受到骨水泥珠影响,缺损区新生骨面积小于3D 多孔组和空白对照组。
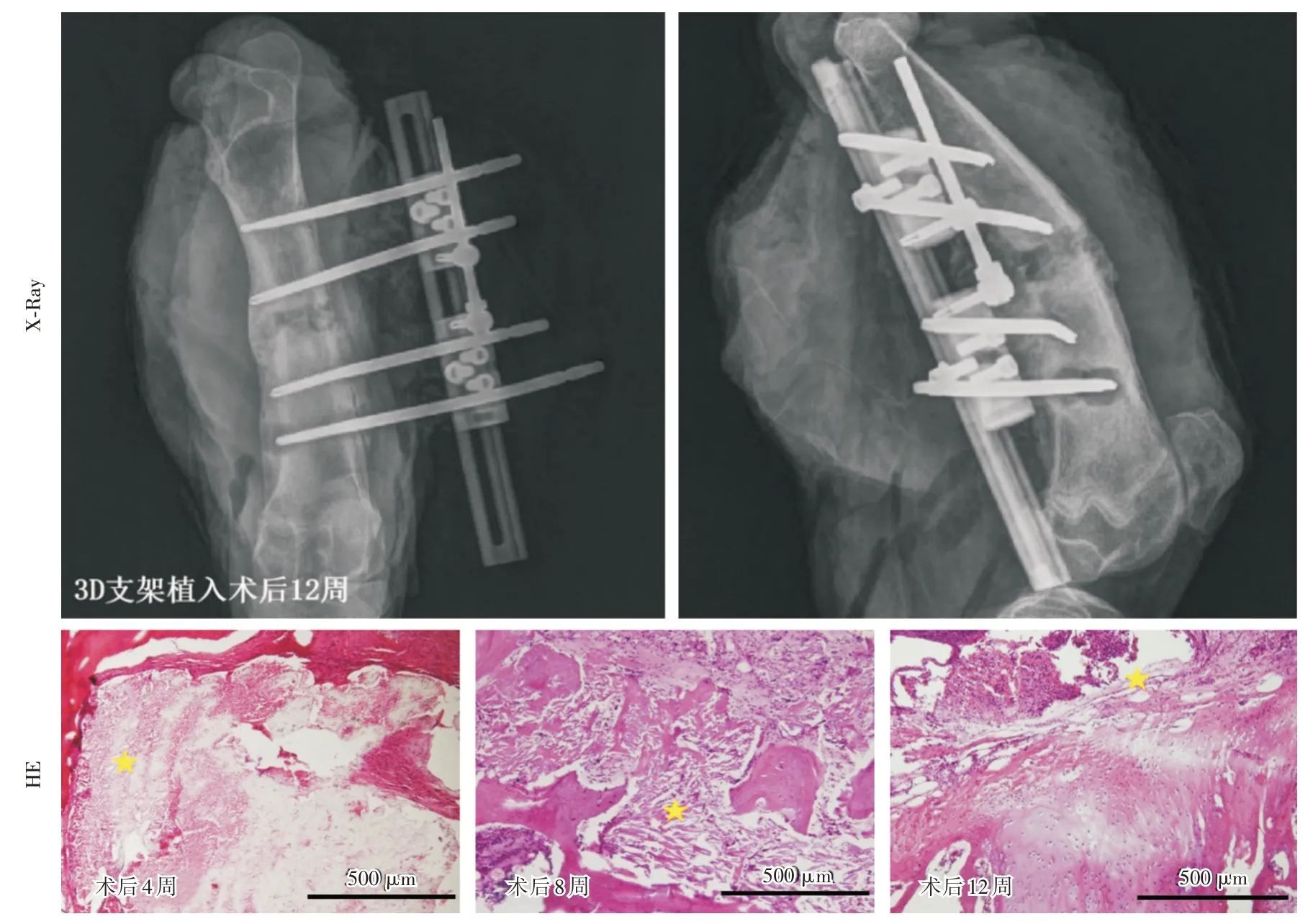
图3 术后12 周3D 多孔支架组X⁃Ray 及术后4、8、12 周HE 染色评估支架降解情况Fig.3 The X⁃Ray and HE stain of 3D scaffold group at the different time points after the operation

图4 术后4、8、12 周3D 多孔支架降解情况Fig.4 The degradation of 3D scaffold at the different time points after the operation
3 讨论
慢性骨髓炎伴骨缺损的治疗一直是骨科临床工作中面临的一大难题,其具有骨质破坏、死骨形成、窦道反复流脓的病理特点,而一期病灶清除配合骨水泥珠链植入控制感染,二期外固定支架行骨搬运术已成为治疗该类疾病的常规手段[8-9]。对于治疗慢性骨髓炎而言,彻底的清创和抗生素的有效运用是治愈的关键[10-11]。作为局部抗生素代入的介质,骨水泥珠链的使用已有30年历史,其治疗效果在临床中也已得到验证[12]。混合抗生素的骨水泥珠链不仅可以填补局部死腔和骨缺损,提供一定的力学支撑,还可以在局部逐渐释放高浓度抗生素,避免全身用药时血液中的抗生素浓度过高而产生毒副作用[13-15]。
但是,骨水泥珠链的缺点是不能进行有效的生物降解,植入后存在占位效应,无法在初期为骨缺损的愈合提供有效的空间,这势必将使患者面临多次手术带来的创伤及经济压力,而同时具备抗感染效果和生物降解性的骨移植材料的成功研发将有可能解决这一难题。如何在抗感染治疗的同时,实现骨的长入成为骨科医生的梦想。所以,要想制备的植入物具备多种特性,靠单一的材料构成无法满足,而复合材料的出现和进一步应用为上述研究目标的达成提供了一条捷径[16]。
因此,本次研究利用3D 低温打印技术,创新性的将PLGA、TCP 及万古霉素融合在一起,打印出复合万古霉素/PLGA/TCP 的多孔支架材料,具备多种优点。首先,3D 打印技术具有优异的个体化制定特点,可以利用CT/MRI 等影像学数据,根据患者自身特征性的骨缺损来打印与之匹配的植入材料,保证了尺寸及空间的完美匹配,为支架提供更好的力学支撑提供了保障[17-18]。其次,3D 打印技术可以参考前期的体外实验数据,个性化的定制材料的孔隙率和结构,使材料的生物力学及缓释效应达到最优化[19-20]。
笔者前期的实验结果证实3D 打印的复合万古霉素/PLGA/TCP 的多孔支架在孔隙率为80%时,其具有最优的抗生素缓释效应。不仅如此,在本次动物实验中,3D 多孔支架组的抗感染效果与骨水泥珠链组相当,充分证实了该种材料的抗感染效果已达到临床应用标准,能够有效控制慢性骨髓炎的局部感染病灶。最后,该材料的生物降解效应是本研究关注的重点。在山羊股骨感染性骨缺损模型中,通过植入3D 多孔支架材料,在术后12 周时发现其本身相对于4 周时发生了显著的降解,这证明复合万古霉素/PLGA/TCP 的多孔支架在具备抗感染效应的同时,还具有良好的生物降解性。
由此可见,将复合万古霉素/PLGA/TCP 的多孔支架运用于临床治疗慢性骨髓炎伴骨缺损患者时,可在一期清创植入该种材料后即刻安装骨搬运支架,随着感染的完全控制和材料的逐渐吸收,骨搬运的治疗可以同步进行,免除了二次手术取出植入物才可进行骨搬运这一步骤,避免多次手术所造成的创伤,同时将显著缩短患者的治疗周期和费用,这无疑将产生良好的社会效应。
应用低温3D 打印技术设计研发的新型复合万古霉素/PLGA/TCP 多孔支架材料不仅具有良好的抗感染效应,而且还具有稳定的生物降解性,其应用于临床后将极大的缩短慢性骨髓炎伴骨缺损患者的治疗周期及费用。同时该材料构成合理、价格低廉、较易获得,具有极大的临床应用潜力,将有望成为一种治疗慢性骨髓炎伴骨缺损的理想骨移植材料。
