人卵巢组织玻璃化冻存方案优选的实验研究
2021-01-20李晓虹汤惠茹李雨珊曾玉翠魏蔚霞黄斌杜辉吴瑞芳
李晓虹,汤惠茹,李雨珊,曾玉翠,魏蔚霞,黄斌,杜辉,吴瑞芳,2*
(1.北京大学深圳医院,深圳 518036;2.深圳市女性重大疾病早期诊断技术重点实验室,深圳 518036)
世界卫生组织公布的《世界癌症报告》显示2018年全球新增860万例女性癌症患者,其中乳腺癌是最常见的癌症类型,占女性癌症病例的近1/4[1]。而约70%的育龄期女性在诊断为乳腺癌时仍有生育意愿[2]。众所周知,大多数癌症治疗,如化疗、放疗或两者的结合都是对性腺有生殖毒性的,导致患者在治疗结束后出现卵巢早衰和不孕。因此卵巢组织冻存和移植具有广阔的应用前景。玻璃化冷冻是一种快速的冷冻方法,它通过使细胞内外液态直接转化为非晶体的玻璃化态,以减少细胞内外冰晶的形成。玻璃化冷冻不需要特殊的设备,节省了时间和成本,多年来该技术在卵巢组织冷冻的应用中取得了重大进展,目前已报道有通过卵巢组织玻璃化冷冻后自体移植妊娠的病例,其中已出生3例活产婴儿,但卵巢组织玻璃化冷冻还缺乏标准化方案,玻璃化冷冻保护液的配比和浓度需要优化[3-5]。
本研究选择4种公认适用于卵巢玻璃化冷冻保存液,建立液滴法直接观察玻璃化冻存液在液氮中快速降温和复融时的玻璃化程度,比较此4种冻存液保存冻融后的人卵巢组织的凋亡标志物细胞色素C(Cytochome C)与半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)的表达情况,以筛选优化的人卵巢组织玻璃化冻存液配方,为人卵巢组织冷冻技术提供实验依据。
资料与方法
一、实验材料
1.研究对象:选取2018年3月至2019年12月期间在北京大学深圳医院因妇科疾病手术治疗的患者卵巢组织。纳入标准:年龄18~40岁之间,月经规律,因疾病需要行腹腔镜或开腹卵巢囊肿剥除术或卵巢切除术的患者。排除标准:术前3个月曾口服激素类药物、有放化疗病史及卵巢早衰。
共收集到纳入符合标准的4例患者卵巢组织。患者年龄为(32.8±4.2)岁,其中因乳腺癌行预防性双侧输卵管卵巢切除术1例,卵巢颗粒细胞瘤行卵巢切除术1例,因卵巢畸胎瘤/卵巢子宫内膜异位症囊肿行卵巢囊肿剥除术各1例。
2.主要试剂及仪器:乙二醇(EG)、二甲基亚砜(DMSO)、蔗糖、海藻糖(Sigma,美国);4-羟乙基哌嗪乙磺酸(HEPES)缓冲的M199培养基(Thermo Fisher Scientific,美国);人工合成血清替代品(SSS)(Irvine Scientific,美国);4%多聚甲醛(北京索莱宝);Cytochome C兔多克隆抗体(BA0781)、Caspase-3兔多克隆抗体(BM3957)(武汉博士德生物);即用型免疫组化Elivision TM super试剂盒(兔/鼠)、二氨基联苯胺(DAB)显色试剂盒(福州迈新生物);玻璃化卵巢组织冻存液(Cryotissue Kit VT301/VT302,Kitazato,日本)、冷冻管(Corning,美国)、光学显微镜(Olympus,日本)、体式显微镜(Olympus,日本)、液氮储存罐(Thermo Fisher Scientific,美国)。
二、实验方法
1.卵巢组织的获取、处理与分组:卵巢切除术者标本离体后立即剪下卵巢皮质,囊肿剥除术者剪下附于手术剥除的卵巢囊肿边缘的正常卵巢皮质,置于盛有6 ml经HEPES缓冲的M199培养液(含20% SSS和100 μg/ml青/链霉素)的离心管中,15 min内去除卵巢组织血迹和髓质及肉眼可见的卵泡与黄体等周期性结构后,分割成(5~10)mm×10 mm×1 mm大小的组织块,随机分成5组,分别纳入冻存组和对照组。参阅有关人卵巢组织玻璃化冷冻保存的文献资料[6-8],设计4组冻存组和1个对照组。以未经冻融处理的新鲜卵巢组织为对照组,不作冻存处理,直接进行后续试验。4种不同玻璃化冻存液成分如下:A冻存液(A组)为含20% EG+20% DMSO+0.5 mol/L蔗糖+20% SSS+M199培养基[6];B冻存液(B组)为含38%EG+0.5 mol/L海藻糖+6%SSS+M199培养基[7];C冻存液(C组)为含15%EG+15%DMSO+0.5 mol/L蔗糖+20% SSS+M199培养基[8];D冻存液(D组)为Cryotissue Kit VT301/VT302 商品成品,成分未知。
人卵巢组织冻存4周后,取出金属网格载体,按蔗糖/海藻糖梯度解冻法复苏人卵巢组织[3-5],以4%多聚甲醛固定24 h后用于HE染色和免疫组化检测。
2.液滴法观察玻璃化冻存液状态:将洁净的液氮注入耐低温的玻璃皿中,将金属网格载体置于液氮中,用移液枪吸取500 μl冻存液,垂直滴在位于液氮中的网格载体上,将玻璃皿置于体式显微镜下,直接观察冻存液在快速降温过程中的玻璃化状态;再将37℃的磷酸盐缓冲液(PBS)注入玻璃皿2中,将玻璃皿2置于体式显微镜下,用镊子夹持金属网格载体,将冻存液的液滴迅速移入玻璃皿2中,直接观察各组冻存液在37℃复融时的玻璃化状态并拍摄记录。冻存液在液氮低温和复融过程中肉眼和显微镜下冻存液均保持透明状为玻璃化状态;冻存液在液氮低温和复融过程中完全形成冰晶体,肉眼呈不透明白色,显微镜下呈现黑色镜像为完全结晶;冻存液在液氮低温和复融时部分形成冰晶体,肉眼呈半透明白色,显微镜下呈现部分黑色镜像,部分仍然保持透明状为部分结晶。
3.人卵巢组织形态学观察:取卵巢组织固定24 h后,常规石蜡包埋切片,制作厚度3 μm连续切片,每隔5张取一张进行HE染色,镜下观察。每次实验任意选取3张切片,共进行4次独立重复实验。在400倍显微镜下,每张切片任选5个视野根据卵泡形态的正常与否进行卵泡计数。正常的卵泡为包含一个完整的卵母细胞和排列整齐的颗粒细胞层,卵母细胞或颗粒细胞未见浓缩核;出现卵母细胞皱缩或核固缩、颗粒细胞排列紊乱、颗粒细胞与卵母细胞分离或与卵泡周围的基膜分离及基底膜不完整中任一项,就表明卵泡退化,视为形态结构异常卵泡。正常卵泡率=正常卵泡数/卵泡总数×100%。
4.免疫组化染色:选择相应抗体对作为细胞凋亡标志物的Cytochome C和Caspase-3进行免疫组化染色。将组织冻融后及对照组卵巢组织切片分别以1∶200稀释的兔抗人Cytochome C抗体和Caspase-3抗体4℃孵育过夜,复温后PBS洗3次,每次3 min,二抗选自即用型免疫组化ElivisionTM Super试剂盒,操作步骤如说明书。DAB显色后用苏木素进行核复染,梯度酒精脱水干燥,二甲苯透明,中性树胶封固。显微镜下观察拍照。每次实验中各组对每个指标分析3张切片,每张切片在随机选取5个视野计数所有阳性细胞的数目。Cytochome C阳性结果为细胞浆或者细胞核出现棕黄色颗粒。采用Image Proplus软件根据染色部位着色深浅分析Cytochome C阳性表达并计算平均累积光密度,平均累积光密度=IOD(SUM)/Area(SUM)。Caspase-3阳性结果为细胞核染成棕黄色,阳性率=阳性细胞/总细胞数×100%。
三、统计学分析
采用SPSS 20.0软件进行数据统计分析。非正态分布的数据以中位数(四分位间距)[M(P25,P75)]表示,组间比较采用单因素方差分析(One-way ANOVA)Kruskal-Wallis法;计数资料用百分率(%)表示,组间分析比较采用卡方检验。P<0.05为差异有统计学意义。
结 果
一、各组冻存液在快速降温和复融时的玻璃化比较
在液氮中快速降温时A、B和D组冻存液均保持完全的玻璃化状态,玻璃液C冻存液大部分为玻璃化状态,仅周边见少许黑色的结晶形成(图1)。在复融过程中,A、B和C组冻存液出现大块黑色的结晶,随着温度上升,黑色结晶逐渐消失;D组冻存液则在整个复融过程中绝大部分保持透明的玻璃化状态,只有少量黑色结晶(图2)。
二、各组冻融后人卵巢组织形态学结果
HE染色显示,各组卵巢组织均可见正常形态的卵泡和闭锁卵泡,绝大部分卵泡在冻融后可以维持正常的形态。冻存组的异常卵泡表现为卵泡形态不规则,颗粒细胞分散、不连续,核固缩,基底膜断裂等(图3)。由于冻存卵巢组织中初级卵泡和次级卵泡较少,仅统计原始卵泡的正常率,各组卵巢组织的原始卵泡正常率与对照组比较均无显著性差异(P>0.05)(表1)。
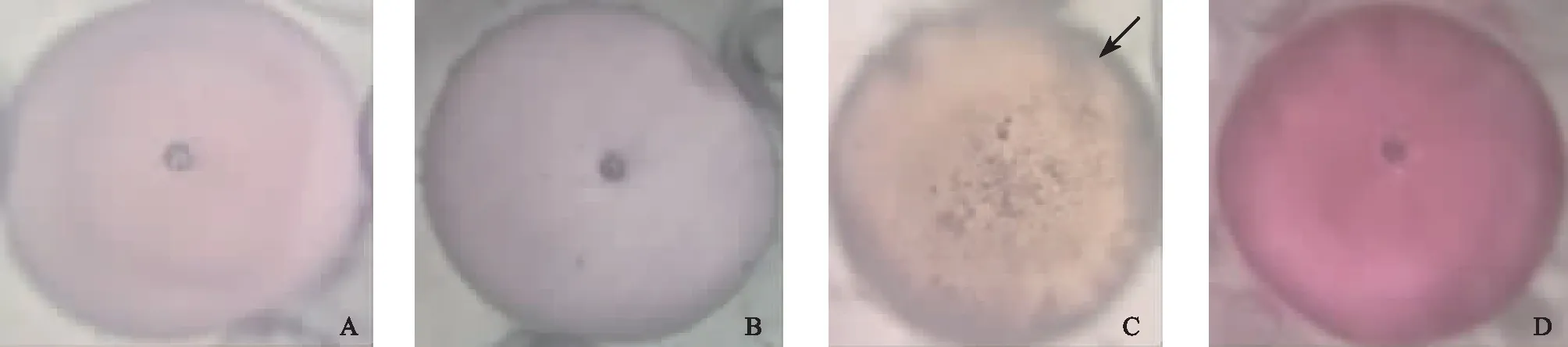
A~D示冻存液A~D组;箭头示结晶图1 各组冻存液在液氮快速降温时的玻璃化比较(×10)

A~D示冻存液A~D组;箭头示结晶图2 各组冻存液在复融后的玻璃化比较(×10)
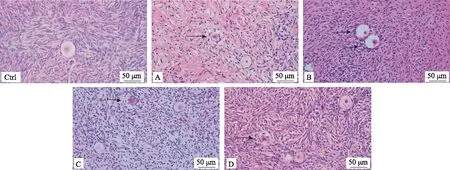
Ctrl:对照组;A~D示冻存液A~D组;箭头示异常卵泡;scale bar=50 μm图3 各组玻璃化冻存后人卵巢组织的形态学比较(HE染色)
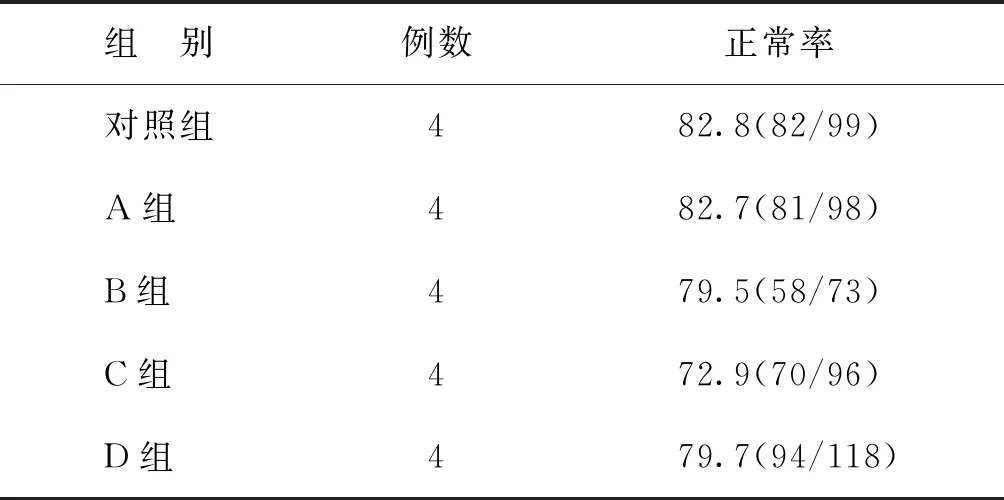
表1 各组患者卵巢组织冻融后原始卵泡正常率(%)
三、各组人卵巢组织中凋亡特异性标志物的表达情况
1.各组人卵巢组织中Cytochome C的表达结果比较:各组人卵巢组织冻融后的卵泡中均可见Cytochome C的表达(图4)。对照组、A、B、C和D组的平均累积光密度中位数分别为0.01、0.03、0.03、0.10和0.02;C组Cytochome C的表达显著高于对照组和D组(P<0.05),其余各组比较均无显著性差异(P>0.05)(图5)。
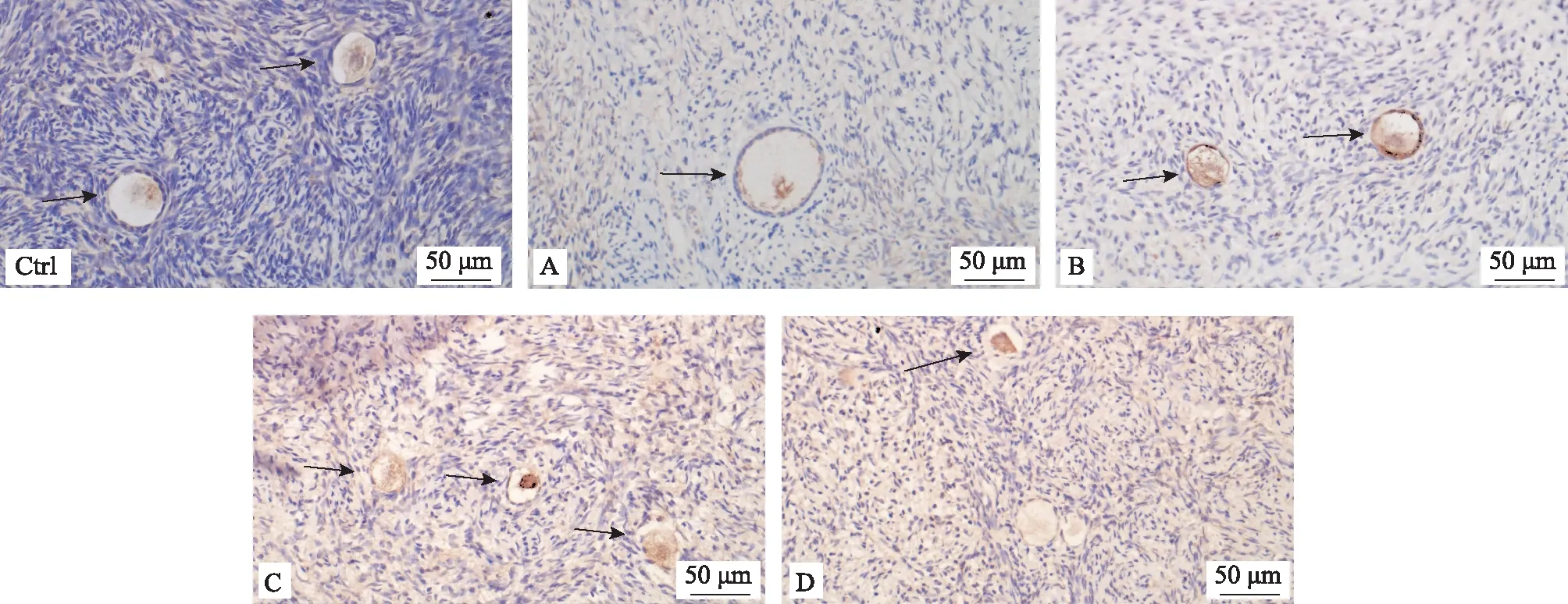
Ctrl:对照组;A~D示冻存液A~D组;箭头示阳性染色;scale bar=50 μm图4 各组患者卵巢组织中Cytochome C的表达(免疫酶标法)

注:与对照组比较,*P<0.05;与D组比较,#P<0.05图5 各组患者卵巢组织中Cytochome C显色统计结果
2.各组人卵巢组织中Caspase-3的表达结果:Caspase-3在对照组的卵巢间质细胞中基本不表达,卵泡可见弱阳性表达,在各冻存组间质细胞的细胞核中可见点状表达,卵泡可见阳性表达(图6)。C组Caspase-3阳性率显著高于A、B、D和对照组(P<0.05),其余各组间Caspase-3阳性率比较均无统计学差异(P>0.05)(表2)。

Ctrl:对照组;A~D示冻存液A~D组;箭头示阳性染色;scale bar=50 μm图6 各组患者卵泡中Caspase-3的表达(免疫酶标法)
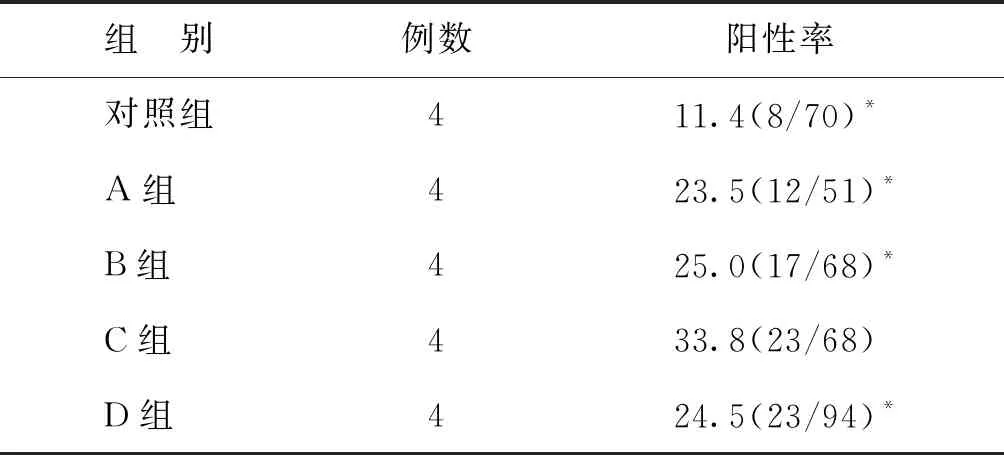
表2 各组患者卵巢组织中Caspase-3阳性率(%)
讨 论
玻璃化冷冻用高浓度的冷冻保护剂置换细胞中的水,通过快速降温方式,使细胞内外的液态直接转化为粘稠的非晶体玻璃化态,从而最大限度地降低了细胞内外冰晶的形成。目前玻璃化冷冻在卵母细胞、胚胎和精子的冻存中取得了很好的效果[9-11],但卵巢组织的成分复杂,组织块的体积也较大,适合于细胞的玻璃化冷冻方案可能并不完全适合用于卵巢组织的冷冻。以往大部分学者较多地从卵巢组织冻融后或移植后卵泡的形态学和超微结构等方面间接地优化玻璃液,操作过程繁琐、费时费力[12]。
本研究通过液滴法,可以方便快速地观察冻存液在快速降温和复融时的玻璃化程度。肉眼观察到玻璃化的溶液保持透明,而结晶溶液则是高度不透明的白色。显微镜下观察,玻璃化的溶液呈透明状,而结晶的溶液呈黑色。虽然我们可以通过液滴法方便直接地观察不同冻存液在液氮快速降温和复融时的玻璃化程度,但冻存液在组织中的玻璃化却很难观察到的。Paredes等[13]发现虽然外部培养基发生了结晶,但小鼠卵母细胞却仍有很高的存活率,提出细胞的存活与外部培养基的玻璃化或结晶关系很小或没有关系。这可能是因为卵母细胞或胚胎细胞质中含有大量的大分子(蛋白和核酸),这将增强冻存液中渗透溶质的玻璃化能力。但卵巢组织块不同于细胞或胚胎,组织块的体积较大,内部结构也更为复杂,关于冻存液的玻璃化程度与其对卵巢组织的冷冻保存效果关系的研究目前尚未见报道。
本研究选择的4种冻存液在相同的条件下,A、B和D组冻存液在液氮中可以保持完全玻璃化状态,而C冻存液在液氮中不能保持完全的玻璃化状态,出现部分结晶。其中A、B和C组冻存液的渗透性冷冻保护剂的总浓度不同,C组冻存液的总浓度为40%(20% EG和20% DMSO),B组冻存液的总浓度为38%(38% EG),C组冻存液的总浓度为30%(15% EG和15% DMSO)。通常认为玻璃化需要较高的冷却速率或较高浓度的冷冻保护剂。在相同的条件下,冻存液的浓度越高,越容易形成玻璃化状态,但高浓度的冷冻保护剂在置换细胞内的水的过程中,如果超过细胞的渗透耐受极限,将导致细胞内溶质的泄漏和不可逆的损伤[14]。因而在优化冻存液时,寻找合适的冷冻保护剂浓度非常重要。本研究中C组冻存液的渗透性冷冻保护剂的总浓度最低,C组人卵巢组织中的晚期凋亡指标Caspase-3的表达显著高于A和B组,可能是由于C组冻存液在快速降温时出现部分结晶,而这些冰晶会对组织细胞造成破坏,从而影响了冷冻保存效果。
在各组冻存液升温复融过程中,我们观察到升温的最初几秒钟,A、B和C组冻存液均出现结晶,随着温度进一步上升后,冰晶才再次融解,而D组冻存液在整个复融过程中绝大部分能保持透明的玻璃态。Yavin等[15]研究发现冻存液的复融的过程其实比冷冻过程更为重要。在升温复融的过程中,细胞内的小冰晶由于表面自由能的差异可以转化为大冰晶即再结晶。Mazur等[16]在小鼠卵母细胞玻璃化冷冻后复融过程中,通过显微镜观察到卵母细胞因细胞内的再结晶而呈现黑色,认为能否防止细胞内玻璃化的再结晶是卵母细胞能否存活的更关键因素。我们的实验发现,虽然A、B和D组冻存液均能在液氮中保持玻璃化状态,但只有D组冻存液在复融过程中可以绝大部分保持玻璃化状态。虽然经过4组冻存液处理冻融后的卵巢组织的卵泡正常率与对照组比无显著差异(P>0.05),但D组人卵巢组织的卵泡早期凋亡指标Cytochome C和晚期凋亡的指标Caspase-3的表达均显著低于C组(P<0.05)。正常情况下Cytochome C存在于线粒体内,参与线粒体呼吸链电子传递和细胞凋亡过程,但Cytochome C在细胞凋亡因素刺激下由线粒体内释放到细胞质内,是细胞凋亡的关键环节。Cytochome C可以激活Caspase-3,使细胞进入不可逆的凋亡阶段。我们的研究结果提示在快速降温和复融中能够保持良好玻璃化状态的冷冻保护液比在快速降温和复融时均不能保持完全玻璃化玻璃液的冷冻效果更好,组织凋亡更少,但体外实验的结果还需要通过体内实验来进一步证实。
综上所述,本研究通过液氮液滴法可方便直观地观察冻存液在快速降温和复融时的玻璃化状态,并可将其用于人卵巢组织玻璃化冻存液的初筛。在快速降温和复融时均能保持较好玻璃化状态的D组(商品化成品)冻存液保护人卵巢组织细胞凋亡较少,效果优于C组冻存液。
