卵巢功能减退患者卵泡液外泌体miRNA表达谱分析研究
2021-01-20沈开元黄芬罗江霞韦静陈春艳罗平黄彦妮
沈开元,黄芬,罗江霞,韦静,陈春艳,罗平,黄彦妮
(柳州市人民医院生殖医学科,柳州 545006)
卵巢储备功能通常直接反映女性的生育潜能,近年来随着不孕人群的增加,卵巢储备功能减退(Diminished ovarian reserve,DOR)患者的比例也逐年升高,并且患者年龄呈下降趋势。DOR患者最明显的表现是窦卵泡数(AFC)的急剧下降、基础FSH升高以及卵泡数目和质量下降。而卵母细胞能否正常完成减数分裂、受精、早期胚胎发育,是影响体外受精-胚胎移植(IVF-ET)结局的主导因素[1]。
外泌体(exosome)是一类可由多种细胞分泌、直径约为 30~150 nm 的膜性囊泡,能够参与免疫应答、抗原提呈、胞间通讯、蛋白质和RNA 转运等多种生理过程,是一种重要的细胞之间物质和信息交流的工具[2]。microRNA(miRNA)是一类长度为 18~25个核苷酸组成的小分子RNA,研究证实miRNA对哺乳动物的生育能力起到重要的调控作用[3],而外泌体能够携带miRNA转移至远端细胞参与细胞生理活动调节,并且其双层膜结构能够保证miRNA在体液中的稳定性,因此适合作为疾病的诊断标志和发病机制的研究。目前,有文献指出外泌体miRNA与女性卵巢功能疾病相关,例如外泌体miRNA参与卵巢癌增殖、凋亡和迁移过程[4]。研究表明卵泡液同样存在大量的外泌体,其外泌体miRNA参与卵母细胞减数分裂恢复、卵泡闭锁凋亡以及表观遗传修饰等生物学事件[5];由于卵泡液能够与血液、颗粒细胞发生大量的物质交换,为卵母细胞提供维持发育的微环境,所以卵泡液外泌体相比血清或者其他体液的外泌体更能反映卵泡的生理变化。然而目前DOR卵泡液外泌体miRNA的功能研究鲜有报道,因此本实验通过研究卵巢功能正常和DOR患者卵泡液外泌体miRNA差异表达谱,寻找可能导致DOR相关的重要候选miRNAs,为今后进一步阐明DOR患者卵母细胞数量和质量下降机制提供理论依据。
材料与方法
一、研究对象
收集2019年12月至2020年3月于柳州市人民医院生殖医学科进行辅助生殖治疗的患者的卵泡液,根据常规检查结果将患者分为卵巢功能正常组(对照组)和卵巢功能减退组(DOR组)。
纳入标准:(1)对照组患者要求年龄≤35岁,均有排卵证据,基础激素水平正常,月经第 2~3天AFC在7~20个之间,因输卵管梗阻或男方因素导致不孕;(2)DOR组患者要求符合DOR诊断标准[6-7],年龄≤35岁,均有排卵证据,并且月经第3天AFC≤5~7个、抗苗勒管激素(AMH)<0.5~1.1 ng/ml、基础FSH>10 U/L,以上3项符合2项并排除输卵管梗阻或男方因素导致不孕的患者纳入研究。排除标准:(1)合并有其他女性内外科疾病如PCOS、高泌乳素血症和盆腔输卵管炎症等;(2)存在不良生活习惯(抽烟、酗酒等)和体重超重(体重指数BMI≥25 kg/m2)的患者。
共纳入30例患者,其中对照组15例,DOR组15例。所有患者均签署知情同意书。本研究通过柳州市人民医院医学伦理委员会审查(审批号:2020(KY-E-18-01))。
二、主要试剂和仪器
1.主要试剂:外泌体提取纯化试剂盒(UR52141,上海宇玫博生物);抗CD63鼠源单克隆一抗(ab193349)、抗TSG101鼠源单克隆一抗(ab83)(Abcam,英国);RNA提取、反转录试剂盒(Invitrogen,美国);测序试剂盒HiSeq 4000 SBS Kit(300 cycles)(Illumina,美国)。
2.主要仪器:离心机(Eppendorf,德国);IVF工作站(K-system,丹麦);倒置相差显微镜(Nikon,日本);ZetaView纳米颗粒跟踪分析仪(Particle Metrix,德国);Illumina Hiseq4000高通量测序仪(Illumina,美国)。
三、卵泡液的收集和保存
对照组主要使用黄体期长方案促排卵,DOR组主要使用微刺激或拮抗剂方案促排卵。当患者血清E2达到550.5~734.0 pmol/L、B超监测显示至少有一个卵泡直径>18 mm时,肌肉注射HCG 10 000 U。注射 HCG 34~36 h后进行经阴道超声引导下取卵,并收集第一管澄清无血染卵泡液移入15 ml 离心管中[8],常温条件下3 000g离心10 min,去除杂质,取上清迅速移入干净的离心管中,-20℃保存备用。
四、外泌体的提取和鉴定
1.卵泡液外泌体的提取和纯化:使用外泌体提取纯化试剂盒制备外泌体样本,根据说明书进行如下操作:将保存备用的卵泡液上清在10 000g、4℃离心20 min后去除细胞和组织碎片,每2 ml上清液加入对应的外泌体提取试剂(ECS溶液)0.5 ml;将混合物涡旋震荡后在4℃孵育2 h,随后在10 000g、4℃离心60 min获得外泌体颗粒沉淀,用1×磷酸缓冲液(PBS)重悬颗粒沉淀,移入外泌体纯化柱子中,在3 000g、4℃离心纯化10 min;最后按照每20 ml样本起始量添加200 μl 1×PBS的比例对外泌体颗粒进行重悬,并将重悬液移入无菌EP管中,立即-80℃保存,留待后续分析使用。
2.外泌体的鉴定:①透射电镜鉴定外泌体形态:将提取的卵泡液外泌体固定在载物铜网上,经过负染色和干燥处理后,透射电镜下拍摄外泌体照片;②Western blot方法检测外泌体特异标记蛋白CD63和TSG101的表达情况:按照常规操作方法,外泌体蛋白上样量为30 μg,经过15% SDS-PAGE胶电泳后,电转至PVDF膜上,室温封闭1 h后分别加入CD63和TSG101 的鼠源单克隆一抗,4℃过夜孵育;孵育结束后TBST清洗3遍,加入二抗室温孵育50 min,TBST清洗3遍,使用ECL+plusTMWestern blotting system试剂盒进行显色,蛋白条带显示清晰后进行拍摄;③纳米粒子轨迹分析(NTA)检测外泌体颗粒大小和浓度:外泌体样本用1×PBS缓冲液进行稀释以适用于颗粒大小和浓度的测量。在温度23℃~37℃条件下,使用ZetaView pmx110分析仪记录并分析11个位置外泌体的测量值,测量数据使用110 nm的聚苯乙烯粒子进行校准。检测报告和原始数据通过ZetaView系统生成导出。
五、外泌体miRNA高通量测序与分析
1.小RNA的文库构建、测序与分析:各组随机取5例患者卵泡液2 ml混匀为10 ml的均一样本并提取纯化外泌体作为测序用的生物学重复样本;共进行3次重复。使用TRIzolReagent Invitrogen试剂盒提取外泌体总RNA(包括miRNA),对外泌体总RNA进行质检,样本浓度≥1 ng/μl且样本总量≥10 ng满足建库要求。随后利用Illumina TruSeq Small RNA试剂盒构建小RNAs文库,首先将总RNA进行第一链cDNA的合成和纯化,通过长距离PCR(LD-PCR)将第一链cDNA扩增为全长的双链cDNA(ds cDNA);ds cDNA经过纯化分析、定量检测以及文库回收后,用HiSeq 4000 PE Cluster Kit Illumina试剂盒进行聚类分析最终生成小RNAs文库。
使用Illumina Hiseq4000高通量测序仪进行测序,上机样本最终浓度为10 pmol/L。对获得的原始数据进行去接头、去除含未知碱基序列、去低质量碱基序列、长度筛选处理,获得 clean small RNA 序列;对clean reads进行长度分布统计和碱基偏好性分析;对clean reads去冗余后与 Rfam、miRBase数据库和基因组序列比对,鉴定出已知和新miRNA、siRNA以及piRNA等各类 sRNA分子,分别获得各自的表达量,进行差异表达分析、样本特异表达miRNA分析和PCA分析;将去除非miRNA的序列后的reads与miRBase数据库(miRBase 21,http://www.mirbase.org/)中miRNA前体及成熟体序列进行比对,统计 map 到成熟体区域的序列数,并预测其二级结构。对各样本已知miRNA进行表达量统计分析,利用TPM法进行表达量的均一化处理,以差异倍数(Fold Change)的绝对值 |FC|≥1.0且P值<0.05作为筛选标准,用DEseq2 软件筛选差异表达的miRNA并进行层次聚类分析。文库的构建、测序与分析均由上海宇玫博生物科技有限公司和上海美吉生物有限公司完成。
2.miRNAs的靶基因预测及功能分析:使用miRanda与TargetScanS软件共同预测结果作为miRNA的候选靶基因。分别使用软件Goatools (https://github.com/tanghaibao/GOatools)和KOBAS(http://kobas.cbi.pku.edu.cn/home.do)对预测的靶基因进行GO功能和KEGG信号通路富集分析,方法为Fisher精确检验;为控制计算的假阳性率使用4种多重检验方法 (Bonferroni,Holm,Sidak和false discovery rate)对P值进行校正;P值≤0.05作为显著靶基因的阈值。
结 果
一、卵泡液外泌体鉴定结果
纳米粒子轨迹分析(NTA)结果显示,检测的粒子直径大小在30~200 nm之间,峰值主要集中在112.9 nm(图1A);使用蛋白免疫印迹检测外泌体特异表达蛋白CD63和TSG101的结果显示,所提取的外泌体的蛋白条带与阳性对照条带分子量相同,证实表达CD63和TSG101(图1B);透射电镜观察可见DOR卵泡液来源的外泌体的外形呈椭圆形或者茶托状(图1 C)。以上特性表明,分离的囊泡体是外泌体。
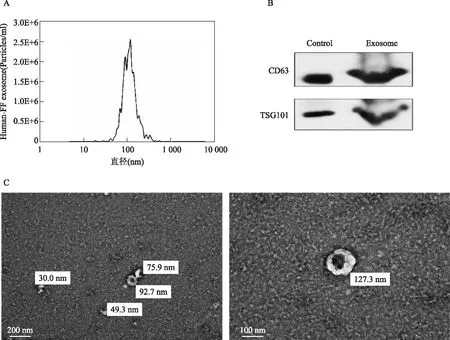
A:卵泡液外泌体颗粒直径和浓度分布的NTA分析结果;B:外泌体CD63和TSG101蛋白表达情况;C:透射电镜下外泌体的形态图1 卵泡液外泌体的鉴定
二、卵泡液外泌体miRNA的表达差异情况
测序结果显示,与对照组相比,DOR卵泡液外泌体中存在80个有明显表达差异的miRNAs,其中31个表达上调,49个表达下调(图2)。表1分别列出上调和下调表达差异倍数前10位的miRNAs。
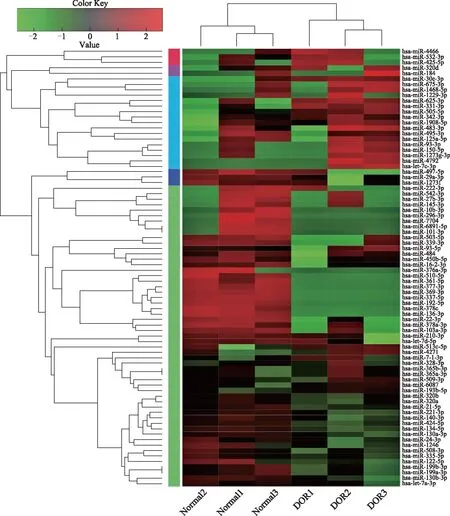
图2 对照组和DOR组卵泡液外泌体表达差异miRNA聚类分析热图

miRNAP值差异倍数(log2FC)调控方向miRNAP值差异倍数(log2FC)调控方向hsa-miR-47920.000 23714.90uphsa-let-7c-3p0.007 59214.25uphsa-miR-1840.000 3244.50uphsa-miR-331-3p0.003 5173.97uphsa-miR-150-5p0.001 2283.61uphsa-miR-425-5p0.008 8303.44uphsa-miR-675-3p3.46E-053.41uphsa-miR-483-3p2.89E-343.39uphsa-miR-505-5p0.001 8633.31uphsa-miR-625-3p0.001 1052.37uphsa-miR-136-3p0.002 395-15.28downhsa-miR-296-3p4.62E-05-15.25downhsa-miR-337-5p0.002 162-14.93downhsa-miR-369-3p0.003 806-14.79downhsa-miR-361-5p0.006 732-14.65downhsa-miR-77040.009 032-14.22downhsa-miR-22-3p1.49E-06-4.46downhsa-miR-378a-3p0.003 346-3.20downhsa-miR-122-5p2.55E-44-3.14downhsa-miR-145-3p0.006 631-2.97down
三、两组差异表达miRNA的生物信息学分析
通过miRanda与TargetScanS软件对差异表达的已知miRNA 进行靶基因预测,一共预测到17 159个靶基因。对差异表达miRNA靶基因进行GO分析,可见靶基因参与的生物学功能比较广泛,富集的生物学功能包括电离型谷氨酸受体信号通路(Ionotropic glutamate receptor signaling pathway)、氨基酸转运调节(Regulation of amino acid transport)、脂多糖介导信号通路(Lipopolysaccharide-mediated signaling pathway)及发育相关的凋亡过程(Apoptotic process involved in development)(图3A)。通过进一步Pathway分析发现,富集相对显著的信号通路有:趋化因子信号通路(Chemokine signaling pathway)、环磷酸腺苷信号通路(cAMP signaling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway)及丝裂原活化蛋白激酶信号通路(MAPK signaling pathway)等(图3B)。
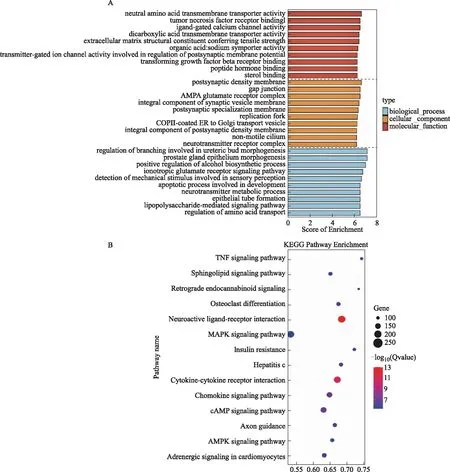
A:GO分析;B:KEGG pathway分析图3 差异表达miRNA靶基因的GO和KEGG Pathway分析
讨 论
卵巢储备功能减退(DOR)是一类多因素诱导疾病,异常血管化、氧化应激、自由基失衡、毒性和遗传学改变都可以促使卵母细胞质量下降,进而导致异常受精和胚胎质量低下。化学药物和放射治疗也会促进患者原始卵泡的消耗,此外DOR的病因还包括自身免疫疾病、医源性损伤以及不良生活习惯等[9]。在辅助生殖治疗中,DOR患者常常出现周期取消率高、获卵数少、临床妊娠率和活产率低而流产率高等临床结局。现在临床上常用激素类药物来治疗DOR,例如脱氢表雄酮(DHEA)、生长激素等能够改善患者的临床结局[10-11]。此外,在促排卵过程中促性腺激素释放激素激动剂(GnRH-a)和拮抗剂(GnRH-ant)的使用能够有效避免内源性LH峰,防止卵泡萎缩或早排,从而提高卵母细胞质量和内膜容受性。然而,这些研究缺乏对于修复改善卵巢储备功能以及DOR发病机理的深入研究。
DOR患者卵巢功能异常主要是由于过氧化物增加、颗粒细胞的异常凋亡和增殖导致卵泡发育阻滞和卵母细胞凋亡。研究表明卵泡液中的成分能够反映卵母细胞质量和临床结局,例如卵泡液的激肽酶谱与PCOS合并代谢综合征患者优质胚胎形成有关[12],卵泡液中25-羟维生素D低水平的患者的胚胎种植率和临床妊娠率显著低于高水平的患者[13]。此外在卵泡液中存在不同形式的miRNA调控卵泡发育的生理状态[14-16],参与到始基卵泡形成、优势卵泡募集、黄体形成和排卵以及卵泡闭锁等过程。近年的研究发现卵泡液中外泌体miRNA与卵巢功能障碍疾病联系紧密,一项多囊卵巢综合征(PCOS)的研究指出,卵泡液外泌体介导miRNA在细胞间的传递可能是导致PCOS的重要发病机理之一[8]。这提示我们,卵泡液外泌体miRNAs是研究DOR发病机理的重要切入点。
本研究在外泌体提取过程发现无论是对照组还是DOR组卵泡液中都存在大量的外泌体,一个值得关注的现象是DOR患者卵泡液外泌体的总含量要明显低于对照组,提示DOR患者卵泡液中的外泌体含量降低可能与卵泡的异常有关,在后续研究中可以进一步验证这一现象。我们通过Illumina Hiseq 4 000测序平台对对照组和DOR组的卵泡液外泌体进行了高通量测序,对两组外泌体miRNAs的表达谱进行分析,结果共筛选出80个差异表达的miRNA,其中hsa-miR-4792、hsa-let-7c-3p、hsa-miR-184等31个miRNA表达上调,hsa-miR-136-3p、hsa-miR-296-3p、hsa-miR-337-5p等49个miRNA表达下调。这说明与对照组相比,DOR卵泡液外泌体miRNA表达谱发生了显著的表达变化。
miRNA的生物学功能主要是通过靶向调控一个或者多个靶基因来发挥的。为了了解外泌体miRNA调节DOR的分子机制,我们采用了miRanda与TargetScanS数据库预测差异表达miRNA的靶基因。一些表达上调的miRNA如预测hsa-miR-150-5p的候选靶基因之一是MMP14,相关研究表明miR-150-5p可以通过靶向MMP14抑制肝癌细胞的迁移和侵入[17];还有研究发现,在培养的神经元样细胞中,hsa-miR-505-5p能够通过负调控CREG1促进糖氧剥夺/复氧诱导的神经元损伤[18]。本研究预测的结果与文献报道相符。因此外泌体 miRNA 通过与靶基因靶向结合在DOR中发挥的功能以及涉及的生物学通路值得进一步深入研究。
我们随后对靶基因功能进行生物信息学分析,GO和KEGG分析的结果提示这些靶基因参与了脂多糖介导信号通路以及发育相关的凋亡过程等生物学功能,并且参与了卵泡或者卵母细胞发育的相关信号通路。例如,cAMP信号通路:cAMP主要维持卵母细胞减数分裂阻滞,防止未成熟卵母细胞提前减数分裂和排卵[19];MAPK通路:参与卵母细胞减数分裂成熟过程,包括促进生发泡破裂、抑制减数分裂过程中的DNA复制、调节染色体的分离、维持MII期阻滞、诱发第2次减数分裂恢复等[20];TNF信号通路:调控细胞凋亡信号通路之一,研究表明TNF-α参与哺乳动物卵巢颗粒细胞的凋亡调控[21],在人的颗粒细胞中也发现TNF-αmRNA和受体的表达,说明TNF信号通路可能也参与调控人类颗粒细胞的凋亡进而影响卵母细胞及胚胎发育[22]。
本研究首次通过比较卵巢功能正常患者和DOR患者卵泡液外泌体所携带的miRNA基因表达谱的差异,发现DOR卵泡液外泌体miRNA表达谱发生了明显的改变;通过对这些差异表达miRNA的靶基因进行GO分析和KEGG分析,发现靶基因可能参与调控MAPK、cAMP、TNF等信号通路,进而影响DOR的病理生理过程。根据本研究结果,我们下一步将继续筛选出在DOR病程起到重要调控作用的miRNA,进一步阐明DOR及其他卵巢功能障碍疾病(如PCOS、早发性卵巢功能不全以及卵巢癌等)的发生和发展的分子机制,为找寻新的防治方法的研究提供新的思路和实验依据。
