子宫内膜间充质干细胞对小鼠模型薄型子宫内膜的修复作用
2021-01-20李瑞娇张汝月郭兴萍张引红李红霞
李瑞娇,张汝月,郭兴萍,张引红,李红霞
(山西省生殖科学研究所,出生缺陷与细胞再生山西省重点实验室,太原 030006)
近年来,随着不孕症发生率的逐年上升[1],辅助生殖技术广受关注。子宫内膜作为胚胎着床的重要场所,状态好坏直接影响着手术的成败。数据显示,子宫内膜厚度≥8 mm是胚胎成功着床的关键指标,小于6 mm时着床成功率则会发生明显下降[2]。对于成功妊娠的最低子宫内膜厚度下限,目前尚无统一说法,但通常将低于7 mm的子宫内膜称为薄型子宫内膜[3]。薄型子宫内膜的发生大多表现为药物流产、刮宫等宫腔操作手术的后续反应,此外部分患者会出现伴随着年龄增加而子宫内膜变薄的情况[4]。研究发现,薄型子宫内膜通常伴随着动脉血流压力增大,血供不足,血管内皮生长因子表达下调,腺上皮细胞增殖受限等[5]。针对薄型子宫内膜的临床治疗方法较多,例如内膜局部搔刮、激素补充、药物刺激、电刺激等,但都效果有限,且个体差异较为明显[6]。
干细胞是一种具有强大自我复制能力和多向分化潜能的细胞[7]。子宫内膜干细胞作为基于子宫内膜本身的自体干细胞,有着易于定向分化和低免疫原性的优势[8]。本实验将小鼠子宫内膜间充质干细胞移植至制作好的薄型子宫内膜小鼠模型中,获得了明显的修复效果,为临床薄型子宫内膜的修复提供思路。
材料与方法
一、实验动物
雌性C57BL/6J小鼠288只,SPF级,8周龄(性成熟且未交配),体重19~22 g;雄性C57BL/6J小鼠36只,SPF级,10周龄(预实验已确定有生育能力),体重22~25 g。均由山西医科大学实验动物中心提供[SCXK(晋)2015-0001]。饲养条件:山西医科大学实验动物中心屏障环境,每5只一笼,温度(25±2)℃,湿度(55±2)%,光照明暗时间比为12 h/12 h,自由获取食物和水。本实验操作经本单位伦理委员会批准,遵循实验动物伦理学要求。
二、实验试剂及仪器
细胞培养液MesenCultTMExpansion Kit(Mouse)、L-Glutamine(STEMCELL,加拿大);戊巴比妥钠(Ceres Chemical,美国);无水乙醇、甲醛、二甲苯(上海国药试剂);生理盐水(山东华鲁制药);伊红、苏木素、中性树脂(武汉Bioswamp);SP Rabbit & Mouse HRP Kit(DAB)(北京康为世纪);pan-cytpkeratin(H-240):sc-15367(Santa cruz,美国)、ERα(hc-20):sc-543(Santa cruz,美国)、monoclonalanti-vimentin:V-6630(Sigma,美国)、VEGF antibody(VG-1):ab1316(Abcam,英国)。
研究级正置显微镜(Olympus IX51,日本);组织脱水机(湖北康强医疗器械);石蜡包埋机(湖北泰维科技);石蜡切片机(Leica,德国);摊片烤片机(湖北康强医疗器械);细胞培养箱(ThermoForma,美国);倒置显微镜(Leica,德国)。
三、实验方法
1.小鼠子宫内膜间充质干细胞分离培养:基于间充质干细胞具有相似特性,采用加拿大STEMCELL公司特配的小鼠骨髓间充质干细胞富集培养液以贴壁培养的方法对C57BL/6J小鼠子宫细胞进行富集培养;并利用流式细胞仪对所获干细胞进行表面标记鉴定,包括CD29/CD45/CD73/CD90/CD105。将生长状态良好的P5细胞从培养瓶消化下来,消化方法参见文献[9]。将消化所得酶液和细胞混合液转移至无菌的15 ml离心管中,1 000 r/min,离心5 min,弃上清,收集沉淀。加入PBS调整细胞浓度,终浓度为5×105/ml,备用。具体操作参见本课题组已发表文献[9]。
2.薄型子宫内膜动物模型的建立:采用宫腔注射95%乙醇的方法,并通过形态观察、子宫内膜厚度测定、HE染色、免疫组化、生育力评估对模型进行鉴定。具体操作参见本课题组已发表文献[10-11]。
3.分组处理:288只小鼠随机分为空白对照组、模型对照组、干细胞移植组,每组96只。空白对照组不做任何处理;模型对照组宫腔注射95%乙醇损伤后立即原位注射PBS 0.1 ml,3 d后尾静脉注射PBS 1 ml;干细胞移植组宫腔注射95%乙醇损伤后立即原位注射子宫内膜间充质干细胞0.1 ml,3 d后尾静脉注射子宫内膜间充质干细胞1 ml。此时记为第0天,分别于第3、7、14、30天取样及合笼。
每组根据取样时间(3 d、7 d、14 d、30 d)不同分为4小组。取样当日,半数小鼠麻醉后获取子宫组织后立即放入4%多聚甲醛中固定;半数小鼠通过合笼怀孕情况,进行生育力评估。
4.子宫内膜形态学观察(HE染色):取出固定好的子宫,脱水透明后用石蜡竖直包埋,包埋好后可见圆形宫腔,切片,厚度为5 μm。HE染色后显微镜下观察子宫内膜组织结构,并使用Leica Qwin plus图像处理软件对子宫内膜厚度进行测量,测量位置为子宫内膜上皮层至肌层的垂直距离,每个样本取3个不同位置进行测量,求均值。
5.子宫内膜再生评估:以免疫组化染色方法检测子宫内膜中角蛋白(Cytokeratin,CK)、波形蛋白(Vimentin,Vim)、血管内皮生长因子(VEGF)、雌激素受体α(ERα)的表达,以评价子宫内膜细胞的再生情况[10-11],实验方法参考SP Rabbit & Mouse HRP Kit(DAB)试剂盒说明书进行。其中CK一抗pan-cytpkeratin(H-240):sc-15367稀释倍数为1∶50,抗原修复方法为柠檬酸钠缓冲液高压修复10 min;Vim一抗monoclonalanti-vimentin:V-6630稀释倍数为1∶200,抗原修复方法同样为柠檬酸钠缓冲液高压修复10 min;VEGF一抗antibody(VG-1):ab1316稀释倍数为1∶150,抗原修复方法为EDTA缓冲液高压修复10 min;ERα一抗(hc-20):sc-543稀释倍数为1∶100,抗原修复方法为柠檬酸钠缓冲液高压修复20 min。评价指标采用平均光密度法,使用Imagepro-plus图像分析系统对各组免疫组化切片进行分析,平均光密度(AOD meandensity)=IOD(integrated optical density)累积光密度/area。每张切片选择3个高倍镜视野,求均值。图片放大倍数为200倍。
6.生育力评估:每天下午17:30以雌雄2∶1的比例将实验小鼠与确定有生殖能力的雄鼠进行合笼交配。每天早上08:00观察阴栓,以确定是否成功交配。
若交配成功,即将雌、雄小鼠分开饲养,并进行标记。若交配不成功,继续合笼,但合笼大约2周后,停止合笼。观察到阴栓约16.5 d后,将雌性小鼠颈椎脱臼处死以确定怀孕情况。暴露子宫,观察小鼠子宫妊娠情况,记录并分析[11]。
四、数据分析
结 果
一、子宫内膜间充质干细胞
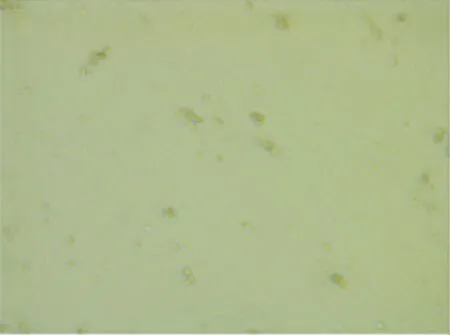
图1 第三代小鼠子宫内膜间充质干细胞(×100)
二、子宫形态变化图
因小鼠为双子宫动物,考虑单侧实验便于与另一侧作为对照,所以每次实验选择单侧损伤,单侧修复。经过损伤(及处理)后30 d,与空白对照组(图2A)相比,模型对照组针孔上方有明显结节,顶部皱缩(图2B),有一定程度的宫腔粘连,猜测为宫腔炎症所导致。干细胞移植组形态明显较为规则,外观流畅,恢复较好(图2C)。
三、子宫内膜厚度分析
随着时间延长,空白对照组子宫内膜变化无统计学差异(P>0.05);模型对照组子宫内膜轻微增厚,但3 d和7 d两个时间点比较无统计学差异(P>0.05),14 d和30 d两个时间点见部分样本纤维化,无法准确统计;干细胞移植组随着时间延长,子宫内膜逐渐增厚,各时间点比较均有统计学差异(P<0.05),其中7~14 d增幅较大,而3~7 d、14~30 d增幅较缓(表1)。
模型对照组可测量厚度的两个时间点内膜厚度均显著薄于对应时间点的空白对照组(P<0.05),且显著薄于对应时间点的干细胞移植组(P<0.05);干细胞移植组与同时间点空白对照组比较,仍有显著差异(P<0.05)(表1)。

A:空白对照组;B:模型对照组;C:干细胞移植组图2 不同组别小鼠30 d亚组子宫大体形态图
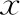
表1 不同组别不同时间点子宫内膜厚度分析[μm,(-±s)]
四、子宫内膜形态学分析
随着近年来的经济社会发展,基层农村在农业建设和农业开发领域取得了令人瞩目的成就,农业机械化进程也在不断推进。但由于各地农业发展基础不一,与全面实现农业机械化和现代化建设还有差距,特别是当前基层农机的管理服务上,还无法实现全面保障服务,影响了部分地区的农业效率和农业发展步伐,面对当前农业发展的必然要求,必须要扎实解决好基层农机综合管理服务问题,确保农业生产有效进行,发挥农业机械化发展的现实优势,促进我国从农业大国向农业强国的迈进。
空白对照组子宫内膜较厚,上皮层细胞圆润饱满,基质层细胞均匀分布,各时间点内膜层、基质层厚度均无明显差异(图3A1~4)。模型对照组子宫损伤明显,上皮细胞扁平,内膜层、基质层均见明显变薄,随时间延长自身修复不明显;14~30 d纤维化程度逐渐严重,比例增多(图3B1~4)。干细胞移植组3 d时子宫内膜有了轻微改善,上皮面出现弧度;7 d时上皮层及基质层厚度均增加,至30 d子宫内膜逐渐增厚,内膜层、基质层均可见明显修复,但与正常对照组相比,仍有一定差距(图3C1~4)。
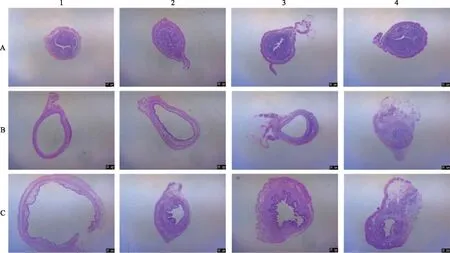
A:空白对照组;B:模型对照组;C:干细胞移植组;1~4分别示取材时间点3 d、7 d、14 d、30 d图3 不同组别小鼠子宫组织形态(HE染色 ×40)
高倍率图片显示各组30 d的子宫组织形态(图4)。可清晰看到空白对照组上皮层完整,上皮面弧度多样,腺体丰富;而模型对照组均为实质性细胞,无明显上皮基质区分,腺体几乎不可见;干细胞移植组细胞密度略低于空白对照组,但上皮细胞体积增大,柱状紧密排列,腺体增加,相比模型对照组有明显改善。

A:空白对照组;B:模型对照组;C:干细胞移植组;箭头示子宫内膜上皮层,五角星示腺体增加图4 不同组别小鼠30 d亚组子宫组织形态(HE染色 ×200)
五、免疫组化数据分析及图片观察
参照小鼠薄型子宫内膜模型建立[10-11]指标选取相关于子宫内膜再生的分子标记物进行评估,包括角蛋白(CK)、波形蛋白(Vim)、血管内皮生长因子(VEGF)、雌激素受体(ERα)。
空白对照组的各个时间点CK、Vim、VEGF、ERα表达均无统计学差异(P>0.05);模型对照组组内不同时间点,CK表达无统计学差异(P>0.05),而30 d时Vim、VEGF、ERα 均与3 d组有统计学差异(P<0.05)。可见随时间延长,子宫内膜有一定自我修复,但对于损伤至基底层的模型而言,修复效果甚微;干细胞移植组随时间延长各组数据均在逐渐改善,3 d与7 d、7 d与14 d、14 d与30 d比较发现,各组表达均具有统计学差异(P<0.05)。其中CK、Vim、ERα表达在7 d至14 d组差异最为明显,VEGF表达则在14 d至30 d组达到最大差异(表2、图5)。
组间比较发现,同一时间点模型对照组各检测指标均显著低于空白对照组(P<0.05),且7 d、14 d、30 d三个时间点各检测指标均显著低于干细胞移植组(P<0.05);干细胞移植组各检测指标与同时间点空白对照组相比,同样具有显著差异(P<0.05)。由此可见,干细胞移植后的子宫内膜状态虽与空白对照组子宫的完好生理状态有一定差距,但对子宫内膜的损伤后修复亦有明显作用(表2、图5)
表2 不同组别小鼠子宫内膜再生相关分子表达结果比较[(-±s),n=12)
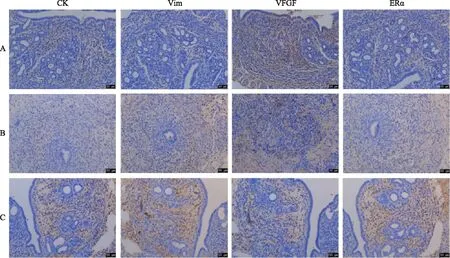
A:空白对照组;B:模型对照组;C:干细胞移植组图5 不同组别小鼠处理后30 d子宫内膜组织再生相关分子的表达(免疫组化染色 ×200)
六、生育力评估
子宫内膜的厚度是子宫形态是否正常的一个重要指标,但只有怀孕并娩出才真正意味着生育力的修复[12]。本实验中,模型对照组怀孕率接近为0,仅30 d组怀孕一例;干细胞移植组随时间延长,怀孕率逐渐增加,30 d后最终怀孕率达50%,与空白对照组的66.7%虽还有一定差距,但也明显高于模型对照组,足以证明干细胞对薄型子宫内膜的修复具有一定效果(表3)。
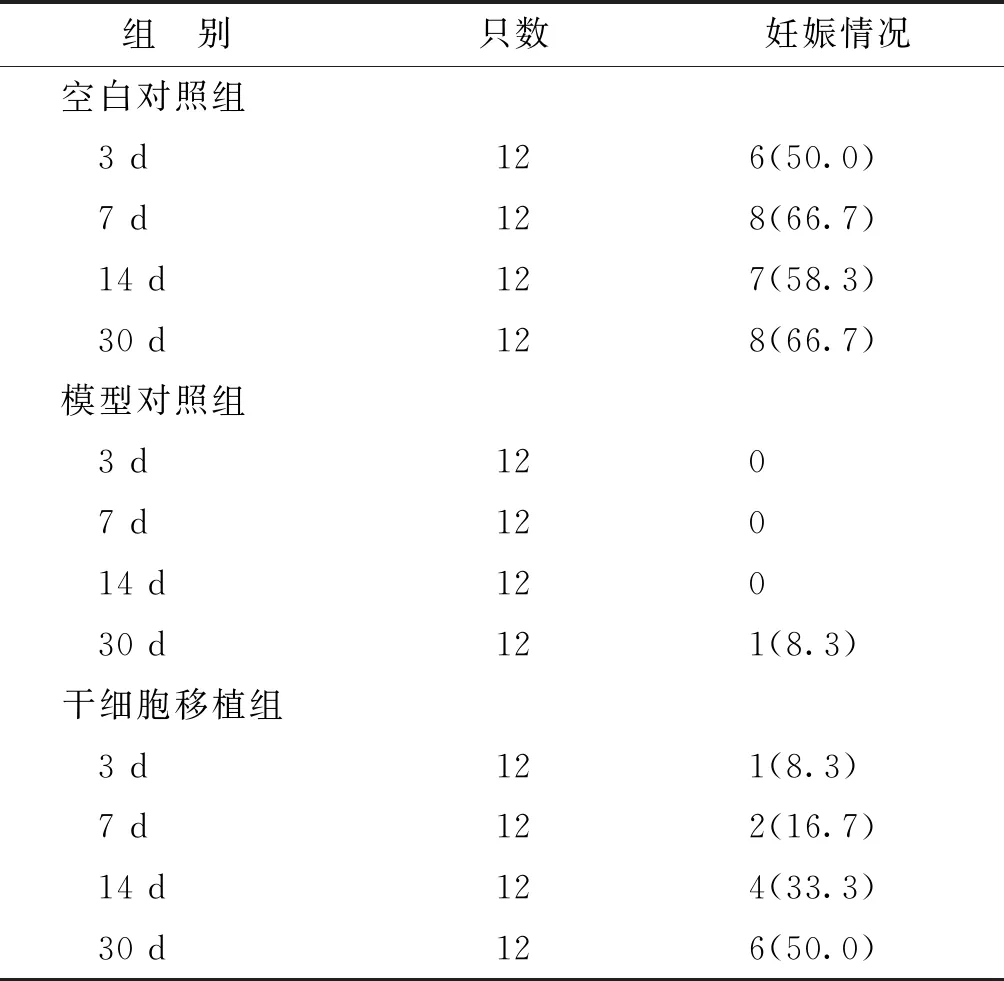
表3 各组小鼠妊娠情况[n(%)]
讨 论
近年来,随着干细胞技术的大力发展及再生医学的兴起,干细胞对各种疾病的治疗研究也越来越多,几乎遍布全身各大组织系统[13]。例如慢性肾脏病[14]、变应性鼻炎[15]、糖尿病辅助治疗[16]、支气管胸膜瘘[17]、骨关节炎[18]等,都取得了不同程度的进展。在子宫损伤修复领域,干细胞的探索也获得了众多成果[19]。研究显示,对薄型子宫内膜进行不同来源的干细胞移植,出现不同程度的子宫内膜增厚、腺体增加、血管再生,怀孕率上升等[20]。目前针对干细胞对薄型子宫可能的的修复机制尚不明确,主要包括细胞迁移、再生、分化、免疫调节、旁分泌作用等多种认知。传统的研究认为,干细胞有着相当高的增殖能力及多方向分化潜能,因此对子宫内膜的再生主要体现在干细胞移植后的增殖和分化。研究发现来源于雄鼠的骨髓间充质干细胞移植进入雌鼠体内后,可被诱导分化为子宫内膜细胞,并形成子宫内膜组织,使得怀孕率明显提高[21]。然而另外的研究发现,在移植干细胞并得到修复的受损子宫中,仅能检测到低于0.01%干细胞存在,提示干细胞的移植数量及体内增殖可能并不是修复的主要手段[3]。Santamaria等[22]将自体来源的CD133+骨髓间充质干细胞移植至子宫受损患者体内,通过对术后6个月的子宫内膜厚度、宫腔粘附状态、血管再生及怀孕状态评估,所有患者的子宫状态均得到良好改善,半数患者甚至恢复到受损前状态,多名患者自然受孕,胚胎移植成功率高达50%。王燕华等[23]将带EGFP标记的小鼠胚胎干细胞移植至受损的小鼠子宫,结果发现胚胎干细胞定植于损伤侧子宫,后续子宫形态恢复较好,且严重纤维化发生例数减少,但存在成瘤风险。Corradetti等[24]研究发现来源于羊膜的间充质干细胞与子宫来源的细胞拥有大量重叠的基因表达谱,而且体外共培养时,子宫来源的间质细胞增殖速度明显增加。Xu等[25]注射复合胶原支架的脐带间充质干细胞于已建立好的大鼠子宫瘢痕模型中,实验发现复合移植组有明显的胶原降解,修复后妊娠率也明显高于对照组。然而,细胞来源不同,移植方式不同,细胞的归巢效率是不一样的,干细胞归巢是其发挥修复作用的重要前提[26]。因此选择合适的细胞来源、恰当的移植时机、移植位置、移植剂量都非常重要。子宫内膜间充质干细胞存在于基底层与肌层的连接处,不仅拥有干细胞共有的高效增殖速率和多能分化特性,且获得方式较为容易,无伦理学困扰,独有的定位优势和低免疫原性也使之成为子宫组织损伤修复当仁不让的首选。
本实验选择实验室已培养鉴定好的小鼠子宫内膜间充质干细胞的第五代进行干细胞移植,PBS注射作为模型对照组。考虑到开腹手术对鼠体本身健康的伤害,本实验选择将悬浮好的子宫内膜间充质干细胞于损伤当时移植进入受损子宫,对其进行修复,并在术后第3天通过尾静脉再次注射干细胞,以期增加归巢干细胞数,提高修复效果。实验结果发现,干细胞移植组子宫内膜厚度明显增加,上皮细胞及基质细胞形态逐渐恢复,数量增多,腺体丰富。同时,我们选择免疫组化检测CK、Vim、VEGF、ERα四种蛋白,通过其表达量的变化来进一步明确修复程度。临床显示子宫内膜薄通常表现为腺上皮生长缓慢,动脉血流阻力增高[27]。角蛋白作为上皮细胞的标志性蛋白,主要表达于腺上皮和腔上皮细胞[28]。角蛋白的高表达,意味着上皮细胞状态良好,形态完整。因此在子宫内膜修复过程中,修复组相比损伤组的角蛋白表达上调,修复组随着时间延长角蛋白表达不断增加,无一不在提示着上皮细胞的良好再生。波形蛋白主要表达于子宫内膜的间质细胞,对间质细胞结构的完整性维持有着非常关键的作用[29]。修复组波形蛋白表达上调,意味着受损子宫内膜间质细胞的有效增殖。VEGF是血管内皮生长因子,在血管通透性的调整,新生血管的形成和维护过程中发挥重要作用[30]。子宫内膜受损导致动脉血流阻力加大,VEGF的表达下降,而VEGF表达上调,则意味着血管生成得到改善,血流通畅,最终诱导子宫内膜增殖,状态改善。通常认为,雌激素受体主要分为ERα和ERβ两种,其中主要存在于生殖系统中与雌激素作用的受体是ERα,二者相互作用介导下游相关因子转录从而影响子宫内膜的生长发育[31]。雌激素受体表达的上升或下降,指示着子宫内膜的增生与蜕膜化。本实验结果发现,四种蛋白均出现了不同程度的上调,说明子宫内膜确实得到了修复,并且在7 d到14 d中间,出现了较高的增长,是一个非常有意义的指征。
本实验结果预后较好,干细胞移植组虽然与空白对照组相比尚有差距,但相对模型对照组来说,已有了明确的改善。但本研究没有对干细胞进行标记,从而进一步跟踪子宫间充质干细胞进入体内的归巢情况,进而探索子宫内膜间充质干细胞修复的机制,是本实验的局限。希望通过后续对本实验的进一步完善及深入,明确修复机理,进一步提升修复效果,为临床子宫内膜干细胞的使用及薄型子宫的治疗打下夯实的基础。
