虾夷扇贝Smad基因家族的鉴定及表达分析*
2021-01-20潘好远戴晓婷胡乃娜曾启繁
潘好远, 戴晓婷, 胡乃娜, 曾启繁,2**
(1. 中国海洋大学海洋生命学院, 海洋生物遗传学与育种教育部重点实验室, 山东 青岛 266003;2. 青岛海洋科学与技术试点国家实验室, 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237)
Smad蛋白介导由TGF-β超家族诱导的信号转导,调节目的基因的转录,参与调节细胞增殖、分化、迁移、创伤和创伤修复等多种生理反应[1-3]。果蝇蛋白Mad和线虫蛋白Sma是Smad蛋白家族的原始形式[4],蟾蜍、小鼠、人类中均发现了与Mad和Sma类似的基因,这些TGF-β信号转导基因被统一命名为Smad[5]。目前,哺乳动物中Smad基因家族包括8个成员,分别为Smad1,Smad2,Smad3,Smad4,Smad5,Smad6,Smad7,以及Smad8/9。可以分为三大类:受体调节Smad(R-Smad)、通用性Smad(Co-Smad)和抑制型Smad(I-Smad),Smad蛋白含有高度保守的N端结构域mad homologous domain1(MH1)和C端结构域mad homologous domain2(MH2)[6]。目前,在基因结构、序列方面对Smad基因家族的研究较多,此外在胚胎发生过程中的表达模式和作用机制等方面也有所研究[7-9]。该家族在脊椎动物的早期发育、原肠形成、造血、背腹轴形成中均发挥重要作用[10];Smad2/3在癌变和衰老过程中可以被TGF-β信号激活,从而起到重要作用[11-12]。
软体动物是冠轮动物中较为特殊的门类,其具有高度多样化的躯体形态,是最早出现在化石记录中的双侧对称动物之一[13]。近年来,TGF-β信号通路和Smad基因家族在双壳贝类中的功能受到越来越多的关注,多个TGF-β超家族配体以及I型、II型受体和Smad家族成员被克隆,刘刚等[14]在太平洋牡蛎(Crassostreagigas)中克隆了Smad1/5/8和Smad4基因并发现其参与了胚胎背部化、三胚层形成和贝壳发生等较重要的发育过程,郭慧慧[15]在栉孔扇贝(Chlamysfarreri)中克隆Smad1、Smad3、Smad4、Smad6基因的全长cDNA序列,董迎辉[16]在泥蚶中克隆得到Smad3基因。通过上述研究可以推测贝类可能存在相似的TGF-β/Smad信号通路,且与生长发育密切相关[15, 17-18]。最近完成的几个双壳类基因组测序项目[19-21]为系统描述海洋双壳类中重要的转录因子家族提供了宝贵的基因组和广泛的转录组资源。虾夷扇贝(Patinopectenyessoensis)在超过3亿年的演化过程中基因组变化缓慢,保持了高度保守的核型与相对完整的古老基因家族[20]。因此,分析Smad基因家族在虾夷扇贝中的序列特征,系统发生关系及时空表达模式,将为理解古老动物类群Smad基因家族的进化与功能研究提供参考。
1 材料与方法
1.1 Smad基因的鉴定
在Swiss-Prot数据库[22](版本号:2019_11)(https://www.uniprot.org/)中选取代表性无脊椎动物(果蝇(Drosophilamelanogaster)、牡蛎(C.gigas)、海葵(Nematostellavectensis)、线虫(Caenorhabditiselegans)、海鞘(Cionaintestinalis)、水螅(Hydravulgaris)、海参(Strongylocentrotuspurpuratus))和脊椎动物(人(Homosapiens)、小鼠(Musmusculus)、斑马鱼(Daniorerio))的Smad蛋白序列进行虾夷扇贝全基因组序列筛查,所有用到的蛋白序列Accession ID详见表1。利用BLAST将Smad蛋白序列与虾夷扇贝的转录组和基因组数据进行比对(e<1×10-5),最终得到虾夷扇贝候选Smad基因。
1.2 虾夷扇贝样品的获取和Smad基因克隆
实验样本采自青岛市南区南山市场,在实验室暂养3 d后,选取活力良好的个体解剖3只取其平滑肌、横纹肌、血和鳃,液氮速冻后置于-80 ℃冰箱中保存。
采用传统酚氯抽提法提取各组织的RNA,取1.5 μg RNA,加入1 μL Oligo dT(100 μmol/L)后,将体系用水补至12.5 μL。混匀后,65 ℃温育5 min。加入4 μL 5×Buffer、0.5 μL Recombinant RNase Inhibitor(40 U/μL)、2 μL dNTP(10 mmol/L)、1 μL反转录酶(200 U/μL)。混匀后,42 ℃ 90 min,72 ℃ 10 min,获得反转录cDNA。基于虾夷扇贝转录组数据库筛选得到的Smad基因cDNA序列设计引物(见表2),对其开放阅读框(ORF)进行克隆验证。以血液cDNA为模板,按Phusion高保真DNA聚合酶说明书进行扩增。采用琼脂糖凝胶(1.5%)电泳检测PCR产物,利用MinElute胶回收试剂盒回收目的片段。将回收片段连接到TEASY-BLUNT载体上,转化DH5α感受态细胞,涂平板,37 ℃过夜。次日,挑取阳性克隆,经菌落PCR检测后,交由生工生物工程(上海)股份有限公司测序。

表1 Smad基因鉴定分析所用蛋白序列注册号

表2 基因系克隆引物及荧光定量PCR引物列表
1.3 序列分析
对虾夷扇贝Smad基因序列进行分析,利用CDD[23]软件预测分析虾夷扇贝Smad蛋白序列的结构域。使用IBS1.0.3[24]展示基因结构和蛋白结构。利用Compute pl/Mw tool[25]分析软件,计算虾夷扇贝Smad蛋白序列的分子重量及等电点。使用多重序列比对软件Clustal W比对分析虾夷扇贝等物种Smad蛋白的MH1,MH2结构域序列,然后通过Genedoc[26]软件进行可视化处理。
1.4 系统发生树构建
在NCBI中下载牡蛎(C.gigas)、水螅(H.vulgaris)、海葵(N.vectensis)基因组和蛋白组文件,根据前述方法进行Smad基因的鉴定,得到蛋白序列,此外在UniProt数据库中下载人(H.sapiens)、小鼠(M.musculus)、斑马鱼(D.rerio)和果蝇(D.melanogaster)的Smad蛋白序列,一起用于系统发生树的构建。
导入MEGA7.0[27]软件分别进行邻接法(Neighbor-Joining)和最大似然法(Maximum Likelihood)构建系统发生树,Bootstrapping值设为1 000。将序列导入BEAST2[28]软件中采用贝叶斯(Bayes)法构建进化树,分析进行了1亿代,每10 000代进行一次采样,前10 000个样品丢弃,最后3种系统发生树通过软件iTOL[29]进行展示。
1.5 虾夷扇贝 Smad 基因家族在早期发育及成体组织的表达分析
将课题组前期收集的各个发育时期(受精卵、2~8细胞、囊胚期、原肠胚期、担轮幼虫、D形幼虫、壳顶幼虫、匍匐幼虫和稚贝)以及成体组织(横纹肌、血、肝胰腺、眼、精巢、足、鳃、肾、外套膜、卵巢、平滑肌)转录组数据[20],在本地的服务器上进行运行和分析,用 STAR[30]软件,以虾夷扇贝基因组为参考序列,将转录组文库序列进行比对,用Samtools[31]软件处理比对结果件,用featureCounts[32]软件根据已发表的基因组注释信息[20]统计每个个体中每个基因的counts值,最后基因的表达量用FPKM(Fragments Per Kilobase of exon model per Million mapped fragments)表示,计算公式为:
为了检测虾夷扇贝早期发育时期Smad基因的表达模式,将FPKM值导入RNentropy[33]软件来进行统计分析,多重测试校正方法采用BH(Benjamini-Hochberg)校正法。使用SPSS20.0[34]软件,通过单因素方差分析(one-way ANOVA)检测基因在各个组织平行样品中的表达量差异。
1.6 荧光定量PCR验证组织表达模式
根据虾夷扇贝Smad基因序列设计荧光定量PCR引物,因为EF1A在扇贝各组织中稳定表达[35-36],所以选择其为内参基因,荧光定量PCR引物见表2。
实时荧光定量PCR反应体系如下:将cDNA稀释成10 ng/μL后取2 μL作为模板,加入10 μL SYBY Green I Real-time PCR Master Mix,上、下游引物(2 μmol/L)各4 μL。使用LightCycler480实时荧光定量PCR仪(Roche)进行扩增。PCR反应条件:94 ℃ 10 min;94 ℃ 15 s,60 ℃ 1 min,40个循环;94 ℃ 15 s,1个循环。分析产物熔解曲线,检验引物特异性,并采用2-ΔΔCt方法计算目的基因的相对表达量。使用SPSS20.0[34]软件,通过单因素方差分析(one-way ANOVA)检测基因在各个组织中表达量差异显著性。
2 结果
2.1 虾夷扇贝Smad基因的鉴定和结构分析
通过对虾夷扇贝全基因组范围的筛查共鉴定得到4个Smad基因,根据系统聚类分析,它们分别是Smad3、Smad4、Smad5和Smad6。此外还通过基因克隆获得了Smad基因的ORF区域,将克隆得到序列与筛查鉴定得到的Smad基因进行比对,Smad3克隆序列与基因组序列相似度达到99.92%、Smad4克隆序列与基因组序列相似度达到99.83%、Smad5克隆序列与基因组序列相似度达到99.57%,Smad6克隆序列与基因组序列相似度达到100%。
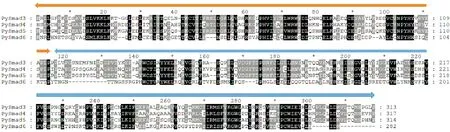
根据序列信息,绘制Smad家族基因的结构如图1。基因全长方面差异较大,最长的Smad3基因达到69 385 bp,有8个外显子;最短的Smad5基因,长13 057 bp,有6个外显子。但Smad基因的开放读码框长度相对稳定,长度都在1 000~2 000 bp,编码氨基酸个数在360~580(见表3)。通过Smad蛋白序列在CDD上进行结构域预测(见图2),其具有N端结构域MH1和C端结构域MH2。Smad4和Smad5连接区还分别具有MADS和MED15结构域。对虾夷扇贝Smad蛋白的多序列比对发现,4个Smad蛋白的结构域同源性很高,MH2结构域具有较高的保守性(见图3)。

(粉色框:外显子编码区;橘黄色框:MH1结构域;紫色框:MH2结构域;白线或双斜线:内含子。The pink boxes indicate the exons. The orange boxes indicate the mad homologous domain1 (MH1) domain. The purple boxes indicate the mad homologous domain2 (MH2) domain. The white horizontal lines with sporadic double slash indicate the introns.)

表3 虾夷扇贝Smad基因家族序列特征

(橘黄色框:MH1结构域;紫色框:MH2结构域;粉色:MED15结构域:蓝色:MADS结构域。The orange boxes indicate the mad homologous domain1 (MH1) domain.The purple boxes indicate the mad homologous domain2 (MH2) domain. The pink boxes indicate MED15 domain.The blue boxes indicate MADS domain.)
(橘黄色箭头:MH1结构域,蓝色箭头:MH2结构域.The orange arrow indicates the mad homologous domain1 (MH1) domain.The blue arrow indicates the mad homologous domain2 (MH2) domain.)
2.2 虾夷扇贝Smad家族的系统发生分析
应用邻接方法、最大似然方法以及贝叶斯方法得到的结果基本一致,均得到相似的拓扑结构。在贝叶斯进化树中Smad蛋白序列更清晰地分为3支,Co-Smad与R-Smad两支之间节点支持率为100%。邻接方法进化树与贝叶斯方法进化树更好地体现了Smad由后口动物向脊椎动物进化的过程。虾夷扇贝基因组中保留了后口动物中完整的Smad家族亚群,在水螅中鉴定Smad1/5/8、Smad2/3以及Smad4三类蛋白,在海葵中鉴定出Smad1/5/8、Smad2/3、Smad4以及Smad6/7四类蛋白,在牡蛎中鉴定出Smad3、Smad4、Smad5以及Smad6四类蛋白(见图4)。三种进化树均显示Smad可以分为3个主要亚族:R-Smad、Co-Smad和I-Smad,其中最大亚族R-Smad又分成介导TGF-β通路的R-Smad和介导BMP通路的R-Smad。虾夷扇贝中Smad被分为4个亚族,Smad3、Smad4、Smad5、Smad6,分别聚到TGF-β通路R-Smad、Co-Smad、BMP通路R-Smad和I-Smad四个亚族中(见图4)。脊椎动物Smad之间表现出更紧密的联系,虾夷扇贝、牡蛎等无脊椎动物的Smad则聚在一起。值得注意的是,虾夷扇贝的Smad3与其它物种的Smad2和Smad3聚在一起;Smad5与其它物种的Smad1、Smad5、Smad8聚类,两者所在的亚族分别调控不同的信号通路,有很强的同源性。虾夷扇贝的Smad4与其它物种的Smad4聚类,Co-Smad亚族中只有一种Smad4,负责与R-Smad蛋白形成异源复合物。 虾夷扇贝Smad6与其它物种的Smad6、Smad7聚类。

(Hs:人;Mm:小鼠;Dr:斑马鱼;Dm:果蝇;Cg:牡蛎;Py:虾夷扇贝;Nv:海葵;Hv:水螅;红色:I-Smad亚群;橘红色:介导TGF-β通路的R-Smad亚群;黄色:介导BMP通路的R-Smad亚群;蓝色:Co-Smad亚群;a:NJ进化树;b:ML进化树;c:Bayes进化树.Hs,H. sapiens;Mm,M. musculus;Dr,D. rerio;Dm,D. melanogaster;Cg,C. gigas;Py,P. yessoensis;Nv,N. vectensis;Hv,H. vulgaris;Red indicates the I-Smad subgroup;orange indicates the R-Smad subgroup that mediates the TGF-β pathway;yellow indicates the R-Smad subgroup that mediates the BMP pathway;blue indicates the Co-Smad subgroup;a,b,c represented phylogenetic tree of NJ,ML,Bayes respectively.)
2.3 Smad基因在胚胎幼虫各发育时期的表达特征
不同Smad基因在胚胎各时期的表达水平各异,暗示Smad基因家族成员在虾夷扇贝早期发育过程中可能参与调控不同的生物学功能(见图5)。Smad3在受精卵和2~8细胞时期有显著的高表达,囊胚期开始该基因表达量迅速降低。Smad4在受精卵、囊胚和原肠胚时期有着高表达量,担轮期开始表达量显著降低。Smad5在囊胚、原肠胚和担轮幼虫3个时期的表达量最高,在受精卵和D型幼虫时期次之。Smad6的表达在进入原肠胚时期时,呈现出明显的增长趋势,约是囊胚时期表达量的2倍,可能在原肠胚时期发挥重要的作用。
2.4 Smad基因在成体组织的表达特征
本研究进一步分析了Smad基因在11种成体组织中的转录组数据(见图6)。结果发现,Smad基因家族在成体组织中的表达没有明显特异性,表达具有广谱性。Smad3在横纹肌和平滑肌中具有较高的表达量,FPKM值均在32以上,在平滑肌中达到40,在其它组织中也有稳定的表达,FPKM值在15左右,在精巢中表达量最低,暗示该基因可能与肌肉生长密切相关。Smad4基因在各个组织均有表达,表达量很相似,FPKM值在13左右,在血液和平滑肌中有表达量较高。Smad5在血细胞中特异性表达,FPKM值高达63,表达量约为其它组织的2~3倍,在精巢中表达量最低。Smad6在鳃和平滑肌中表达量较高,在精巢中的表达量最低,足、眼、消化腺等组织的表达量约是精巢的5倍。

(受精卵:Fertilized eggs;2~8细胞:2~8-cells;囊胚期:Blastulae;原肠期:Gastrulae;担轮幼虫:Trochophores;D形幼虫:D-shaped larvae;壳顶前期:Early umboperiod;壳顶中期:Middle umbo period:壳顶后期:Find umbo period:匍匐幼虫:Creeping larvae;稚贝:Juvenile。 标注字母完全不同的表示存在显著性差异(P<0.05). Different letters indicate significant differences(P<0.05).)
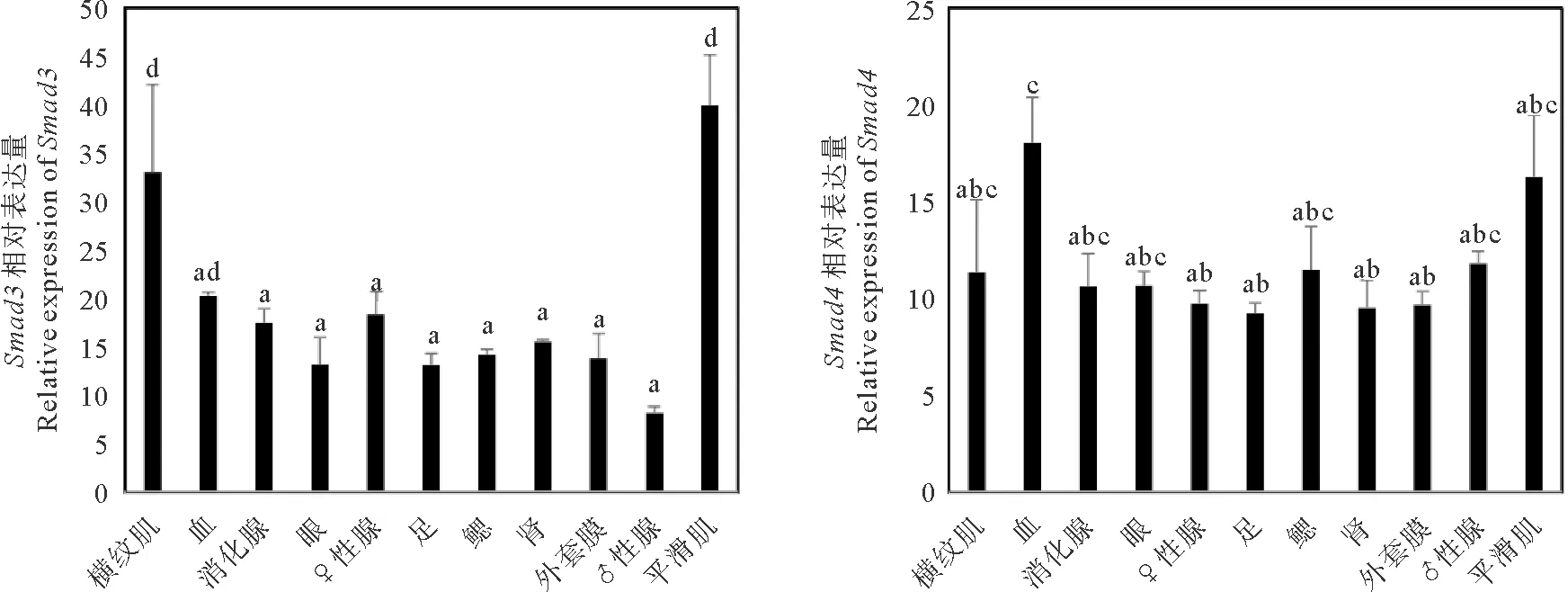

(横纹肌:Striated muscle;血:Blood;消化腺:Hepatopancreas;眼:Eye;♀性腺:Female gonad;足:Foot;鳃:Gill:肾:Kidney:外套膜:Mantle;♂性腺:Male gonad;平滑肌:Smooth muscle。任意两种组织间,标注字母完全不同的表示存在显著性差异(P<0.05)。 Different letters between tissues indicate significant differences(P<0.05).)
2.5 荧光定量PCR验证结果
在11个成体组织中选取平滑肌、横纹肌、血和鳃进行荧光定量PCR验证(见图7),结果发现Smad3在平滑肌中表达量最高,Smad4和Smad5在血液中表达量最高,Smad6在鳃中表达量最高,其表达模式与RNA-Seq分析结果一致。

(平滑肌:Smooth muscle;横纹肌:Striated muscle;血:Blood;鳃:Gill。任意两种组织间,标注字母完全不同的表示存在显著性差异(P<0.05)。Different letters between tissues indicate significant differences(P<0.05).)
3 讨论
对虾夷扇贝Smad基因的结构(见图1)和蛋白结构(见图2)进行分析发现,各个Smad的内含子数目、蛋白长度、MH1/MH2结构域位置等有明显的结构差异,基因全长方面差异较大,内含子与外显子数目也不相同,暗示它们在扇贝的生命活动中可能具有不同的作用。但其结构域大致相同,Smad蛋白包含三个不同的区域MH1、MH2和一个连接区。MH1位于Smad蛋白的N端,MH2的结构域位于Smad蛋白的C端,MH1和MH2之间的氨基酸序列是连接区[37]。MH1域可以与DNA键结合,此外,MH1域还具有11个氨基酸组成的发夹结构。MH2结构域含有约200个氨基酸,其氨基酸序列高度保守[38]。通过虾夷扇贝Smad蛋白结构域序列对比发现,Smad基因家族都含有一个保守的MH1和C末端MH2结构域,MH2结构域相对于MH1具有更高的保守性(见图3)。
通过进化分析的结果可以看出,虾夷扇贝Smad数量跟无脊椎动物比较相近,保留了后口动物中完整的Smad基因家族亚群,前期研究显示,Smad家族成员不仅影响细胞核内转录蛋白的活性,而且可以与转录激活因子相互作用,对基因起到调节作用,在动物生理学和疾病免疫过程中扮演重要角色[39]。Smad在胚胎发育时期和成体组织的表达模式反映出,该基因家族成员在虾夷扇贝的生命活动中具有重要的功能。大多数动物的胚胎发育都经历了从母体效应基因控制到胚胎基因组控制的转变,母体效应基因主要控制胚胎发育的早期阶段[40]。Smad3基因在受精卵和2~8细胞时期有较高的表达量,之后该基因表达量迅速降低,在以后的时期都处在很低的表达水平,推测该基因是母源基因,在胚胎早期细胞分裂过程中发挥重要作用。胚胎经过卵裂发育到中囊胚阶段后,母源基因控制转变为胚胎基因控制,这种基因控制的变化叫做“中期囊胚转换”(Midblastula transition,MBT)[41]。虾夷扇贝Smad6在胚胎发育早期表达量较低,在囊胚期及原肠胚时期表达量大幅增加,与胚胎基因组开始转录导致的“中期囊胚转换”现象相符合。
在虾夷扇贝各成体组织中,Smad基因均有不同程度的表达,说明该家族在组织中的表达具有广谱性。Smad1过量表达可以抑制肌肉特异性基因的表达,Smad1和Smad5被认为是BMP信号通路的两个主要转导介质,而BMP信号在脊椎动物早期发育过程中决定腹侧命运[42]。Smad5和Smad1是具有相似功能的一类基因[1, 43],这可能是因为脊椎动物基因组在进化过程中发生过加倍,导致基因数量加倍[44]。基因复制在新基因的产生和基因家族的扩张过程中发挥重要作用[45]。虾夷扇贝中Smad5在横纹肌和平滑肌中的高表达量也暗示着Smad5基因具有相似的功能。Smad3基因在横纹肌和平滑肌中的表达量约为其它组织的2倍,暗示其与肌肉的生长发育也密切相关。哺乳动物的研究表明Smad3是TGF-β的下游效应因子,可阻断MyoD诱导的肌源性分化[46]。Smad6在鳃中特异性表达,推测其在鳃中发挥调控作用,贝类的鳃具有呼吸和滤食功能,且在防御排毒过程中也发挥着重要作用。
本研究筛查鉴定出4个Smad基因。进化分析表明,虾夷扇贝中的Smad基因分为3类,分别是R-Smad亚群中的Smad3、Smad5;Co-Smad亚群中的的Smad4;I-Smad亚群中的Smad6。胚胎时期表达分析显示,Smad3基因在虾夷扇贝受精卵和2~8细胞时期有较高的表达量,之后该基因表达量迅速降低,推测其可能是母源基因,在胚胎早期细胞分裂过程中发挥重要作用。在胚胎发育早期Smad6表达量较低,但表达量在囊胚期及原肠胚期显著升高,可能与母型调控向合子型调控过渡的 “中期囊胚转换”有关。各成体组织的表达分析结果显示Smad3在横纹肌和平滑肌中有较高的表达量,推测该基因家族在虾夷扇贝的生长发育过程,尤其是肌肉生长方面起重要作用。
