副溶血弧菌胶体金快速检测试纸的研制及应用*
2021-01-20李嘉文绳秀珍唐小千战文斌
朱 慧, 李嘉文, 绳秀珍**, 唐小千, 邢 婧, 战文斌, 2
(1. 中国海洋大学水产动物病害与免疫学实验室,山东 青岛 266003;2. 青岛海洋科学与技术试点国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237)
副溶血弧菌(Vibrioparahaemolyticus)隶属于弧菌属(Vibrio),是一种致病性革兰氏阴性嗜盐菌,广泛分布于海水和海洋环境中,可引起海水养殖鱼类、贝类及甲壳类等经济动物流行病并导致暴发性死亡,已成为海水养殖动物的主要病原菌之一,给海水养殖产业造成严重的经济损失[1-3]。海产品中的副溶血弧菌也是常见的引起食物中毒或食源性疾病的重要病原菌[4-6]。副溶血弧菌的快速检测是预防和控制该病原菌传播及食源性中毒或疾病发生的关键。
目前,已见报道的副溶血弧菌检测方法主要有检测病原核酸的环介导等温扩增技术(LAMP)、聚合酶链式反应(PCR)、实时定量PCR等[7-10],这些技术各有优势,但在实用性上有一定的局限,耗时长,操作复杂,需要专业设备,基层的普通养殖人员难以完成检测操作。近年来发展起来的重组酶聚合酶扩增(RPA)技术被称为是可以替代PCR的核酸检测技术,有学者建立了副溶血弧菌Real-time RPA技术[11],该技术检测时间短,但是需要提取检测病原的核酸,仍然不能满足现场使用的需求。副溶血弧菌免疫学检测技术已有酶联免疫吸附法(ELISA)和免疫荧光抗体技术[12-13],也需要操作经验和专业仪器设备。胶体金免疫层析试纸具有易于携带、检测时间短、操作简便、结果肉眼可见、不需要专业设备、适用于现场等优点,是一种十分有发展前景的现场快速检测技术,已在医学检验中得到广泛应用,但是,水产动物病原的现场快速检测试纸尚未得到很好地开发,关于副溶血弧菌胶体金快速检测试纸的资料较少[14]。
细菌是多种抗原成分组成的复合体,不同病原菌之间可能存在的共同抗原蛋白会导致交叉免疫反应性,因此,排除交叉反应对检测结果判定的干扰是免疫学技术检测病原时需要解决的关键问题。我们前期曾制备了鱼类病原性溶藻弧菌快速检测试纸[15],能够准确鉴别溶藻弧菌感染及其与其他菌的交叉反应。为了满足副溶血弧菌快速检测的需求,本文制备了兔抗副溶血弧菌多克隆抗体,标记20 nm胶体金后制得金标垫,提取副溶血弧菌的外膜蛋白、鞭毛蛋白、胞外产物和全菌蛋白,将不同浓度的4种抗原蛋白作为4条检测线,特别在T4线设置全菌蛋白,以羊抗兔IgG作为质控线,基于竞争免疫层析技术制备了副溶血弧菌胶体金快速检测试纸,对患病牙鲆组织的检测结果显示其能够准确鉴别副溶血弧菌感染。
1 材料与方法
1.1 实验菌株与动物
实验所用副溶血弧菌(V.parahaemolyticus)、溶藻弧菌(V.alginolyticus)、鱼肠道弧菌(V.ichthyoenteri)、鳗弧菌(V.anguillarum)、哈维氏弧菌(V.harveyi)由本实验室保存。6周龄纯种雌性新西兰大白兔购自青岛市药品检验所。
1.2 副溶血弧菌多抗制备及效价测定
1.2.1副溶血弧菌兔多抗制备与纯化 副溶血弧菌使用LB液体培养基中培养,后用福尔马林灭活。用0.01 mol·mL-1磷酸盐缓冲液(PBS,pH= 7.4)调整菌体浓度至1.0×108cfu·mL-1,保存于-20 ℃备用。灭活菌液分4次免疫纯种新西兰大白兔,初次免疫将灭活菌液混入弗氏完全佐剂(1∶1, v/v),背部6点皮下注射;1周后,将灭活菌液与弗氏不完全佐剂混匀(1∶1),背部皮下注射免疫;间隔2周后重复免疫1次,然后在1周后耳缘静脉注射灭活菌液。最后一次免疫1周后取血,将血液置于离心管中,室温静置1 h后,4 ℃过夜。次日,3 500×g离心15 min,取上清即为抗血清。
运用辛酸-硫酸铵法对兔抗血清进行纯化。抗血清用0.06 mol·mL-1乙酸缓冲液(pH=4.0;1∶4,v/v)稀释, 然后用0.1 mol·mL-1NaOH调整血清稀释液pH至4.5;室温下,用电磁搅拌器边搅拌边缓慢滴加辛酸,1 mL血清稀释液中加入25 μL辛酸,搅拌30 min。将混合液离心,收集上清并用45 pm微孔滤膜过滤,加入10%的无菌PBS,用5.0 mol·mL-1NaOH调整pH至7.4。冰浴条件下,按0.277 g·mL-1的终浓度缓慢加入硫酸铵粉末并搅拌均匀,4 ℃静置过夜。次日,在4 ℃下离心,收集沉淀并用少量无菌PBS溶解,超纯水中透析24 h;冻干后,将粉末用无菌PBS重悬至合适浓度并通过十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析纯化的兔多抗,-80 ℃保存备用。
1.2.2 副溶血弧菌兔多抗效价测定 利用ELISA技术测定兔抗副溶血弧菌多抗的效价。在96孔酶标板中加入100 μL浓度为5×107cfu·mL-1副溶血弧菌菌液,包被过夜,次日用含0.05% Tween-20的PBST洗涤,每孔加入200 μL的3%牛血清白蛋白(BSA),37 ℃封闭1 h;PBST再次洗涤后,每孔加入100 μL梯度稀释的副溶血弧菌兔多抗,设置3个平行, PBS为阴性对照,37 ℃孵育1 h;PBST洗涤后,每孔加入100 μL碱性磷酸酶(AP)标记羊抗兔IgG抗体,37 ℃孵育1 h,PBST洗涤,再加入200 μL底物显色液,避光发色5 min后酶标仪测定OD405值。
1.3 副溶血弧菌抗原组分的提取
1.3.1 外膜蛋白的提取 副溶血弧菌外膜蛋白的提取参考熊焰等的方法[16]。将扩大培养后的副溶血弧菌离心,无菌PBS洗涤后重悬至原菌液体积1/25,加入少量10%蔗糖,室温下混匀后,置于-20 ℃下作用15 min;取出混合液,加入等体积0.4% Triton-X100,搅拌混匀作用30 min,10 000 ×g离心30 min,取上清并用0.45 pm微孔滤膜过滤,冰浴条件下缓慢加入2.5倍体积冷无水乙醇(4 ℃),-20 ℃静置过夜;次日,混合液于4 ℃、10 000×g离心30 min,沉淀经过Tris-NaCl洗涤重悬后,加入等体积0.6 mol·L-1碘化钾溶液,37 ℃作用1 h后离心,取上清于冰浴条件下加入2.5倍体积4 ℃的无水乙醇, -20 ℃静置过夜。次日,将混合液4 ℃下离心,无菌PBS重悬沉淀,采用上述 SDS-PAGE分析外膜蛋白。SDS-PAGE结束后,取出凝胶放在CuCl2可逆染色液中染色,黑背景光照条件下观察蛋白带,切取主要蛋白条带,于脱色液中脱色,超纯水冲洗胶条3次。将胶条切成小块后装入透析袋中,加入洗脱缓冲液,置于水平电泳仪中恒流40 mA电泳8 h。电泳结束后,逆转电流电泳5 min,吸出洗脱缓冲液,超纯水中透析24 h。冻干后,无菌PBS溶解,Bradford法[17]测定浓度,-80 ℃冻存备用。
1.3.2 鞭毛蛋白的提取 副溶血弧菌鞭毛蛋白的提取参考张晓佩等[18]方法并略有改动。将培养的副溶血弧菌离心后,用无菌0.01 mol·mL-1PBS洗涤并重悬至原菌液体积的1/20;用1.0 mol·mL-1盐酸将菌液的pH调整至2.0,室温搅拌30 min,然后4 ℃、1 500 ×g离心30 min,取上清液4 ℃、533 000×g离心1 h,用1 mol·mL-1NaOH调整上清液pH至7.2。在冰浴条件下,加入硫酸铵粉末至终浓度为2.67 mol·mL-1,搅拌30 min,4 ℃静置过夜。次日,4 ℃下再次离心15 min,取沉淀溶于无菌PBS中,SDS-PAGE分析后,切胶回收主要条带蛋白,洗脱收集蛋白,超纯水中透析24 h。冻干后,粉末溶于PBS中,Bradford法测定浓度。
1.3.3 胞外产物的提取 根据Inamura等[19]的方法提取副溶血弧菌的鞭毛蛋白。副溶血弧菌于LB液体培养基中37 ℃培养24 h,取1 mL的液体培养物在每个预先放置了一层赛璐玢的LB琼脂平板上涂布均匀,37 ℃条件下培养24~48 h;每个平板用无菌PBS洗下菌体;收集菌悬液,在4 ℃下7 000×g离心30 min,收集上清。冰浴条件下,加入硫酸铵粉末至终浓度为2.0 mol·mL-1,搅拌后4 ℃放置过夜。次日,4 ℃下10 000×g离心1 h,无菌PBS重悬沉淀,SDS-PAGE分析后,切胶回收主要条带蛋白,洗脱收集蛋白,用超纯水透析24 h。冻干后,无菌PBS调至合适浓度,Bradford法测定浓度,-80 ℃冻存。
1.3.4 全菌破碎蛋白的制备 将副溶血弧菌浓度调至1×108cfu·mL-1,超声波破碎仪破碎(Sonics & Materials;振幅39%;pulse on,3 s;pulse off,3 s)至液体澄清,即为副溶血弧菌破碎蛋白。然后,超纯水中透析、冻干,粉末用PBS溶解,Bradford法测定浓度,于-80 ℃冻存备用。
1.4 间接ELISA法分析免疫交叉反应
为了分析副溶血弧菌兔多抗与其他弧菌的交叉反应性,同样方法提取了溶藻弧菌、鱼肠道弧菌、哈维氏弧菌、鳗弧菌的外膜蛋白、鞭毛蛋白、胞外产物和全菌破碎蛋白,运用间接ELISA分析副溶血弧菌兔多抗与这些抗原蛋白的免疫反应。将抗原蛋白分别于96孔酶标板中4 ℃过夜,每种蛋白设3个平行,以无菌0.01 mol·mL-1PBS作为阴性对照;次日, PBST洗涤3次,加入3% BSA,于37 ℃封闭1 h,PBST洗涤后加入兔抗副溶血弧菌多抗(1∶2 000),37 ℃孵育1 h,PBST洗涤后加入100 μL AP标记的羊抗兔IgG(1∶8 000),37 ℃孵育1 h;PBST洗涤,加入底物显色液,暗处反应10~20 min,然后加入2 mol·mL-1NaOH溶液终止显色反应, 405 nm处检测OD值。计算各实验孔与阴性对照光吸收值之比(P/N),当P/N≥2.1时为阳性。计算4种抗原蛋白间的P/N值,绘制“P/N值-抗原蛋白”直方图,根据直方图分析免疫交叉。
1.5 胶体金最适标记蛋白浓度的确定及金标抗体的制备
按照我们前期使用的方法制备胶体金[15],透射电镜观察确定胶体金颗粒大小一致,形态呈椭球形或球形,无聚团现象后用于实验。用0.1 mol·mL-1碳酸钾溶液和0.1 mol·mL-1盐酸将制得的20 nm胶体金pH调至8.4[15],然后将胶体金设置10个浓度梯度(分别为1~10 μg·mL-1),每个浓度取出1 mL胶体金,分别加入10 μL不同浓度的副溶血弧菌兔多抗,迅速混匀,室温下静置30 min后加入10 μL 5% 的NaCl,混匀后室温静置2 h。分光光度计测定每个浓度梯度在520 nm处的OD值,以OD值为纵轴、蛋白浓度为横轴制作曲线图,取曲线中OD值最大处对应的兔多抗用量为稳定胶体金的最低蛋白量,在此基础上加20%的蛋白标记量即是最适合的蛋白标记浓度。
用0.1 mol·L-1碳酸钾将胶体金pH调至8.4[15],按照确定的最合适标记浓度加入副溶血弧菌兔多抗,搅拌20 min后于室温下静置10 min;用BSA调整使其终浓度为1%,然后搅拌15 min,室温静置10 min;4 ℃下1 200×g离心15 min,取上清液经13 500×g(4 ℃)离心30 min。取沉淀,金标多抗洗涤液(含1% BSA的0.01 mol·L-1PBS,pH=8.4)洗涤后离心,取沉淀,金标多抗保存液(0.01 mol·L-1PBS中含3%蔗糖,1% BSA,0.2% Tween-20和0.02% NaN3,pH=8.4)重悬沉淀至原来体积的1/10,即为金标兔抗副溶血弧菌多抗。
1.6 4条检测线抗原蛋白特异性及划线浓度的确定
利用间接ELISA法测定副溶血弧菌4种抗原蛋白在相应检测线上的划线浓度。在96孔酶标板中加入副溶血弧菌的4种抗原蛋白,每种蛋白设置3个平行,阴性对照为无菌PBS,4 ℃包被过夜;次日, PBST洗3次,然后用 3%的BSA于37 ℃封闭1 h;PBST洗涤后,加入副溶血弧菌兔多抗(1∶2 000)于37 ℃孵育1 h; PBST洗涤后,加入 AP标记的羊抗兔IgG(1∶8 000)于37 ℃孵育1 h;PBST洗涤,加入底物显色液放于暗处10~20 min,后加入NaOH溶液终止显色反应, 405 nm处检测OD值。计算各实验孔与阴性对照孔的光吸收值之比(P/N),P/N≥2.1显示为阳性。计算4种抗原蛋白间的P/N比值,并根据P/N比值和蛋白包被浓度来确定划线浓度。
1.7 副溶血弧菌快速检测试纸的结构设计
根据交叉反应分析结果,将病原菌的多种抗原组分排列在一起时,它们能够同时与该病原菌的抗体发生反应,而其他菌只有共同抗原发生反应。由此,将副溶血弧菌的4种抗原排列在一起作为4条检测线(T1~T4,制备详见1.8.1),并将T4线设计为全菌蛋白,用金标副溶血弧菌抗体制备金标垫,羊抗兔IgG作为质控抗体,设计副溶血弧菌快速检测试纸。利用竞争免疫层析技术进行检测,待检样品中的副溶血弧菌会与检测线上的抗原蛋白竞争结合金标垫上的金标副溶血弧菌抗体,使检测线上的抗原无法与金标副溶血弧菌抗体反应,检测线全部不显色;若待检样品中不含副溶血弧菌,检测线上的抗原就会与金标副溶血弧菌抗体结合,检测线全部显色;若待检样品中含有其他病原菌,只有其共同抗原与检测线上的副溶血弧菌抗原竞争结合金标抗体,部分检测线不显色。
1.8 副溶血弧菌快速检测试纸的制备
1.8.1 金标垫及检测层的制备 将玻璃纤维膜四周宽0.5 cm的边缘整齐的裁剪掉,并将玻璃纤维膜裁成宽0.8 cm的小条。将新制备的金标兔抗副溶血弧菌多抗用喷膜仪(Biodot,XYZ3060)均匀地喷涂在玻璃纤维膜小条上,冷冻干燥,避光封存备用。
将副溶血弧菌4种抗原蛋白的浓度分别调至1.5节中所确定的划线浓度,用喷膜仪将外膜蛋白、鞭毛蛋白、胞外产物和全菌蛋白均匀喷涂于硝酸纤维素膜上,分别作为检测线T1、T2、T3和T4,4条检测线之间相距1.5 mm。将0.5 mg·mL-1羊抗兔IgG喷涂于硝酸纤维膜上作为质控线,与T4相距5 mm,靠近吸水垫,而检测线T1靠近样品垫(见图1)。
1.8.2 试纸条的组装 取出PVC底板,将准备好的硝酸纤维素膜、金标垫、样品垫和吸水垫依次粘贴,组装成试纸条整版。组装示意图如图1所示,首先粘贴上硝酸纤维膜,其次是吸水垫和金标垫,其中硝酸纤维膜的上端边缘重叠于吸水垫边缘之下,硝酸纤维素膜的下端边缘覆盖于金标垫上端边缘之下,最后组装样品垫(样品垫的上端边缘重叠在金标垫的下端边缘之上)。用切条机裁剪组装好的试纸条,宽度设置为3.75 mm。裁剪好的试纸条装入塑料卡盒中,密封于有干燥剂的铝箔小袋中,低温保存备用。
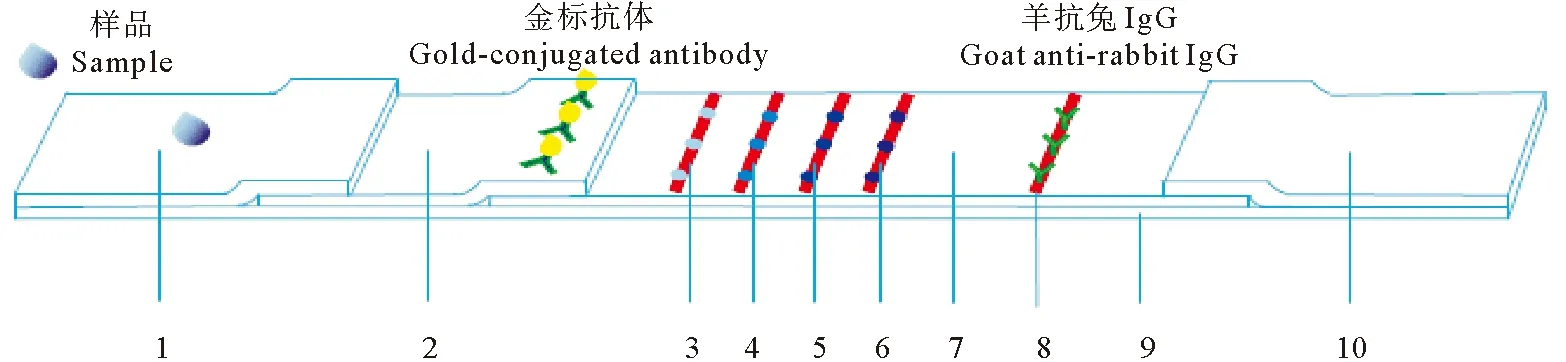
(1.样品垫;2.金标垫;3~6.检测线T1~T4(T线),分别喷涂副溶血弧菌外膜蛋白(T1)、鞭毛蛋白(T2)、胞外产物(T3)和全菌蛋白(T4);7. 硝酸纤维素膜(NC膜);8. 质控线(C线);9. PVC底板;10.吸水垫。1. Sample pad;2. Glass fiber containing anti-V. parahaemolyticus polyclonal antibody;3~6. Outer membrane protein (T1), flagellum protein (T2), extracellular products (T3) and whole-cell bacterial protein (T4) of V. parahaemolyticus were used as test lines (T lines) respectively; 7. Nitrocellulose membrane;8. Control Line (C line); 9. PVC board;10. Absorption pad.)
1.9 检测试纸的特异性
将副溶血弧菌、鳗弧菌、鱼肠道弧菌、溶藻弧菌、哈维氏弧菌分别离心纯化,用无菌0.01 mol·mL-1PBS(pH=7.4)调至浓度为1×107cfu·mL-1,用PBS作为阴性对照,使用制备的副溶血弧菌快速检测试纸进行检测,10 min后肉眼观察检测结果并拍照,确定试纸的检测特异性。
1.10 检测试纸的灵敏性
用无菌0.01 mol·mL-1PBS(pH=7.4)将副溶血弧菌调至5×107、5×106、5×105、5×104cfu·mL-14个浓度,使用制备的副溶血弧菌快速检测试纸进行检测,10 min后肉眼观察检测结果并拍照,确定试纸的检测灵敏性。
1.11 牙鲆组织中副溶血弧菌的检测
取感染了副溶血弧菌发病的牙鲆肝、脾、肾组织混合,每1 g组织样品用5 mL无菌PBS在冰浴条件下充分研磨3~5 min,用筛绢过滤得到的研磨液作为检测样品液,使用制备的副溶血弧菌检测试纸进行检测,健康的牙鲆组织液和无菌PBS分别作为阴性对照。
采用ELISA实验作为对照,上述患病牙鲆的检测样品液为包被液,检测牙鲆组织中的副溶血弧菌,确定快速检测试纸的检测准确性。
2 结果
2.1 副溶血弧菌兔多抗的效价
纯化的副溶血弧菌兔多抗包括IgG重链和轻链蛋白,说明纯化抗体可用于胶体金检测试纸的制备(见图2 A的条带)。ELISA检测结果显示(见表1),副溶血弧菌兔多抗的稀释倍数低于1×105时,其OD405值皆大于阴性对照PBS的OD405值的2倍,而当抗体稀释倍数为2×105时,OD405值小于阴性对照的OD405值的2倍,所以制备的副溶血弧菌兔多抗的效价为1×105。
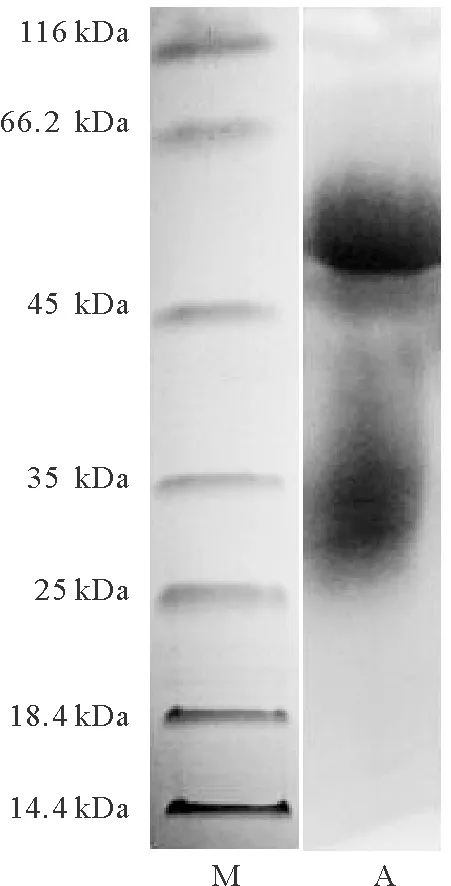
(M:蛋白质分子量标准;A:副溶血弧菌兔多抗。M: Marker; A: Anti-V. parahaemolyticus polyclonal antibody.)
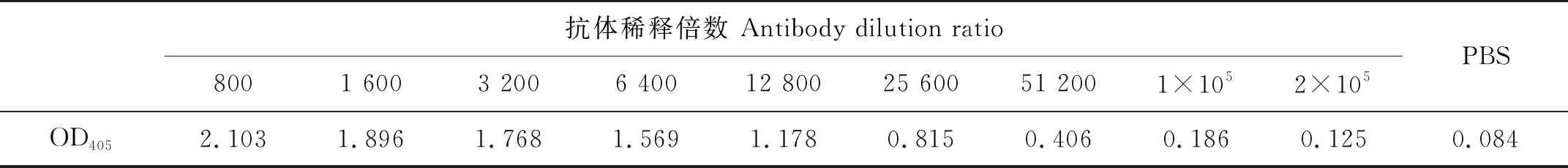
表1 副溶血弧菌兔多抗的效价
2.2 副溶血弧菌抗原组分SDS-PAGE分析结果
SDS-PAGE图谱显示(见图 3),副溶血弧菌外膜蛋白条带主要位于42、38、36、32和26 kDa;鞭毛蛋白主要条带位于72、 37和32 kDa;胞外产物主要条带位于37、28、26、22和18 kDa。选取这些主要蛋白用作快速检测试纸的检测线抗原蛋白。
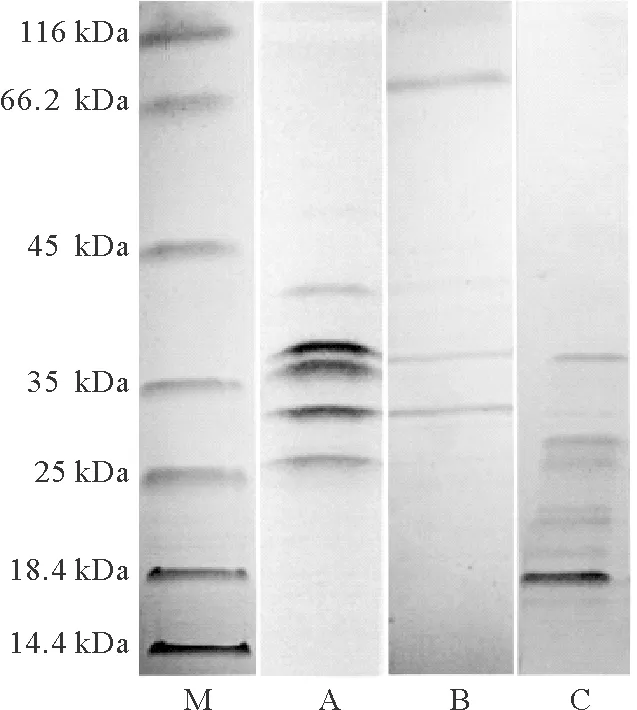
(M:蛋白质分子量标准;A:外膜蛋白;B:鞭毛蛋白;C:胞外产物。M: Marker; A: Outer membrane protein; B: Flagellin protein; C: Extracellular products of V. parahaemolyticus.)
2.3 免疫交叉分析结果
副溶血弧菌兔多抗与副溶血弧菌外膜蛋白、鞭毛蛋白、胞外产物和全菌蛋白的免疫反应呈现强阳性,与溶藻弧菌的外膜蛋白和全菌蛋白、鱼肠道弧菌的全菌蛋白、哈维氏弧菌的胞外产物也呈现阳性或弱阳性,表明副溶血弧菌兔多抗与这些抗原有不同程度的免疫交叉反应。副溶血弧菌兔多抗与鳗弧菌的4种抗原组分没有明显的交叉反应(见图4)。

(A1~A4:副溶血弧菌外膜蛋白、鞭毛蛋白、胞外产物和全菌蛋白;B1~B4:溶藻弧菌外膜蛋白、鞭毛蛋白、胞外产物和全菌蛋白;C1~C4:鳗弧菌外膜蛋白、鞭毛蛋白、胞外产物和全菌蛋白;D1~D4:鱼肠道弧菌外膜蛋白、鞭毛蛋白、胞外产物和全菌蛋白;E1~E4:哈维氏弧菌外膜蛋白、鞭毛蛋白、胞外产物和全菌蛋白;虚线:P/N =2.1。 A1~A4: Outer membrane protein, flagellum protein, extracellular products and whole-cell bacterial protein of V. parahaemolyticus; B1~B4: Outer membrane protein, flagellum protein, extracellular products and whole-cell bacterial protein of V. alginolyticus; C1~C4: Outer membrane protein, flagellum protein, extracellular products and whole-cell bacterial protein of V. anguillarum; D1~D4: Outer membrane protein, flagellum protein, extracellular products and whole-cell bacterial protein of V. ichthyoenteri; E1~E4: Outer membrane protein, flagellum protein, extracellular products and whole-cell bacterial protein of V. harveyi; The dashed line represented P/N = 2.1.)
2.4 胶体金最适标记蛋白浓度
OD值法测定副溶血弧菌兔多抗标记胶体金的最佳蛋白量,结果显示蛋白浓度小于3 μg·mL-1时,胶体金的OD值呈上升趋势;蛋白浓度大于3 μg·mL-1时,OD值呈下降趋势后趋于平缓,表明3 μg·mL-1为稳定胶体金的最低蛋白量,最佳标记浓度为3.6 μg·mL-1(最低蛋白量基础上加20%,见图 5)。
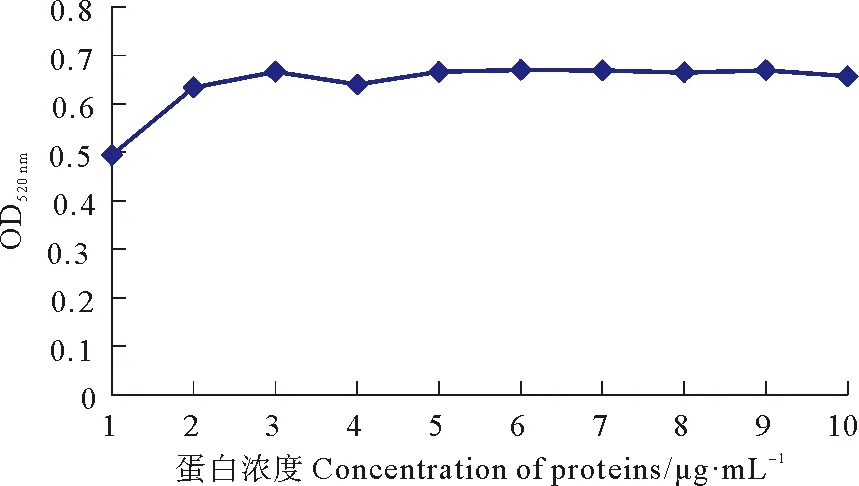
图5 OD值曲线法确定胶体金标记副溶血弧菌兔多抗的最佳标记浓度
2.5 4种抗原蛋白特异性及划线浓度
副溶血弧菌4种蛋白的OD405值与PBS OD405值的比值(P/N值)皆大于等于2.1,表明4种抗原蛋白均可与副溶血弧菌兔多抗特异性结合(见表2)。根据4种抗原蛋白的浓度和P/N值确定副溶血弧菌快速检测试纸的4条检测线T1、T2、T3和T4上的抗原蛋白划线浓度,分别为外膜蛋白0.8 mg·mL-1、鞭毛蛋白0.3 mg·mL-1、胞外产物1.0 mg·mL-1、全菌蛋白0.4 mg·mL-1。

表2 ELISA法确定副溶血弧菌4种抗原蛋白的划线浓度Table 2 The dispensed concentration of four antigens of V. parahaemolyticus determined by ELISA
2.6 检测结果的判读方法
根据竞争免疫层析法原理,副溶血弧菌快速检测试纸检测结果的判读方法如下(见图6A):(1)质控线(C线)显色,4条检测线T1~T4全部不显色,表明检测样品中含有副溶血弧菌与检测线上的抗原蛋白竞争结合金标副溶血弧菌抗体,结果为阳性;(2)质控线显色,4条检测线T1~T4全部显色,表明检测样品中不含副溶血弧菌,金标副溶血弧菌抗体与检测线上的抗原结合而显色,结果为阴性;(3)质控线显色,检测线T4线呈现红色,而检测线T1、T2、T3中个别条带不显色,表明检测样品中不含副溶血弧菌,但含有与副溶血弧菌具有共同抗原的其他病原菌,结果为其他菌的交叉反应;(4)质控线和检测线T1~T4都不显色,表明该试纸失效或操作出现问题。
2.7 试纸的特异性
对鳗弧菌、鱼肠道弧菌、溶藻弧菌、哈维氏弧菌和副溶血弧菌使用制备的副溶血弧菌快速检测试纸进行检测,结果如图6B所示,当检测鳗弧菌、鱼肠道弧菌、溶藻弧菌、哈维氏弧菌时(见图6B 1~4),质控线和T1~T4检测线皆显色,表明结果为副溶血弧菌阴性,但是鱼肠道弧菌(见图6B-2)、溶藻弧菌(见图6B-3)使T4检测线较PBS组(见图6B-5)变浅,哈维氏弧菌的T2、T3线较PBS组变浅,表明存在一定程度的交叉反应;PBS使C线和4条T线皆显色;检测副溶血弧菌时,仅C线显色,4条检测线皆不显色,即检测结果为阳性(见图6B-6)。
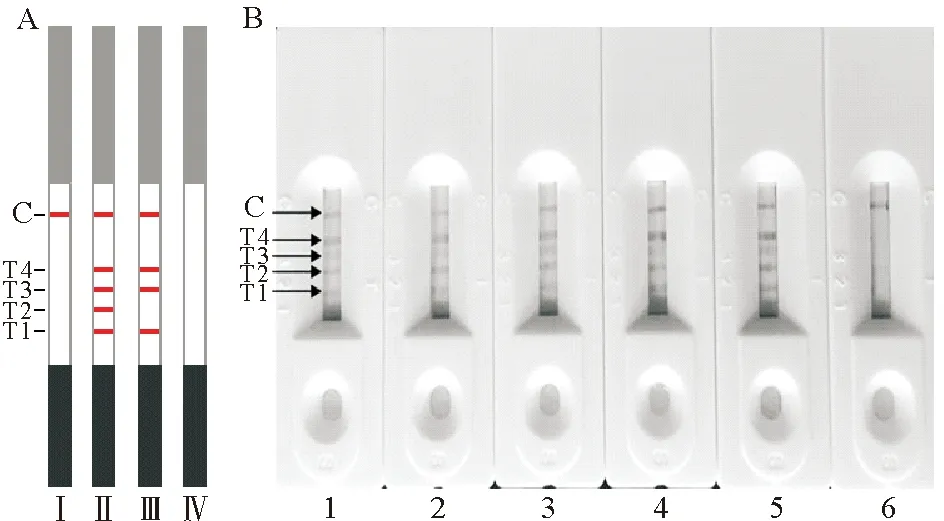
(A: Ⅰ. 阳性结果;Ⅱ. 阴性结果;Ⅲ. 交叉反应;Ⅳ. 试纸失效。B: 1. 鳗弧菌检测结果;2. 鱼肠道弧菌检测结果;3. 溶藻弧菌检测结果;4. 哈维氏弧菌检测结果;5. PBS阴性对照;6. 副溶血弧菌检测阳性结果。A: Ⅰ. Positive results;Ⅱ. Negative results;Ⅲ. Cross reaction;Ⅳ. Invalid results. B: 1. V. anguillarum;2. V. ichthyoenteri;3. V. alginolyticus;4. V. harveyi;5. PBS;6. V. parahaemolyticus.)
2.8 试纸的灵敏性
使用制备的副溶血弧菌快速检测试纸检测5×107、5×106、5×105、5×104cfu·mL-1的副溶血弧菌,发现在检测5×107、5×106、5×105cfu·mL-1的副溶血弧菌时,质控线显色而T1~T4线不显色,浓度为5×104cfu·mL-1时,T1~T4线开始显色,说明5×105cfu·mL-1即为该试纸的检测限(见图7)。
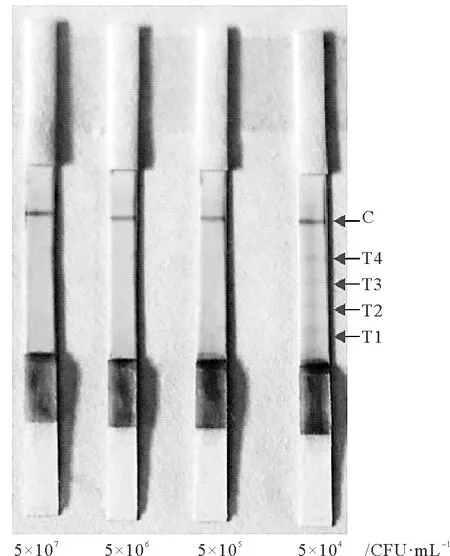
图7 副溶血弧菌快速检测试纸的检测灵敏性
2.9 试纸的检测准确性
使用副溶血弧菌快速检测试纸检测人工感染副溶血弧菌发病的牙鲆肝、脾、肾混合样品,发现T1~T4检测线皆不显色,只有质控线显色,结果判定为阳性;而健康牙鲆组织样品和PBS使4条检测线和质控线皆显色,结果判定为阴性(见图8)。

(i:健康牙鲆组织样品检测结果;ii:PBS阴性对照;iii:患病牙鲆组织检测结果。i: Negative control using the tissues of healthy flounder;ii: Negative control using PBS;iii: Positive results for V. parahaemolyticus in flounder.)
ELISA的结果显示牙鲆组织样品OD值与健康牙鲆组织阴性对照组OD值的比值(P/N值)大于2.1,表明为副溶血弧菌阳性(见图9),与试纸的检测结果一致。
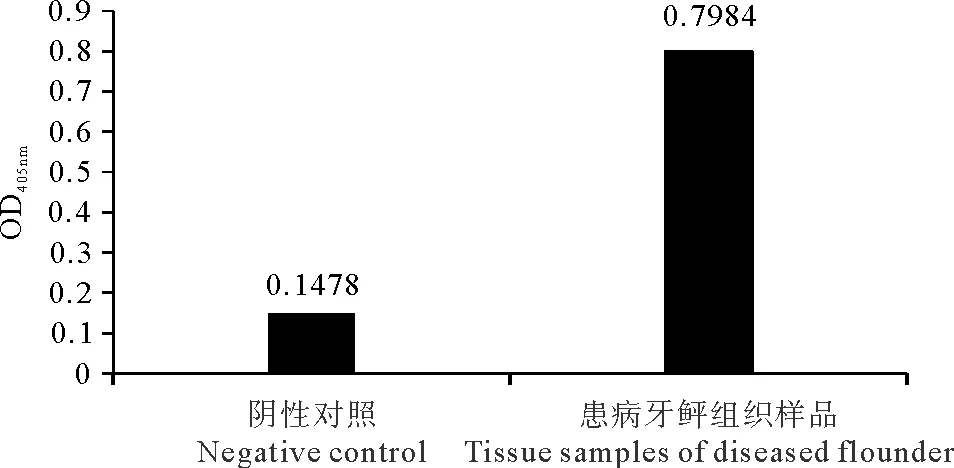
图9 ELISA检测牙鲆样品中副溶血弧菌
3 讨论
副溶血弧菌可引起水产养殖鱼、虾、蟹、贝等经济动物的流行性和暴发性死亡[2-3],是水产动物特别是海水鱼类弧菌病的主要致病菌,有时会与溶藻弧菌、哈维氏弧菌等发生混合感染[20],而食用被副溶血弧菌污染的海产品可引起急性肠胃炎、败血病等疾病[4-5]。传统的副溶血弧菌核酸和免疫学检测技术多局限于实验室检测,耗时长、需要专业仪器和人员,不适用于现场的实时检测,检测结果滞后无法满足养殖者及时制定防控决策的需求,延误治疗时机,急需快速、简便、准确的现场检测诊断技术。免疫胶体金技术是一种很有发展前景的现场检测技术,但是排除病原菌之间免疫交叉反应对结果判定的干扰是其需要解决的关键问题。本文使用副溶血弧菌4种抗原蛋白作为4条检测线,4种检测线抗原设置不同浓度,并在T4线设置全菌蛋白,采用竞争免疫层析原理制备了副溶血弧菌快速检测试纸,确定了4条检测线同时不显色判定为阳性,同时显色判定为阴性,个别检测线不显色则为交叉反应的结果判定方法,对患病牙鲆组织的检测结果表明该试纸可以用于副溶血弧菌的准确检测。
为了解决免疫学检测技术存在的免疫交叉反应干扰检测准确性的问题,一般是通过筛选病原独有的抗原或特异性抗体的策略,但是费时费力。本文制备了副溶血弧菌兔多抗,分析了副溶血弧菌抗体与5种弧菌的外膜蛋白、鞭毛蛋白、胞外产物及全菌蛋白的免疫交叉反应,发现副溶血弧菌与其自身的4种抗原蛋白皆发生较强的结合反应,但仅与其他弧菌的个别共同抗原发生较弱的交叉反应,根据此现象,如果增加抗原蛋白种类数作为多条检测线,可根据所有抗原蛋白同时与病原菌抗体反应则为阳性结果,个别抗原反应则为交叉反应,从而将二者区分开。本文同时使用副溶血弧菌的外膜蛋白、鞭毛蛋白、胞外产物和全菌蛋白作为4条检测线,利用副溶血弧菌抗体作为金标抗体,根据竞争免疫层析原理,当检测样品中含有副溶血弧菌时,则会与金标副溶血弧菌抗体结合,导致检测线上4种抗原蛋白无法与金标副溶血弧菌抗体的结合,从而4条检测线同时不显色;相反,则同时显色;如果检测样品中含有其他菌,则其含有的共同抗原与检测线上副溶血弧菌的相应抗原竞争结合金标抗体,从而使该检测线不显色或着颜色变浅,可以判定为交叉反应。为了避免其他菌含有多种共同抗原而出现所有检测线皆不显色的情况,本研究在T4线上特别设置了副溶血弧菌全菌蛋白,因全菌蛋白中一定含有除共同抗原以外的其他抗原蛋白,这些抗原蛋白与金标副溶血弧菌抗体反应而使T4线显色,从而避免其他菌使4条检测线同时不显色而造成假阳性。目前,文献报道的胶体金快速检测试纸一般设置一条检测线,或者在多条检测线上喷涂不同浓度的相同抗原/抗体从而实现定量检测[21-22],本文采用了将4种抗原作为4条检测线来检测一种病原菌的策略。另外,因为副溶血弧菌中不同抗原组分的含量不同,为了使4条检测线能够同时显色或同时不显色,本文利用ELISA测定了4种抗原组分与副溶血弧菌兔多抗反应的OD值,计算其与阴性对照的P/N值,根据P/N值确定检测线上外膜蛋白、鞭毛蛋白、胞外产物和全菌蛋白4种抗原蛋白的划线浓度分别为0.8、0.3、1.0 和0.4 mg·mL-1。利用制备的副溶血弧菌快速检测试纸对鳗弧菌、鱼肠道弧菌、溶藻弧菌、哈维氏弧菌和副溶血弧菌进行检测,只有副溶血弧菌使4条检测线同时不显色,其他弧菌使部分检测线颜色变浅,根据本文确定的结果判定方法,可以准确区分副溶血弧菌感染及其他菌的交叉反应,即其他弧菌的交叉反应不会影响对副溶血弧菌检测结果的准确判断,而对人工感染的牙鲆组织的检测结果也与ELISA结果一致,表明制备的试纸具有很好的特异性和检测准确性。对于副溶血弧菌与其他病原菌混合感染的情况,使用该试纸只能检测到副溶血弧菌阳性,其他菌的存在不会影响副溶血弧菌的准确鉴定,但该试纸无法鉴别混合感染,需要联合使用其他病原菌快速检测试纸或者借助于多病原高通量检测技术鉴别混合感染。本实验室前期曾研制了鳗弧菌、海豚链球菌(Streptococcusiniae)、杀鲑气单胞菌(Aeromonassalmonicida)、 荧 光 假 单 胞 菌(Psedomonasfluorescens)、 迟 缓 爱 德 华 氏 菌(Edwardsiellatarda)及海分支杆菌(Mycobacteriummarinum)6 种病原菌同步检测免疫芯片[26],以及副溶血弧菌、鱼肠道弧菌、鳗弧菌、溶藻弧菌、哈维氏弧菌和河流弧菌(Vibriofluvialis)的血清学诊断抗原芯片[27],适用于混合感染情况下的多病原同步鉴别。因此,该试纸可以用于副溶血弧菌感染的大量样品的快速初筛,联合使用其他病原菌的快速检测试纸或者配合使用多病原高通量检测技术可以解决混合感染情况下病原的准确鉴别问题。
目前,检测病原菌的胶体金免疫层析试纸的灵敏度一般在105~106cfu·mL-1[23-25],本文制备的副溶血弧菌快速检测试纸的灵敏度为5×105cfu·mL-1,达到了同类试纸的检测水平。但是,样品中副溶血弧菌浓度低于5×105cfu·mL-1时,4条检测线会显色,从而出现假阴性结果,限制了其在感染早期的病原检测中的应用,因此,还有待于通过优化抗体及其他实验条件参数提高灵敏度。
4 结语
本文基于竞争免疫层析原理制备的副溶血弧菌快速检测试纸具有很好的检测特异性和准确性,制备试纸时仅需要制备副溶血弧菌兔多抗作为金标抗体,提取其外膜蛋白、鞭毛蛋白、胞外产物和全菌蛋白作为4条检测线(T1~T4),无需筛选特异性抗原/抗体,即可实现副溶血弧菌的准确检测,不受其他菌交叉反应的干扰。使用该试纸进行检测,操作简便快速,可以在10 min内得到肉眼直视的检测结果,适用于病原性副溶血弧菌的现场快速检测,具有较高实用价值,研究结果为水产养殖中副溶血弧菌的快速检测提供了有力工具。
