假病毒在肠道病毒相关研究中的应用
2021-01-19霍雅倩综述毛群颖李秀玲审校
霍雅倩 综述,毛群颖,李秀玲 审校
1.上海生物制品研究所有限责任公司,上海200050;2.中国食品药品检定研究院肝炎病毒疫苗室,北京100050
肠道病毒(enterovirus,EV)属于小 RNA 病毒科肠道病毒属,是一类无包膜病毒,包括EV-A ~L 共12 个组,约 163 种病毒(https:/ / talk.ictvonline.org.)。EV为20 ~30 nm 的二十面体立体对称球形颗粒,由1个裸露在外的病毒蛋白衣壳和内含的一条单股正链RNA 构成,引起的重症疾病包括无菌性脑膜炎、脑干脑炎、心肌炎和脊髓灰质炎[1-3]等。20 世纪上半叶,脊髓灰质炎病毒曾在全球范围内流行,直至疫苗的普及和应用,有效控制了疾病流行。WHO 提出了全球消除脊髓灰质炎的倡议和目标[4],使人类进入后脊髓灰质炎时代。自20 世纪90 年代以来,由EV71、CV-A16 等多种EV 引起的婴幼儿手足口病(hand-foot-mouth disease,HFMD)在亚太地区出现持续大范围暴发流行,呈现出流行强度高、范围广、重症和死亡人数多的特点[5],引起了人们高度关注。
2015 年12 月,在国家的重点支撑下,经过8 年的联合攻关,由我国自主研发的EV71 全病毒灭活疫苗获批上市。上市后我国HFMD 死亡病例持续降低,至2018 年我国HFMD 的死亡病例已较该疫苗上市前(2010—2015 年均值)下降了93%(http://www.nhc.gov.cn.),使我国成为全球唯一可以有效防控EV71所致HFMD 的国家。而由CV-A16、CV-A6 及CV-A10等其他EV[6]引起的HFMD 仍呈持续高流行态势,近年来由EV71 为核心的多价HFMD 疫苗的研发得到越来越多的重视[7]。相关领域的病原学、流行病学、动物模型、检测方法等相关研究均得到了快速发展。
假病毒由于可携带报告基因,且只能进行一个细胞周期的感染,具有生物安全性高、与真病毒特性相近、定量准确客观、研发速度快等优势,已被广泛应用于多种病毒的相关研究中。本文就假病毒在EV 中和抗体检测方法、抗病毒药物筛选、可视化动物模型建立等方面的研究进展作一综述。
1 假病毒的定义
假病毒是一种人工构建的不具有完整基因组的病毒样颗粒(virus-like particles,VLPs),与天然病毒相比,其表达包膜蛋白或衣壳蛋白的序列被删除或被修饰,通常由报告基因代替,使其保持了天然病毒可感染宿主细胞的特性,但又不能扩增、复制,无法产生具有感染性的子代病毒颗粒,因此不会污染环境,生物安全性高,不需要在BSL-3 及以上级别实验室进行操作[8]。同时假病毒还可通过携带特定报告基因,如荧光素酶等,利用化学发光,达到对病毒客观、准确定量的目的,也可通过活体成像、定位,直观反映病毒在动物体内的动态转归[9]。近年来已越来越多地应用于病毒进入宿主细胞过程和特异性受体、中和抗体表位、假病毒疫苗、中和抗体滴度检测方法、抗病毒药物筛选、病毒基因治疗、可视化动物模型建立等研究中[10]。另外,假病毒由于其整合衣壳蛋白的能力及较高的转染效率,具有宿主范围广泛、可抵抗血清补体的灭活等作用[10]。
2 假病毒的构建
病毒的构建是假病毒研究的关键环节。以人EV、乳头瘤病毒(human papilloma virus,HPV)为代表的非包膜病毒[11]通常使用多质粒共转染,或RNA与质粒共转染哺乳动物细胞构建假病毒[4]。多质粒共转染系统是将T7 RNA 聚合酶质粒、复制子质粒、衣壳子质粒共转染至敏感细胞,复制子在T7 RNA 聚合酶的作用下在细胞内转录。RNA 与质粒共转染系统是先将复制子质粒进行体外转录获得RNA,再与衣壳子质粒共转染至敏感细胞获得假病毒。而包膜病毒通常使用人类免疫缺陷病毒(human immunodeficiency virus,HIV)、水泡性口炎病毒(vesicular stomatitis virus,VSV)、鼠白血病病毒(murine leukemia virus,MLV)等商业化载体构建假病毒[12]。
3 EV 假病毒的构建
EV 基因组为1 条长约 7 500 nt 的单股正链RNA,包括5′UTR、1 个开放阅读框(open reading frame,ORF)和 3′Poly(A)尾。ORF 编码 1 个多聚前体蛋白,可进一步水解为 P1、P2、P3 3 个前体蛋白,P1 编码VP1、VP2、VP3、VP4 4 个衣壳蛋白,P2、P3 编码 2A、2B、2C、3A、3B、3C、3D 7 个非结构蛋白[14]。
假病毒主要由复制子质粒、衣壳子质粒两部分构成。其中,复制子质粒通常采用T7 启动子、EV 5′UTR、荧光素酶报告基因、2A 蛋白酶切割序列、EV非结构蛋白 P2 和 P3 序列及 3′Poly(A)尾构建;衣壳子质粒通常采用增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP)、2A 蛋白酶切割序列和 EV 衣壳蛋白P1 序列构建。通过多质粒共转染系统或RNA与质粒共转染系统获得假病毒[14]。近年肠道病毒假病毒的构建情况和应用现状见表1。

表1 已构建的EV 假病毒的应用现状Tab.1 Application of constructed pseudoviruses
衣壳蛋白是决定EV 特性的核心区域,因此衣壳子质粒需使用目的病毒的衣壳蛋白区基因序列构建,而复制子质粒或复制子RNA 通常可由与目的病毒同型或同组病毒的基因组(除衣壳蛋白外)所构建。除CV-B5 假病毒外,通常使用与衣壳子同组病毒的复制子(如均为EV-A 的EV71 复制子与CV-A16衣壳子)共转染可成功获得假病毒;但使用与衣壳子不同组病毒的复制子(如EV71 复制子与CV-B3 衣壳子、CV-B5 复制子与CV-A6 衣壳子)均无法成功获得有效的假病毒,可能是由于同一种类的病毒包装机制有共同点或相似点,但不同种病毒的包装机制均不相同[29]。见表2。CHEN 等[14]采用多质粒共转染系统与RNA 及质粒共转染系统均无法获得以CVB5 基因组为复制子的CV-B5 假病毒,最终使用CVB3 复制子构建假病毒,可能是由于CV-B5 的基因结构本身不太稳定,而采用报告基因替换P1 序列的假病毒构建方式加重了该结构的不稳定性。

表2 EV 假病毒的构建Tab.2 Construction of pseudoviruses
4 假病毒在EV 相关研究中的应用
4.1 中和抗体检测 中和抗体是评价疫苗有效性、人体保护效果等方面的关键指标。因此,经验证的中和抗体方法对疫苗生产的质控和评价十分重要。传统中和抗体检测(conventional neutralization test,cNT)通常采用细胞病变(cytopathic effect,CPE)法或蚀斑减少法进行,即通过中和抗体可特异性抑制目的病毒对细胞的致病变能力,反映抗体对病毒的中和能力,但由于cNT 需要人为观察CPE 来判定结果,具有主观性强、精确度低、耗时长、操作繁琐[14]及实验室安全级别要求高等问题。为缩短检测周期,近年来,改良的酶联免疫吸附斑点试验(enzyme-linked immunosorbent spot assay)采用包被的HRP 标记单克隆抗体,可捕获病毒感染后细胞分泌的蛋白,通过酶联斑点显色的方式反映中和抗体对病毒感染细胞的能力,检测周期短(14 h)[30]、特异性高[31],但仍需使用活病毒,且灵敏度低、线性差[27]。而基于假病毒的中和试验(pseudovirus-based neutralization test,pNT)仅需将一定拷贝数的假病毒与血清样本于37 ℃,5%CO2条件下中和数小时,随后加入病毒的敏感细胞,孵育10 ~16 h,经清洗、裂解细胞内假病毒后,加入报告基因底物,经化学发光仪检测即可准确得到假病毒含量。结果以相对光单位(relative light unit,RLU)表示,通过标准曲线的线性方程即可得到中和抗体效价,从而避免了人为观察的主观性,具有客观、准确、快速、安全性高的优势。
临床样本考核是评价检测方法的有效手段。部分 EV pNT 的临床样本考核结果[14-15,21-23]见表 3,可见 EV71、CV-A6、CV-A10、CV-B5 4 种 pNT 试验的敏感性均 > 90%,敏感性较高;EV71、CV-A6、CV-A10的特异性较好,而CV-B5 的特异性较低,导致其假阳性率偏高;pNT 试验的阳性预测值均 >95%;EV71、CV-A6、CV-A10 的阴性预测值较高,CV-B5 较低;EV71、CV-A6、CV-A10 的约登指数较高,CV-B5相对较低。
相关性分析是反映新建检测方法的另一关键指标。作为目前公认的金标准,pNT 常以cNT 为依据,通过统计学手段进行相关性与一致性分析。已建立的 EV71、CV-A6、CV-A10、CV-A16、CV-B3 5 种 pNT均表现出了与cNT 良好的相关性(P 均<0.000 1)和较高的一致性[4,14-15,21,23-24,26],见表 4。PV pNT 的相关性较高(P 均<0.01),其一致性分析采用口服脊髓灰质炎疫苗(oral poliomyelitis vaccine,OPV)、野毒株脊髓灰质炎灭活疫苗(inactivated poliovirus vaccine from salk strain,wIPV)、Sabin 株脊髓灰质炎灭活疫苗(inactivated poliovirus vaccine from sabin strain,sIPV)的免疫血清进行评价,结果表明,pNT 与cNT 的检测结果相近,均具有较高一致性。研究还使用PV-2 和PV-SabinⅡ的pNT 与cNT 检测不同疫苗免疫血清中和滴度,结果表明,当采用同一型检测毒株,两种方法具有较高的一致性[27]。提示已建立的EV pNT结果准确,可作为cNT 的替代方法用于临床样本的检测和评价[14]。

表3 EV pNT 的临床样本考核评价Tab.3 Evaluation of EV pNT in clinical samples
4.2 可视化动物模型 动物模型是疾病研究及相关疫苗、药物研发和评价的另一关键工具。由于多数EV 可对新生实验动物具有一定致病能力,但对成年实验动物不敏感,因此多数EV 动物模型只能采用新生动物模型建立,如EV71、CV-A16 等乳鼠模型。但由于新生动物免疫系统发育不完全,在疫苗保护效果等研究中只能通过免疫母体,通过母传抗体保护新生动物的能力间接进行保护效果评价。而假病毒由于可带有发光报告基因,同时又具有活病毒相应的感染能力和特性,可用于建立直观、且可动态观察的可视化动物感染模型建立,并可通过活体成像技术检测报告基因的RLU 值,定量反映病毒在动物体内特定部位的相对含量。同时,由于不需要观察动物发病或死亡情况,从而避免了只能采用乳鼠间接评价保护效果的局限性,通过活体成像技术直接检测成年小鼠的感染情况,直接反映疫苗对病毒感染的保护效果。
ZHOU 等[19]采用导入 hSCARB2 基因的 C57BL /6小鼠建立了EV71 报告基因假病毒的可视化感染模型,通过将灭活病毒疫苗注射至动物体内,随后采用一定剂量假病毒对实验动物进行攻击,评价疫苗主动免疫的保护效果,结果显示,灭活病毒疫苗的平均保护率为88%。以BALB/c 小鼠建立的CV-B5 假病毒可视化感染模型[9]与CV-A6 假病毒可视化感染模型[22]也已成功构建,并证实了灭活病毒疫苗的免疫保护效果,为CV-A6、CV-B5 疫苗研发提供了有效的研究工具。
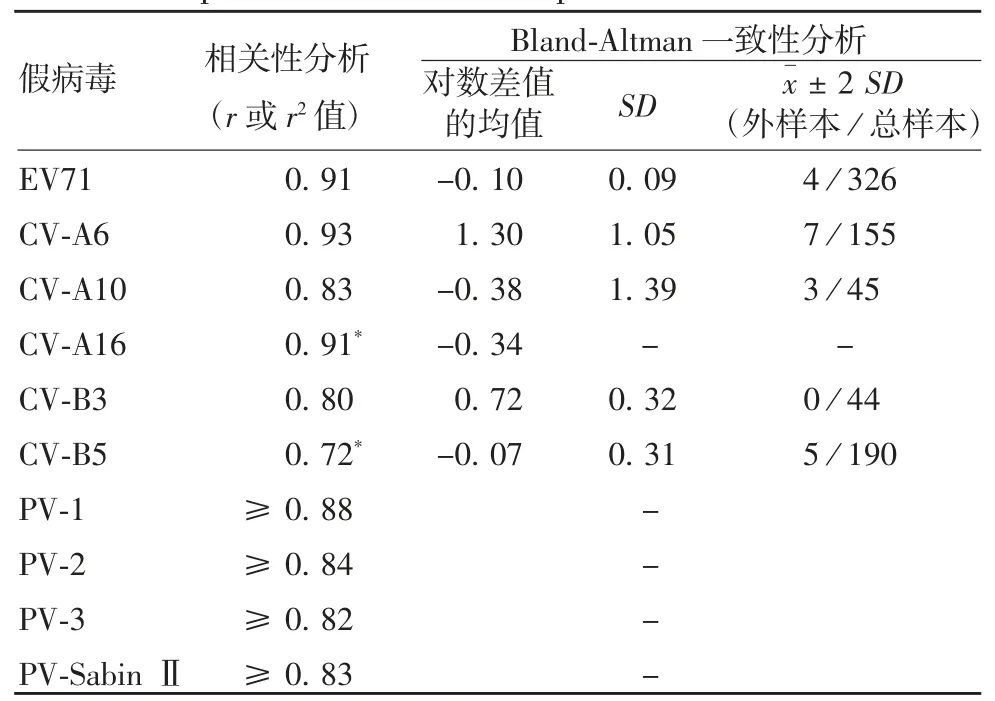
表 4 EV cNT 与pNT 的比较分析Tab.4 Comparison of EV cNT and pNT
4.3 抗病毒药物筛选 与中和抗体检测的方法相近,传统的抗病毒药物筛选也往往以活细胞为载体,即通过观察病毒在活细胞上引起的CPE 评价药物的抗病毒作用[32]。除具有与cNT 方法相同的缺点和问题外,还难以区分因药物本身可能对细胞存在毒性的问题。包含报告基因的假病毒可有效避免以上问题,实现快速、高通量地检测病毒感染情况,从而准确反映药物对病毒的抑制能力。但由于假病毒的报告基因在病毒粒子包装之前已经表达,对作用于病毒转录后的药物难以进行评价,使假病毒在抗病毒药物筛选中的应用存在一定局限性[32]。
SU 等[21]使用 EV71 和 CV-A16 的假病毒及感染性克隆建立了药物筛选方法,并应用该方法对400 种天然化合物库进行抗EV71 和CV-A16 药物的初筛,发现了44 种化合物可抑制报告基因的表达,经活细胞法复筛确认,证明木犀草素、高良姜素和榭皮素3 种化合物可有效抑制EV71 和CV-A16 对活细胞的感染。
5 小结及展望
目前已建立了 EV71、CV-A6,10,16、CV-B3,5、PV-1 ~ 3,SabinⅡ等 7 种 EV 的 pNT 法及 EV71、CV-A6、CV-B5 可视化动物模型,EV71 和 CV-A16 假病毒已在药物筛选中初步应用,显示了良好的应用效果和前景,但仍存在检测病原单一、方法标准化、替代野毒株cNT 法的验证等问题。应充分利用可人工构建的优势,进一步开展高通量多通道pNT 方法研究,加强pNT 与cNT 法的比较,完善方法验证和转换的依据,为EV 的疫苗评价和药物筛选提供工具。
