b 型流感嗜血杆菌精制多糖分子大小分布及重均分子质量检测方法的改良
2021-01-19李向群韩菲尹珊珊邓海清刘建凯袁波
李向群 ,韩菲 ,尹珊珊 ,邓海清 ,刘建凯 ,袁波
1.沈阳药科大学,辽宁沈阳110016;2.北京民海生物科技有限公司,北京102600
b 型流感嗜血杆菌(Haemophilus influenza type b,Hib)为革兰阴性荚膜型致病菌。在 6 种(a、b、c、d、e、f)荚膜型流感嗜血杆菌中致病力最强,可引起5 岁以下幼儿脑膜炎、肺炎及其他侵袭性疾病如败血症、会厌炎、心包炎等[1]。目前最有效的防范措施是注射Hib 结合疫苗。该疫苗是将Hib 精制多糖与载体蛋白共价结合得到T 细胞依赖抗原,激发婴幼儿(≤2 岁儿童)、老人及免疫缺陷患者体内的免疫应答,产生免疫记忆,诱生免疫球蛋白IgG,较单纯多糖疫苗诱生的IgM 更有效,且能维持较长时间,具有良好的保护力[2]。
Hib 精制多糖是Hib 结合疫苗的中间产品,分子大小是评价其质量的重要指标,《中国药典》三部(2020 版)通则3419 采用体积排阻法(size exclusion chromatography,SEC)测定Hib 精制多糖分子大小及分配系数(KD)值对应保留体积的回收率(RX),该方法根据多糖分子在多孔性凝胶色谱柱中从大到小分离的原理,利用凝胶色谱柱的分子筛机制,采用AKTA 层析系统分离供试品,再用检测器对分离出的物质进行检测,得到供试品在层析柱中的KD及相对分子质量分布情况。《中国药典》三部(2020 版)规定Hib 精制多糖采用琼脂糖CL-4B 凝胶柱检测,KD≤ 0.5 的多糖 RX应大于 50%[3]。
Hib 精制多糖属天然水溶性高分子化合物,以微生物为原料通过物理化学方法提取获得[4]。分子质量及分子质量分布是表征高分子物质的最基本参数之一,也是高分子性能研究和生产过程中需控制的重要参数。通常可用4 种分子质量表示方式表征高分子分子质量大小:数均分子质量(Mn)、重均分子质量(MW)、Z 均分子质量(M)z及黏均分子质量(Mη)。一般来说,分子质量不均一的高分子分子质量Mz>MW> Mη> Mn[5]。
本研究采用HPLC 法将体积排阻色谱(SEC)与18 角度静态激光散射系统MALLS 联用,通过激光照射样品产生的散射光来描述供试品的分子特性并得到供试品准确的MW[6],无需借助任何标准品或预设的标准曲线进行计算,且对供试品进行更准确、客观的表征。该技术已被越来越广泛地应用于细菌性多糖相对分子质量的测定,同时根据示差图谱可对样品的相对分子大小及回收率情况进行分析[7-8]。本方法中激光检测器对大分子物质敏感,容易产生响应信号,而示差折光信号对样品浓度敏感,这两种检测器可同时反应样品中各相对分子质量组分的差异[9]。传统SEC 法测定Hib精制多糖相对分子质量是利用AKTA 层析系统,测试周期较长,一般需10 ~12 h,且仅能进行定性分析;而采用HPLC-MALLS 系统联用方法测试,用时较短,一般1 h 内完成,操作简单、检测效率高。
本研究采用HPLC-MALLS 系统测定Hib 精制多糖供试品的KD及RX,旨在与AKTA 层析系统测试结果进行对接,同时实现精制多糖MW的准确检测。
1 材料与方法
1.1 供试品 9 批Hib 精制多糖(批号分别为1909-106、1909107、1911108、1911109、1911111、1912112 ~1912115)由北京民海生物科技有限公司制备及保存,各项质量指标均符合《中国药典》三部(2020版)要求。
1.2 主要试剂及仪器 维生素B12、牛血清白蛋白(BSA)及DNA(鲑鱼睾丸脱氧核糖核酸钠盐)均购自美国Sigma 公司;蓝色葡聚糖2000、AKTA pure150M层析系统、CL-4B Sepharose 琼脂糖凝胶色谱柱(1.6 cm × 100 cm)、色谱柱管(16 / 100)购自美国GE 公司;AKTA 层析系统联用的RID-20A 型示差仪及CL-20A 型HPLC 系统购自日本岛津公司;DAWN HELEOS Ⅱ型18 角度静态光散射分析系统MALLS /R(I包括光散射仪和配套示差仪)购自美国Wyyat 公司;TSK G5000PWxl 色谱柱及 TSK PWXL Guard 保护柱购自日本TOSOH 株式会社。
1.3 色谱条件
1.3.1 AKTA 层析系统 采用CL-4B Sepharose 琼脂糖凝胶色谱柱作为分离柱,0.15 mol / L 氯化钠溶液为流动相,将 2 mg / mL 葡聚糖 2000 和 1 mg / mL维生素B12 按5 ∶1 的比例混合,采集波长为206 和280 nm 双波长模式。流速为 0.3 mL / min,上样体积为1 mL。以葡聚糖2000 保留体积为空流体积,维生素B12 保留体积为柱床体积。
1.3.2 HPLC-MALLS 系统 采用TSK G5000 PWxl色谱柱作为分离柱,0.15 mol / L 氯化钠溶液为流动相,以0.1 mg / mL DNA 保留体积作为空流体积,1.5%氯化钠溶液保留体积为柱床体积,采集示差信号,流速为 0.5 mL / min,上样体积为 40 μL。
1.4 供试品处理及上样检测 取供试品适量,以流动相配制浓度为5 mg / mL Hib 精制多糖溶液,使用前经0.2 μm 膜过滤。AKTA 层析系统和HPLC-MALLS系统上样样品为同1 管供试品,浓度为5 mg / mL,同日进行平行测试,记录示差信号。
1.5 数据结果处理 HPLC-MALLS 系统以2 mg /mL BSA 作归一化分析,校准仪器,供试品检测结果采用ASTRA 7.3 软件进行归一化处理,采用Debye Plot模型拟合曲线获得MW。根据供试品检测示差图谱,按下式计算供试品的KD,利用系统自带软件计算KD值为 0.5 的 RX。
KD=(Ve - Vo)/(Vi - Vo)
式中Ve 为供试品保留体积;HPLC 系统中Vo为葡聚糖2000 出峰保留体积,Vi 为维生素B12 出峰保留体积;HPLC-MALLS 系统中Vo 为DNA 出峰保留体积,Vi 为氯化钠出峰保留体积。合格标准:KD≤0.5,RX≥ 50%。
1.6 AKTA 层析系统与HPLC-MALLS 系统相关性分析 实验数据采用Excel 2007 软件进行统计及分析,以AKTA 系统测得KD值为横坐标,HPLC-MALLS系统测得KD值为纵坐标拟合线性回归方程,计算相关系数r,以r >0.6 判定检测结果相关,即两种方法等效。
1.7 HPLC-MALLS 方法的验证
1.7.1 重复性 9 批供试品采用HPLC-MALLS 系统均上样 6 次,测定 MW、KD及 RX,并计算 RSD。接受标准:RSD ≤ 5%。
1.7.2 准确性 9 批供试品的上样量均为200 μg(理论值),采用HPLC-MALLS 系统上样6 次,计算Hib 精制多糖回收率(实测值占理论值的百分比)及RSD。接受标准:回收率≥70%。
1.7.3 定量限 检测同批次浓度为0.5 和1.0 mg/mL的 Hib 精制多糖,以信噪比(S / N)≥ 10 且不确定度<5%确定定量限。
2 结 果
2.1 Hib 精制多糖的KD及RX9 批供试品经HPLC系统检测,KD最大值为 0.37,RX最小值为 78%,经HPLC-MALLS 系统检测,KD最大值为 0.38,RX最小值为84%;两者检测结果均符合《中国药典》要求,见表1。

表1 9 批供试品的AKTA 层析系统及HPLC-MALLS 系统检测结果Tab.1 Determination results of nine batches of samples by AKTA chromatography system and HPLC-MALLS system
2.2 AKTA 层析系统与HPLC-MALLS 系统的相关性 KD值回归方程为:Y = 0.903 X + 0.051,r 为0.978,表明检测结果具有显著相关性,两种方法等效,见图1。
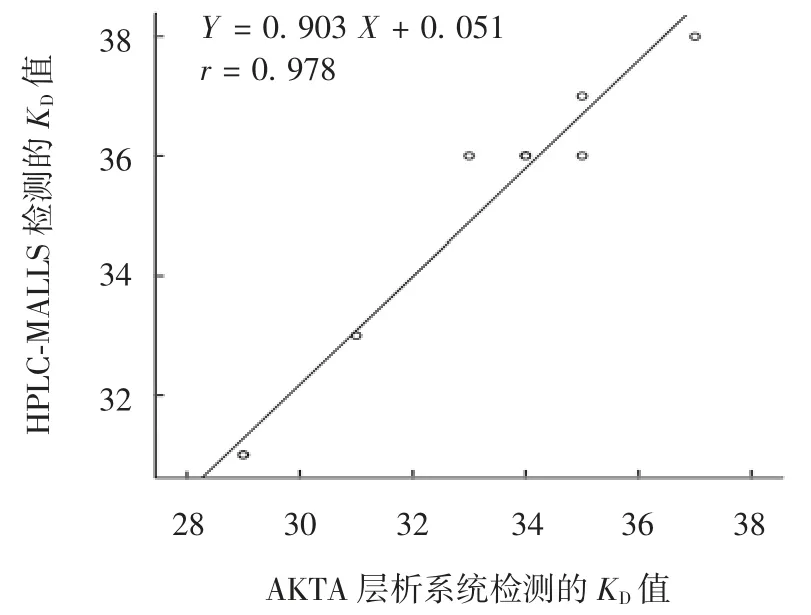
图1 两种方法检测的KD 值线性曲线Fig.1 Linear curve of KD values determined by two methods
2.3 HPLC-MALLS 方法的验证
2.3.1 重复性 结果显示,9 批供试品MW为(1.390 ~2.341)× 105g / moL,MW、KD及 RX平行间的 RSD均≤3.8%,见表2。表明方法重复性良好。
2.3.2 准确性 结果显示,9 批供试品检测6 次多糖回收率为 80% ~ 87%,RSD 为 0.05% ~ 3.43%,见表3。表明方法准确性良好。
2.3.3 定量限 0.5 及 1 mg / mL Hib 精制多糖的S / N 分别为 35 和 62;0.5 mg / mL Hib 精制多糖的不确定度 > 5%,不可信度较高,1 mg / mL Hib 精制多糖不确定度<5%,可信度较高。见表4。确定定量限为 1 mg / mL。
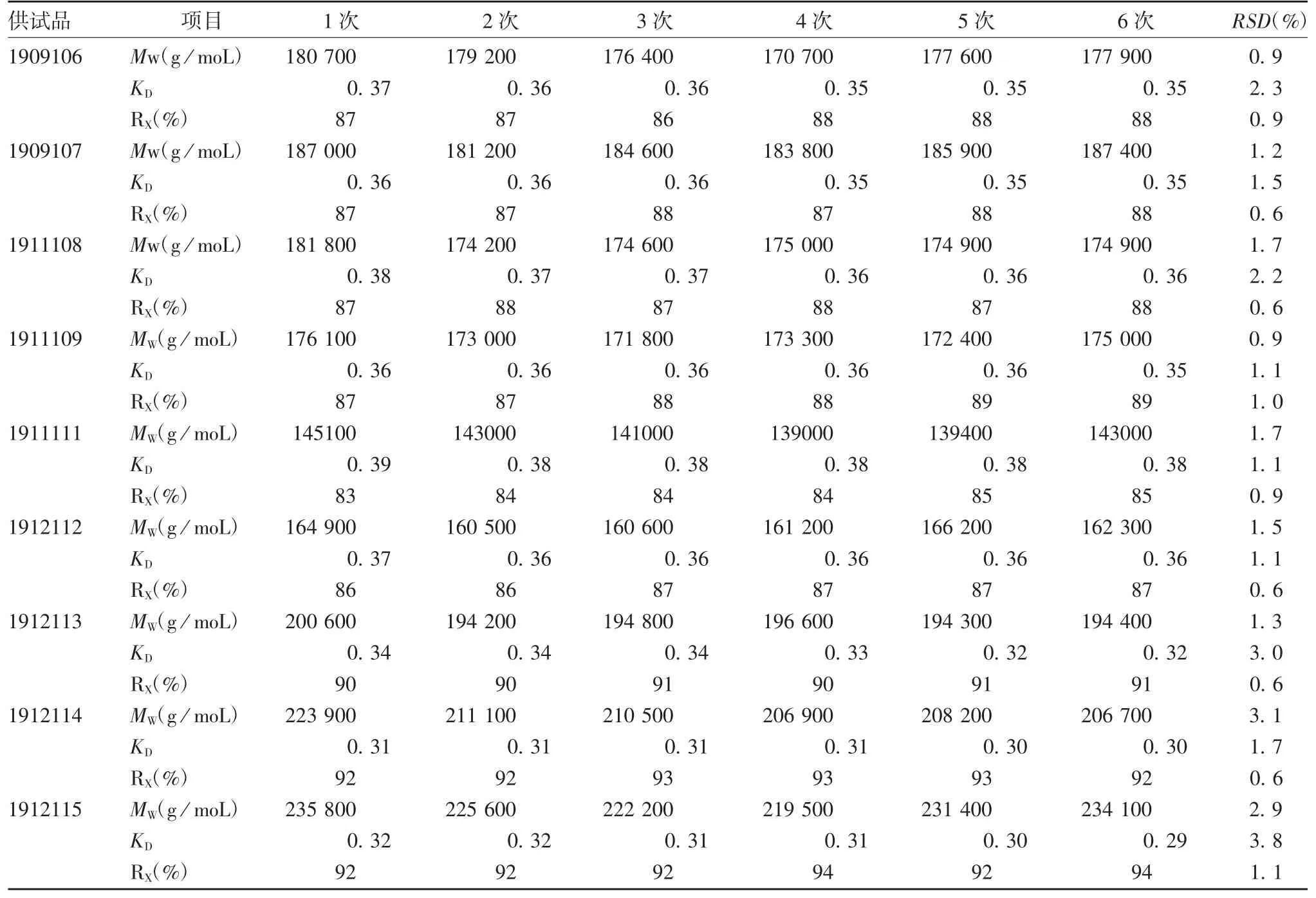
表 2 9 批供试品 HPLC-MALLS 系统检测6 次的 KD 值、RX 及MWTab.2 KD,RX and MW values of nine batches of samples in six tests by HPLC-MALLS system
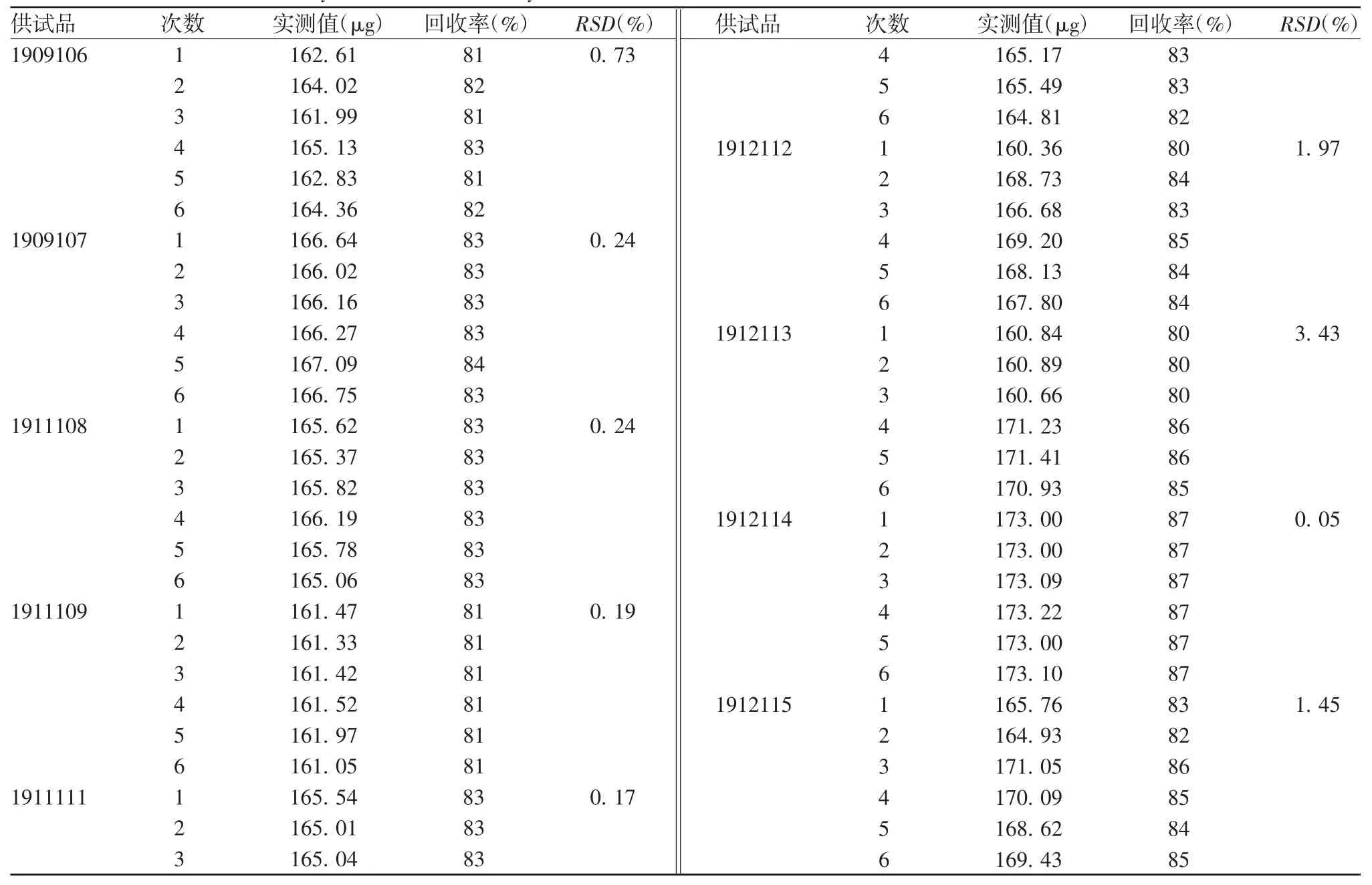
表3 HPLC-MALLS 系统准确性验证Tab.3 Verification for accuracy of HPLC-MALLS system

表4 不同浓度Hib 精制多糖测试结果Tab.4 Determination results of purified HIb polysaccharide at various concentrations
3 讨 论
HPLC-MALLS 是利用SEC 色谱分离系统将供试品中的组分按尺寸大小依次洗脱进入MALLS 系统进行分析,激光照射的样品会在各方向产生散射光,光散射强度与MW及溶液的浓度成正比,散射光角度变化与分子尺寸大小相关[10]。
AKTA 层析系统检测9 批供试品的KD为0.29 ~0.37,HPLC-MALLS 系统检测的 KD为 0.31 ~ 0.38,两系统KD值进行线性拟合得后,r 为0.978,表明两种方法测定Hib 精制多糖相对分子大小(KD值)时结果相关性显著,方法间具有等效性。
9 批次供试品经HPLC-MALLS 系统重复测试6次,MW、KD及 RX重复性结果的 RSD 均小于 5%,表明重复性良好。由于Hib 精制多糖的浓度较高,糖溶液体系较为黏稠,导致多糖回收率较低,最高值仅为87%,这可能是供试品与色谱柱的相互作用造成的。在后续验证工作中将进行深入研究。
SEC-MALLS 系统在实际测试高分子物质的MW时,会有多重因素影响结果的不确定度,如色谱柱类型、流动相组成、流速、柱温、样品处理、进样体积、折光指数增量(dn / dc)等。在同等条件下选取不同浓度供试品测试,选择更低的不确定度对应的数据作为表征供试品相对分子质量的结果。常采用S / N法确定供试品中定量限,一般以S / N ≥ 10 对应浓度确定[11]。本研究结果显示,Hib 精制多糖检测的S / N 达60 以上才能达到不确定度相对较低(即结果可信度高)的定量要求。因此,对于不同的制品可能需不同的S / N 确定其定量限。
综上所述,生物大分子的结构和构象能影响其生物学功能[11],Hib 精制多糖相对分子质量及分子大小测试结果能间接反应其结构,因此,检测方法的准确、可靠是疫苗产品质量的重要保证。HPLC-MALLS系统检测Hib 精制多糖与AKTA 层析系统相比更适用于测试Hib 精制多糖的MW、KD及RX,可作为Hib精制多糖分子大小分布检测的改良方法,通过数据不断积累和补充,下一步将进行更多方面的方法学研究及验证。
