长链非编码RNA-ATB对瘢痕疙瘩成纤维细胞增殖和凋亡的影响及其机制研究
2021-03-16高蜜阳张荣明熊亮申锦帆刘畅
高蜜阳,张荣明,熊亮,申锦帆,刘畅
(锦州医科大学附属第一医院 烧伤整形科,辽宁 锦州121000)
瘢痕疙瘩是由于伤口、创伤、烧伤、手术切口或疾病等导致瘢痕形成,主要与成纤维细胞的过度增殖和细胞外基质的大量沉积有关[1]。瘢痕疙瘩的临床表现主要是高出皮肤的瘢痕组织生长,通常伴有瘙痒和疼痛。有研究显示瘢痕疙瘩的形成与基因调控、炎症因子、细胞因子和免疫因素等密切相关[2]。由于瘢痕疙瘩的发病机制和调控机制尚不清楚,瘢痕疙瘩的治疗仍未取得突破性进展。长链非编码RNA(long non-coding RNA, lncRNA)是非编码RNA的亚类,其长度超过200 nt,且具有比编码RNA 更强的组织和细胞特异性。lncRNA 在不同的细胞、组织及其不同的发育阶段中表达均不同,并参与各种疾病的发生、发展,同时在细胞分化、增殖、迁移、凋亡和代谢等过程中起着重要的调节作用[3]。有研究显示大量lncRNAs 在瘢痕疙瘩中存在异常表达,其中lncRNA AC073257.2 能够调控GLI2基因,参与成纤维细胞的生长、增殖;lncRNA HNF1A-AS1 能够调控HNF1A基因,参与瘢痕疙瘩的形成[4]。有研究显示被转化生长因子b 激活的长链非编码RNA(lncRNA-ATB)在肿瘤、外周血管疾病、动脉粥样硬化、骨关节炎、免疫性等疾病中发挥着重要作用[5-7]。然而ATB 在瘢痕疙瘩中的作用及机制尚未完全阐明。因此本研究采用RT-PCR 检测瘢痕疙瘩和正常皮肤组织中ATB 的表达水平,并进一步深入探讨ATB 调控miR-200c/DNA 甲基转移酶DNMT3B 通路在瘢痕疙瘩成纤维细胞增殖和凋亡中的作用,证实ATB/miR-200c/DNMT3B 轴对瘢痕疙瘩形成的影响。
1 材料与方法
1.1 组织标本
选取2017年12月—2018年7月在锦州医科大学附属第一医院烧伤整形科接受瘢痕疙瘩治疗的30 例患者。其中,男性19 例,女性11 例;平均年龄(32.7±10.1)岁;在手术前均未接受药物治疗、放射治疗、化学治疗、激光治疗等。排除肿瘤、免疫性疾病及严重的肝肾功能不全患者。术中切除瘢痕疙瘩和少量周围正常皮肤组织,标本保存于液氮中用于进一步实验。同时分为瘢痕疙瘩组和正常皮肤组,以及瘢痕疙瘩成纤维细胞细胞组与正常成纤维细胞组。患者均签署知情同意书。
1.2 主要试剂
DMEM 细胞培养基和胎牛血清购自美国Gibco公司,CCK-8 试剂盒购自大连碧云天生物技术有限公司,磷酸盐缓冲液和胰蛋白酶购自上海思吉生物制品有限公司, RNA 逆转录试剂盒和Lipofectamine 2000 购自日本TaKaRa 公司,Trizol Reagent 和SYBR Green 购自美国Promega 公司,miRNeasy Mini Kit 购自德国Qiagen 公司,TaqMan MicroRNA Assay 试剂盒购自美国Applied Biosystems公司,兔抗人DNMT3B、周期素依赖性激酶6(CDK6)、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)和β-actin 抗体购自美国Abcam 公司,HRP 标记的羊抗兔IgG 购自美国CST 公司。sh-ATB、sh-DNMT3B、miR-NC、miR-200c mimics 和miR-200c inhibitors 由中国上海Genepharm 公司合成。通过PCR 扩增野生型(o/e-ATB) 或突变体(o/e-NC)ATB 片段,并亚克隆到pcDNA3.1 载体,pcDNA3.1载体购自美国Invitrogen 公司。
1.3 方法
1.3.1 细胞培养与转染人瘢痕疙瘩成纤维细胞购自中国科学院上海细胞库,采用含10%胎牛血清的DMEM 细胞培养基在37℃、5%二氧化碳平衡湿度培养箱中培养。取对数生长期细胞进行实验,采用Lipofectamine 2000 按试剂盒说明书转染sh-ATB、 o/e-ATB、 miR-200c mimics、 miR-200c inhibitors 和sh-DNMT3B,转染24 h 后用于进一步实验。同时根据不同转染方式分为:sh-NC 组、sh-ATB组、o/e-NC 组、o/e-ATB 组、miR-NC 组、miR-200c mimics 组、miR-200c inhibitors 组、共转染sh-ATB+miR-200c inhibitors 组、共转染o/e-ATB+miR-200c inhibitors 组、共转染miR-200c inhibitors+sh-DNMT3B 组、共转染miR-200c mimics+sh-DNMT3B 组。
1.3.2 qRT-PCR采用miRNeasy Mini Kit 提取miRNA,使用TaqMan MicroRNA Assay 试剂盒检测miR-200c 的相对表达量,并使用Applied Biosystem 7500 进行qRT-PCR,U6 作为内参。采用Trizol 提取组织和细胞中总RNA,使用NanoDrop 1000 分光光度计测定RNA 的浓度,使用PrimeScriptTMqRT-PCR试剂盒从总RNA 合成第一链互补DNA,并使用SYBR Green PCR Master Mix 进行qRT-PCR,以βactin 作为内参,按2-ΔΔCt法进行相对表达量分析。
1.3.3 细胞增殖转染后24 h 收集各组细胞,以2×104个密度接种到96 孔培养板中,各组细胞分别培养0 d、1 d、2 d 和3 d 后,加入10 μl 的CCK-8 溶液,在37℃下再孵育2 h,使用酶标仪测量450 nm处的吸光度值。
1.3.4 细胞凋亡转染后24 h 收集各组细胞,以2×105个密度接种到6 孔培养板中,以2×104个密度接种到96 孔培养板中,加入10 μl Annexin VFITC 和5μl 碘化丙啶染色液(0.25 mg/ml),轻轻混匀,室温避光孵育20 min,用流式细胞仪进行检测。
1.3.5 双荧光素酶将野生型ATB(ATB-WT)、突变型ATB(ATB-MUT)、野生型DNMT3B(DNMT3B-WT)或突变型DNMT3B (DNMT3B-MUT)克隆到pmirGLO 质粒受体中,同时将miR-200c mimics 或miR-NC 导入293 细胞中,共培养48 h 后采用双荧光素酶受体分析系统测量双荧光素活性。
1.3.6 Western blotting转染后24 h 收集各组细胞,常规提取细胞总蛋白,BCA 试剂盒测定蛋白浓度,使用10% SDS-PAGE 凝胶分离等量(50 μg)蛋白质样品,110 V 电泳,250 mA 电转至PVDF 膜,5% 脱脂奶粉37℃封闭2 h。分别加入DNMT3B、CDK6、Caspase-3 和β-actin 一抗4℃孵育过夜,TBST 洗膜3 次,10 min/次,二抗37℃孵育1 h,TBST洗膜3次,30 min/次,ECL显影。并使用Image J软件分析蛋白条带灰度值,以β-actin 作为内参,计算相对表达量。
1.4 统计学方法
数据分析采用SPSS 17.0 统计软件,计量资料以均数±标准差(x±s)表示,比较用配对t检验、独立样本t检验或重复测量设计的方差分析,进一步的两两比较用Dunnett-t检验,相关性分析用Spearman 法,P<0.05 为差异有统计学意义。
2 结果
2.1 ATB 在瘢痕疙瘩组织和瘢痕疙瘩成纤维细胞中的表达
瘢痕疙瘩组与正常皮肤组ATB 相对表达量分别为(2.96±1.07)和(1.11±0.49),经t检验,差异有统计学意义(t=8.561,P=0.000),瘢痕疙瘩组较正常皮肤组高。瘢痕疙瘩成纤维细胞细胞组与正常成纤维细胞组ATB 相对表达量分别为(2.37±0.26)和(1.07±0.12),经t检验,差异有统计学意义(t=7.814,P=0.001),瘢痕疙瘩成纤维细胞细胞组较正常成纤维细胞组高。sh-NC 组与sh-ATB 组ATB 的相对表达量分别为(0.44±0.10)和(1.01±0.15),经t检验,差异有统计学意义(t=5.476,P=0.005),sh-ATB 组 较sh-NC 组 高。o/e-NC 组与o/e-ATB 组ATB 的相对表达量分别为(1.01±0.06)和(1.97±0.21),经t检验,差异有统计学意义(t=7.686,P=0.002),o/e-ATB 组较o/e-NC 组高。
2.2 低表达ATB对成纤维细胞细胞增殖和凋亡的影响
sh-ATB 组与sh-NC 组转染后不同时间点的成纤维细胞OD450 值比较,经重复测量设计的方差分析,结果:①不同时间点间的OD450 值比较有差异(F=180.102,P=0.000);②sh-ATB 组与sh-NC 组的OD450 值比较有差异(F=61.130,P=0.000),sh-ATB 组较sh-NC组低;③sh-ATB组与sh-NC组的OD450 值变化趋势比较有差异(F=10.612,P=0.000)。同时sh-NC 组与sh-ATB 组CDK6 的相对表达量分别为(0.96±0.12)和(0.57±0.08),经t检验,差异有统计学意义(t=4.678,P=0.010),sh-ATB 组较sh-NC 组低(见图1)。进一步检测细胞凋亡情况,sh-NC 组与sh-ATB 组细胞的凋亡率分别为(6.97±1.43)%和(14.00±1.37)%,经t检验,差异有统计学意义(t=6.142,P=0.004),sh-ATB组较sh-NC 组高(见图2)。sh-NC 组与sh-ATB 组Caspase-3 的相对表达量分别为(0.99±0.12) 和(1.74±0.10),经t检验,差异有统计学意义(t=5.839,P=0.004),sh-ATB组较sh-NC组高(见图3)。见表1。
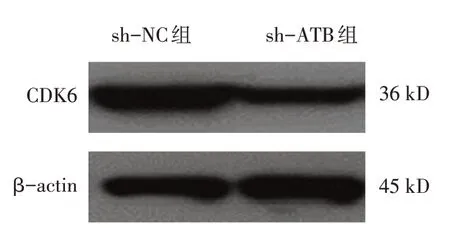
图1 sh-NC组与sh-ATB组CDK6相对表达量比较
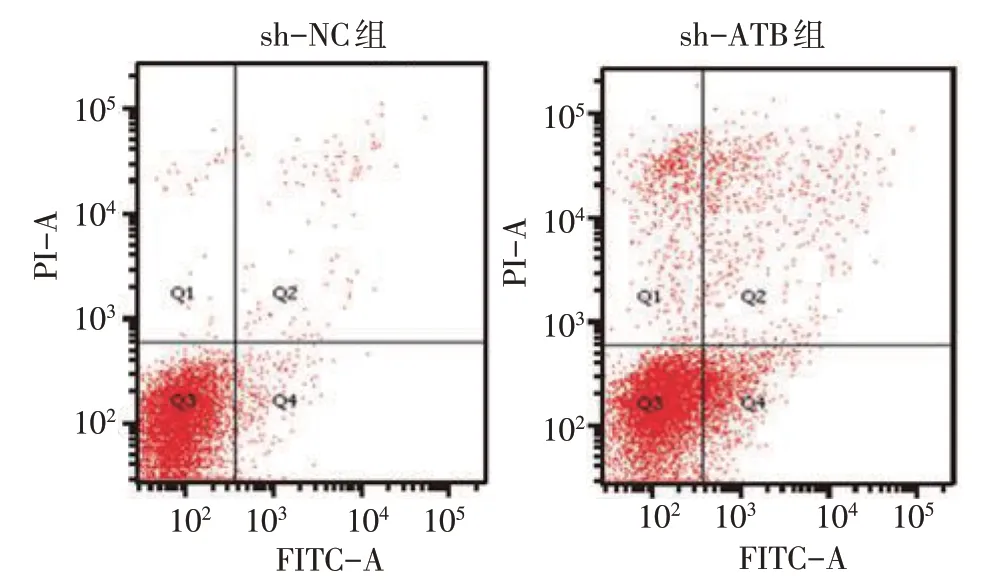
图2 低表达ATB对成纤维细胞凋亡的影响
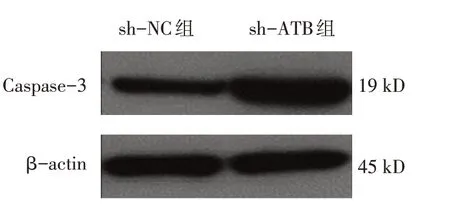
图3 低表达ATB对凋亡相关分子Caspase-3表达的影响

表1 sh-ATB组与sh-NC组转染后不同时间点的成纤维细胞OD450值比较 (x±s)
2.3 ATB靶向结合miR-200c
miR-NC 组ATB-WT 和ATB-MUT 双荧光素酶活性分别为(1.15±0.08) 和(1.07±0.09),miR-200c mimics 组分别为(0.47±0.04) 和(1.10±0.04)。两组ATB-WT 双荧光素酶活性比较,差异有统计学意义(t=13.083,P=0.000),两组ATB-MUT双荧光素酶活性比较,差异无统计学意义(t=0.469,P=0.664)。o/e-ATB 组miR-200c 相对表达量为(0.45±0.06),o/e-NC 组为(1.02±0.12),经t检验,差异有统计学意义(t=7.190,P=0.002),o/e-ATB 组低于o/e-NC 组。sh-NC 组与sh-ATB 组miR-200c 相对表达量分别为(0.97±0.12) 和(1.47±0.12),经t检验,差异有统计学意义(t=4.977,P=0.008),sh-ATB 组高于sh-NC 组。瘢痕疙瘩组与正常皮肤组miR-200c 相对表达量分别为(0.66±0.20)和(1.17±0.39),经t检验,差异有统计学意义(t=6.461,P=0.000),瘢痕疙瘩组低于正常皮肤组。经Spearman 相关分析,ATB 与miR-200c 在瘢痕疙瘩组织中的表达水平呈负相关(rs=-3.429,P=0.000)(见图4)。miR-NC 组miR-200c 相对表达量为(1.01±0.13),miR-200c mimics 组相对表达 量为(1.54±0.10), miR-200c inhibitors 组为(0.45±0.08),经方差分析,差异有统计学意义(F=76.010,P=0.000),成纤维细胞细胞转染miR-200c mimics 后能够促进miR-200c 的表达,转染miR-200c inhibitors 后能够抑制miR-200c 的表达。
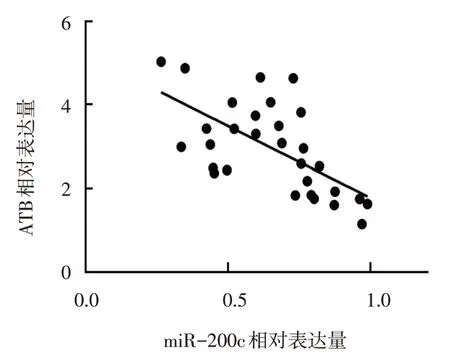
图4 ATB与miR-200c在瘢痕疙瘩组织中表达的相关性
2.4 过表达miR-200c 对成纤维细胞细胞增殖和凋亡的影响
miR-200c mimics 组和miR-NC 组转染后不同时间点的成纤维细胞OD450 值比较,经重复测量设计的方差分析显示:①不同时间点间的OD450 值比较有差异(F=331.764,P=0.000);②两组的OD450值比较有差异(F=155.169,P=0.000),miR-200c mimics 组较miR-NC 组低;③两组的OD450 值变化趋势比较有差异(F=17.397,P=0.000)。miR-NC组与miR-200c mimics 组CDK6 的相对表达量分别为(1.00±0.16)和(0.45±0.07),经t检验,差异有统计学意义(t=5.529,P=0.005),miR-200c mimics组较miR-NC 组低(见图5)。miR-NC 组与miR-200c mimics 组细胞凋亡率分别为(7.40±0.28)%和(16.53±1.14)%,经t检验,差异有统计学意义(t=9.252,P=0.001)(见图6),miR-200c mimics 组较miR-NC 组高。miR-NC 组 与miR-200c mimics 组Caspase-3 的相对表达量分别为(1.02±0.22) 和(1.63±0.09),经t检验,差异有统计学意义(t=4.467,P=0.011)(见图7),miR-200c mimics 组较miR-NC 组高。见表2。

图5 过表达miR-200c对增殖相关分子CDK6表达的影响
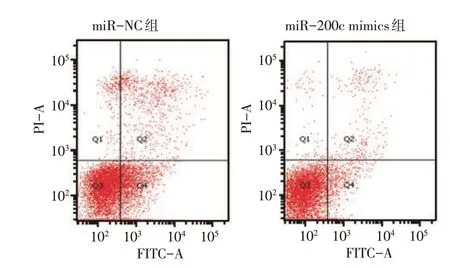
图6 过表达miR-200c对成纤维细胞凋亡的影响

图7 过表达miR-200c对凋亡相关分子Caspase-3表达的影响
表2 miR-200c mimics组和miR-NC组转染后不同时间点的成纤维细胞OD450值比较 (±s)
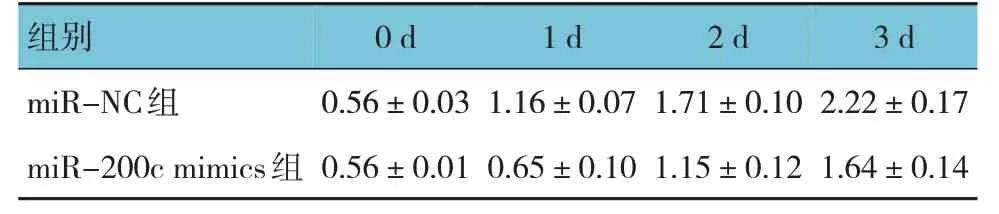
表2 miR-200c mimics组和miR-NC组转染后不同时间点的成纤维细胞OD450值比较 (±s)
组别0 d 1 d 2 d 3 d miR-NC组miR-200c mimics组0.56±0.03 0.56±0.01 1.16±0.07 0.65±0.10 1.71±0.10 1.15±0.12 2.22±0.17 1.64±0.14
2.5 miR-200c能够靶向结合DNMT3B
miR-200c mimics 组DNMT3B-WT 和DNMT3BMUT 荧光素酶活性分别为(0.58±0.04) 和(0.97±0.08),miR-NC 组分别为(0.98±0.07) 和(1.04±0.07)。两组DNMT3B-WT 荧光素酶活性比较,差异有统计学意义(t=8.094,P=0.001),转染miR-200c mimics 后双荧光素活性下降。两组DNMT3B-MUT 荧光素酶活性比较,差异无统计学意义(t=1.090,P=0.337)。miR-NC 组与miR-200c mimics 组DNMT3B 蛋白相对表达量分别为(1.02±0.05)和(0.51±0.04),经t检验,差异有统计学意义(t=13.796,P=0.000),miR-200c mimics 组较miR-NC 组低(见图8)。miR-NC 组 与miR-200c inhibitors 组DNMT3B 蛋白相对表达量分别为(1.04±0.07)和(1.47±0.11),经t检验,差异有统计学意义(t=5.712,P=0.005),miR-200c inhibitors 组 较miRNC 组高。瘢痕疙瘩组与正常皮肤组DNMT3B 相对表达量分别为(2.28±0.70)和(1.03±0.30),经t检验,差异有统计学意义(t=9.025,P=0.000),瘢痕疙瘩组较正常皮肤组高。经Spearman 分析,miR-200c与DNMT3B 在瘢痕疙瘩组织中的表达水平呈负相关(rs=-2.011,P=0.001)(见图9),ATB 与DNMT3B 在瘢痕疙瘩组织中的表达水平呈正相关(rs=0.829,P=0.002)(见图10)。
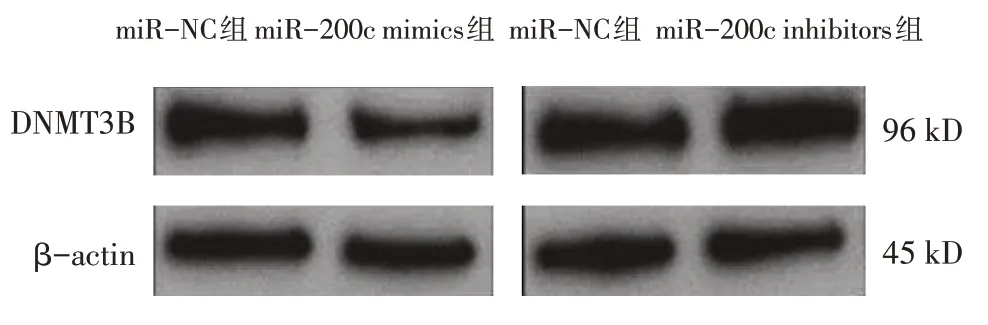
图8 瘢痕疙瘩成纤维细胞转染染miR-NC、miR-200c mimics和miR-200c inhibitors后DNMT3B的表达水平
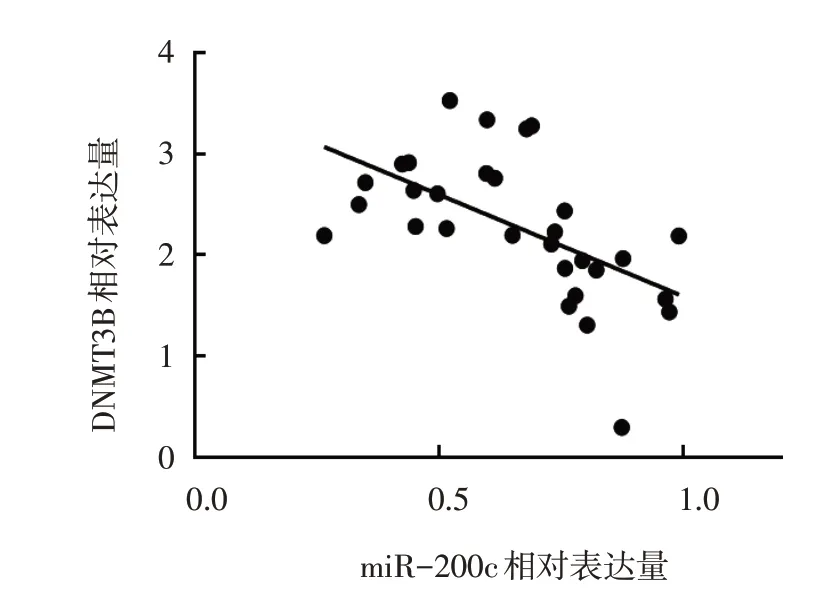
图9 miR-200c与DNMT3B在瘢痕疙瘩组织中表达的相关性
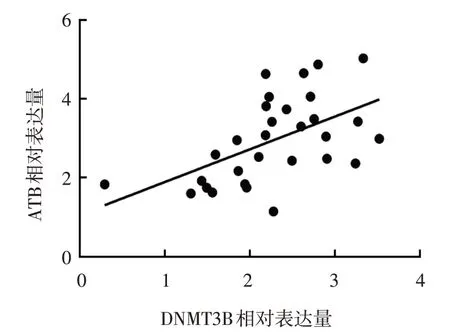
图10 ATB与DNMT3B在瘢痕疙瘩组织中表达的相关性
2.6 ATB 调控miR-200c/DNMT3B 通路参与成纤维细胞细胞的增殖和凋亡
共转染sh-ATB+miR-200c inhibitors 组与sh-NC组转染后不同时间点的成纤维细胞OD450 值比较,经重复测量设计的方差分析,结果:①不同时间点间的OD450 值比较有差异(F=192.560,P=0.000);②两组OD450 值比较无差异(F=4.339,P=0.054);③两组OD450 值变化趋势比较无差异(F=1.024,P=0.409)。共转染sh-ATB+miR-200c inhibitors 组与sh-ATB 组成纤维细胞OD450 值比较,经重复测量设计的方差分析,结果:①不同时间点间的OD450 值比较有差异(F=138.352,P=0.000);②两组OD450值比较有差异(F=27.567,P=0.000);③两组OD450 值变化趋势比较有差异(F=4.235,P=0.022)。sh-NC 组与共转染sh-ATB+miR-200c inhibitors 组细胞凋亡率分别为(6.97±1.43)%和(7.60±1.35)%,经t检验,差异无统计学意义(t=0.559,P=0.606)。见表3。
共转染o/e-ATB+miR-200c inhibitors 组与o/e-ATB 组转染后不同时间点的成纤维细胞OD450 值比较,经重复测量设计的方差分析,结果:①不同时间点间的OD450 值比较有差异(F=271.965,P=0.000);②两组OD450 值比较有差异(F=42.868,P=0.000);③两组OD450 值变化趋势比较有差异(F=7.459,P=0.002)。共转染o/e-ATB 和miR-200c inhibitors 组和o/e-ATB 组细胞凋亡率分别为(2.37±0.85)%和(4.35±0.60)%,经t检验,差异有统计学意义(t=3.302,P=0.030),o/e-ATB 组较共转染o/e-ATB+miR-200c inhibitors组高。见表4。
共转染miR-200c inhibitors+sh-DNMT3B 组与miR-NC 组转染后不同时间点的成纤维细胞OD450值比较,经重复测量设计的方差分析,结果:①不同时间点间的OD450 值比较有差异(F=177.080,P=0.000);②两组OD450 值比较无差异(F=0.002,P=0.964);③两组OD450 值变化趋势比较无差异(F=2.661,P=0.083)。共转染miR-200c inhibitors+sh-DNMT3B 组与miR-200c inhibitors 组成纤维细胞OD450 值比较,经重复测量设计的方差分析,结果:①不同时间点间的OD450 值比较有差异(F=171.475,P=0.000);②两组OD450 值比较有差异(F=45.448,P=0.000);③两组OD450 值变化趋势比较有差异(F=6.883,P=0.003)。miR-NC 组与共转染miR-200c inhibitors+sh-DNMT3B 组细胞凋亡率分别为(7.40±1.28)%和(6.63±0.91)%,经t检验,差异无统计学意义(t=0.848,P=0.444)。见表5。
共转染miR-200c mimics+sh-DNMT3B 组与miR-200c mimics 组转染后不同时间点的成纤维细胞OD450 值比较,经重复测量设计的方差分析,结果:①不同时间点间的OD450 值比较有差异(F=83.287,P=0.000);②两组OD450 值比较有差异(F=14.702,P=0.002);③两组OD450 值变化趋势比较有差异(F=5.401,P=0.009)。共转染miR-200c mimics+sh-DNMT3B 组 与miR-200c mimics 组 细胞 凋 亡 率分别为(21.17±1.41)% 和(16.53±1.14)%,经t检验,差异有统计学意义(t=4.440,P=0.011),共转染miR-200c mimics+sh-DNMT3B 组较miR-200c mimics 组高。这提示ATB 能够通过调控miR-200c/DNMT3B 通路参与成纤维细胞的增殖和凋亡。见表6。
表3 共转染sh-ATB和miR-200c inhibitors对成纤维细胞细胞增殖的影响 (±s)
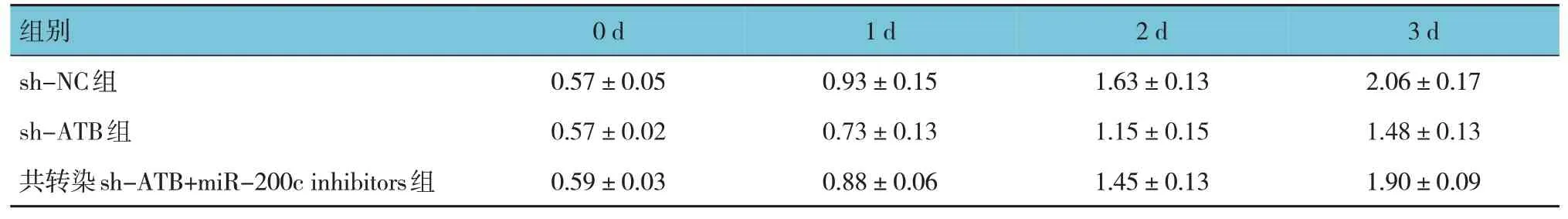
表3 共转染sh-ATB和miR-200c inhibitors对成纤维细胞细胞增殖的影响 (±s)
组别0 d 1 d 2 d 3 d sh-NC组sh-ATB组共转染sh-ATB+miR-200c inhibitors组0.57±0.05 0.57±0.02 0.59±0.03 0.93±0.15 0.73±0.13 0.88±0.06 1.63±0.13 1.15±0.15 1.45±0.13 2.06±0.17 1.48±0.13 1.90±0.09
表4 共转染o/e-ATB和miR-200c inhibitors对成纤维细胞细胞增殖的影响 (±s)

表4 共转染o/e-ATB和miR-200c inhibitors对成纤维细胞细胞增殖的影响 (±s)
组别0 d 1 d 2 d 3 d o/e-NC组o/e-ATB组共转染o/e-ATB+miR-200c inhibitors组0.58±0.04 0.56±0.03 0.57±0.03 0.98±0.18 1.29±0.19 1.65±0.16 1.58±0.10 2.06±0.17 2.45±0.16 1.97±0.10 2.44±0.17 3.25±0.16
表5 共转染miR-200c inhibitors和sh-DNMT3B对成纤维细胞细胞增殖的影响 (±s)
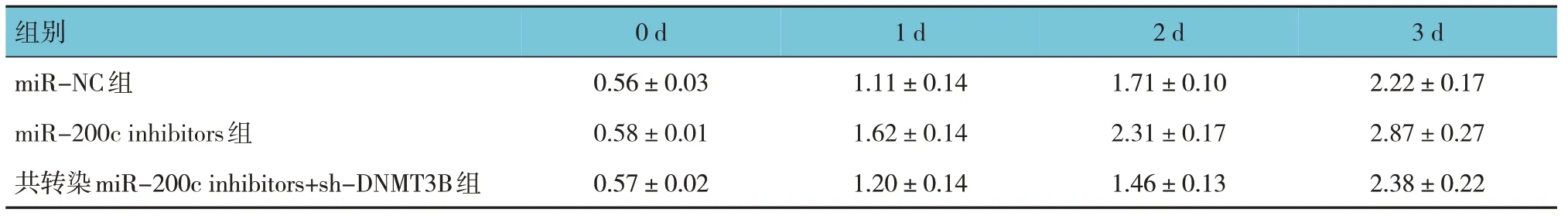
表5 共转染miR-200c inhibitors和sh-DNMT3B对成纤维细胞细胞增殖的影响 (±s)
组别0 d 1 d 2 d 3 d miR-NC组miR-200c inhibitors组共转染miR-200c inhibitors+sh-DNMT3B组0.56±0.03 0.58±0.01 0.57±0.02 1.11±0.14 1.62±0.14 1.20±0.14 1.71±0.10 2.31±0.17 1.46±0.13 2.22±0.17 2.87±0.27 2.38±0.22
表6 共转染miR-200c mimics和sh-DNMT3B对成纤维细胞细胞增殖的影响 (±s)
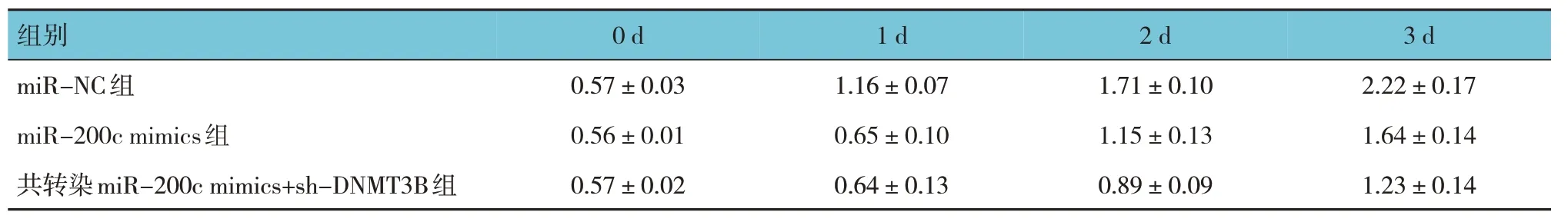
表6 共转染miR-200c mimics和sh-DNMT3B对成纤维细胞细胞增殖的影响 (±s)
组别0 d 1 d 2 d 3 d miR-NC组miR-200c mimics组共转染miR-200c mimics+sh-DNMT3B组0.57±0.03 0.56±0.01 0.57±0.02 1.16±0.07 0.65±0.10 0.64±0.13 1.71±0.10 1.15±0.13 0.89±0.09 2.22±0.17 1.64±0.14 1.23±0.14
3 讨论
在瘢痕疙瘩的研究中,越来越多的研究开始转向LncRNAs 和miRNAs 对瘢痕疙瘩的调控作用[8]。目前采用基因芯片证实在瘢痕疙瘩存在大量异常表达的LncRNAs 和miRNAs,其中有研究显示在瘢痕疙瘩中有1 731 种lncRNAs 表达上调,782 种lncRNAs 表达下调[9]。LncRNAs 能够通过多种途径参与疾病的调控,其中最常见的是ceRNA 机制,即LncRNAs 靶向结合miRNAs,进而调控下游分子的表达。miRNAs 是一类非编码的小RNA,长度只有20~24 nt,在生物体基因组中普遍存在。目前研究证实miRNAs 只占所有RNA 的1.0%左右,但能够调控机体30%~50%基因表达[10]。miRNAs 通过靶向调控靶mRNA,参与细胞增殖、分化、侵袭、迁移和凋亡等多种细胞生物学行为。随着对miRNAs 研究的深入,越来越多的证据表明miRNAs参与瘢痕疙瘩的形成[11]。然而关于LncRNAs 调控miRNAs 在瘢痕疙瘩中的研究尚少。
在本研究中采用qRT-PCR 检测瘢痕疙瘩组织和瘢痕疙瘩成纤维细胞中ATB 相对表达量,结果显示ATB 在瘢痕疙瘩组织中的表达水平明显高于正常皮肤,同时在瘢痕疙瘩成纤维细胞细胞中ATB的表达水平明显高于正常成纤维细胞。这提示ATB在瘢痕疙瘩中存在明显异常表达。在进一步的研究中采用shRNA 干扰技术在成纤维细胞中低表达ATB,结果显示低表达ATB 能够明显抑制细胞增殖,并促进细胞凋亡,同时下调增殖相关分子CDK6,上调凋亡相关分子Caspase-3 的表达水平。这提示ATB 参与瘢痕疙瘩的形成。然而其作用机制有待进一步探讨。
有研究显示miR-152-3p、miR-21、miR-200c和miR-203 在瘢痕疙瘩中均存在异常表达,并参与瘢痕疙瘩的形成[12-14]。同时研究显示LncRNA HOXA11-AS 能够靶向结合miR-124-3p 而抑制Smad5 的表达,参与瘢痕疙瘩细胞外基质的形成[15]。最近有研究显示,ATB 能够通过调控miR-200c 参与结直肠癌的发生发展[16]。在本研究中,双荧光素酶结果显示ATB 能够靶向结合miR-200c,同时在成纤维细胞细胞中转染o/e-ATB 后能够明显抑制miR-200c 的表达水平,在转染sh-ATB 后能够明显促进miR-200c 的表达水平,这说明在成纤维细胞中ATB 能够靶向抑制miR-200c。在进一步的人体瘢痕疙瘩组织中也正证实ATB 与miR-200c 的表达水平呈负相关。
为证实miR-200c 在成纤维细胞中发挥的作用,采用miR-200c mimics 过表达miR-200c 后能够明显抑制细胞增殖,并促进细胞凋亡,同时下调增殖相关分子CDK6 和上调凋亡相关分子Caspase-3 的表达水平。这一结果与低表达ATB 对成纤维细胞的作用相似,更进一步提示ATB 能够靶向结合miR-200c 而抑制miR-200c 的表达水平。
DNA 甲基化是表观遗传学中一种重要的修饰方式,主要是通过DNA 甲基转移酶(DNA methyltransferase, DNMT)来催化和维持起作用[17]。DNMT家族成员在生命的各种活动中均发挥重要作用,包括DNMT1、DNMT2、DNMT3A 和DNMT3B,后两者主要在哺乳动物中发挥作用[18]。DNMT3B 是从头DNA 甲基化转移酶,可以不需要甲基化的DNA 作模板,即可完成非甲基化的DNA 的甲基化修饰,研究显示DNMT3B 参与了肿瘤、血管性疾病和免疫性疾病等[19]。同时也有研究显示DNMT3B 在瘢痕组织中的表达水平明显升高[20]。在本研究中双荧光素酶结果显示miR-200c 能够靶向结合DNMT3B,同时在成纤维细胞细胞中转染miR-200c mimics 后能够明显抑制DNMT3B 蛋白的表达水平,在转染miR-200c inhibitors 后能够明显促进DNMT3B 蛋白的表达。 这进一步提示miR-200c 能够靶向结合DNMT3B,进而抑制DNMT3B 的表达。同时miR-200c 与DNMT3B 在瘢痕疙瘩组织中的表达水平呈负相关,ATB 与DNMT3B 在瘢痕疙瘩组织中的表达水平呈正相关,这提示ATB 可能通过靶向抑制miR-200c,进而促进DNMT3B 的表达,最后参与成纤维细胞细胞增殖和凋亡。
在进一步的回复验证试验中,已证实lncRNAATB/miR-200c/DNMT3B 轴在瘢痕疙瘩成纤维细胞中的作用。结果显示在瘢痕疙瘩成纤维细胞中共转染sh-ATB 和miR-200c inhibitors 能够逆转单独转染sh-ATB 对细胞增殖和凋亡的影响,共转染o/e-ATB和miR-200c inhibitors 能够进一步加强单独转染o/e-ATB 对细胞增殖和凋亡的影响;瘢痕疙瘩成纤维细胞中共转染miR-200c inhibitors 和sh-DNMT3B 能够逆转单独转染miR-200c inhibitors 对细胞增殖和凋亡的影响,共转染miR-200c mimics 和sh-DNMT3B能够进一步加强单独转染miR-200c mimics 对细胞增殖和凋亡的影响。这进一步证实ATB 能够通过调控miR-200c/ DNMT3B 通路参与成纤维细胞增殖和凋亡。
综上所述,ATB 在瘢痕疙瘩组织中高表达,低表达ATB 能够通过调控miR-200c/DNMT3B 通路,抑制成纤维细胞增殖,并促进细胞凋亡。lncRNAATB/miR-200c/DNMT3B 轴在瘢痕疙瘩成纤维细胞的增殖和凋亡中发挥着重要作用。ATB 可能成为瘢痕疙瘩治疗的新靶点。
